Влияние гиперпролактинемии на основные показатели жирового обмена
30.01.2004
Пролактин (ПРЛ), относящийся к семейству гипофизарных пептидных гормонов, принимает активное участие в нормальном течении и развитии беременности, формировании материнской доминанты и непосредственно отвечает за процессы лактогенеза и лактопоэза. Однако ПРЛ — это не только гормон «беременности и лактации». Так, например, множественные воздействия, оказываемые ПРЛ на иммунную систему, сводятся не только к стимуляции Т-лимфоцитов, но и к активации синовиальных фибробластов суставов и способствуют, таким образом, развитию ревматоидного артрита, что позволяет предположить участие гормона во многих системных процессах, в том числе и иммунопатологических.
Известно метаболическое действие ПРЛ на ткань молочной железы, которое проявляется в стимуляции поглощения глюкозы и липогенезе. Пролактин, усиливая образование соответствующих м-РНК, повышает синтез казеина и a-лактальбумина, активируя тем самым синтез молока. Учитывая эти свойства, можно предположить и то, что пролактин оказывает системное влияние на углеводный и жировой обмен.
Принимая во внимание тот факт, что подавляющее большинство пациенток с гиперпролактинемическим гипогонадизмом (ГГ), обращающихся к эндокринологам или гинекологам, находятся в репродуктивном возрасте, перед эндокринологами встает задача не просто медикаментозного купирования гиперпролактинемии, но и восстановления фертильности. Как показали многочисленные работы, посвященные исследованию потомства женщин с гиперпролактинемическим гипогонадизмом, парлодел-индуцированные беременности протекают без каких-либо специфических осложнений. Среди детей, зачатых на фоне приема дофаминомиметиков, те или иные соматические или психические патологии наблюдаются не чаще, чем у детей, родившихся от спонтанных беременностей.
Хорошо известны клинические проявления ГГ: галакторея, нарушения, менструального цикла различной степени тяжести, поражения перекреста зрительных нервов при супраселлярном распространении опухоли, развитие остеопении и остеопороза.
Роль пролактина в регуляции энергетического баланса, жирового и углеводного обмена до настоящего времени не до конца выяснена. Данные современной литературы относительно влияния повышенного уровня пролактина на состояние липидного и углеводного обмена человека противоречивы, однако предположить наличие связей между пролактином и углеводным обменом несложно. Гиперпролактинемия, ведущая к гипоэстрогении, может вызывать изменения липидного спектра, аналогичные нарушениям у здоровых женщин в менопаузе: увеличение содержания общего холестерина сыворотки крови (ХС), повышение концентрации липопротеидов низкой плотности (ЛПНП) и липопротеидов очень низкой плотности (ЛПОНП) с одновременным снижением липопротеидов высокой плотности (ЛПВП). Доказано, что перечисленные нарушения способствуют повышению атерогенности плазмы крови, увеличивают риск развития ишемической болезни сердца, артериальной гипертензии, ожирения, СД 2 типа у женщин в менопаузе.
В исследовании M. Matsuda и соавт., посвященном изучению влияния хронической гиперпролактинемии на содержание глюкозы и инсулина у мышей, было достоверно доказано повышение содержания этих показателей в течение 12 месяцев наблюдения после искусственно вызванной гиперпролактинемии.
И. И. Дедов и Г. А. Мельниченко отмечали, что до 49% пациенток с диагнозом «гиперпролактинемический гипогонадизм» предъявляли жалобы на избыточную массу тела.
По данным В. А. Черноголова, избыток массы тела (ИМТ > 25,0 кг/м²) был выявлен у 40% пациенток с умеренной гиперпролактинемией и микроаденомой гипофиза, у 34,7% пациенток с идиопатической гиперпролактинемией и у 45,5% женщин с выраженной гиперпролактинемией, обусловленной макропролактиномами.
U. Fahy и соавт. провели исследование липидного спектра плазмы крови среди пациенток с ГГ и в контрольной группе женщин, а также оценили влияние терапии дофаминомиметиками на содержание липидов. При определении содержания общего холестерина, триглицеридов, ЛПНП, ЛПОНП, ЛПВП достоверных отличий между обследуемыми группами выявлено не было, однако на фоне назначения бромокриптина произошло достоверное снижение показателя общего холестерина. Ссылаясь на полученные данные, авторы предлагают включать пациенток с гиперпролактинемическим гипогонадизмом в группу риска по развитию сердечно-сосудистых заболеваний, а улучшение состояния липидного спектра связывают с нормализацией функции яичников.
В другой работе проводились тесты, как оральный глюкозотолерантный, так и с аргинином, с целью выяснения типа нарушений в углеводном обмене и секреции инсулина. В исследование были включены пациентки с гиперпролактинемией и нормальным ИМТ (группа 1), пациентки с ожирением (группа 2), в группу контроля вошли здоровые женщины с нормальным ИМТ без гиперпролактинемии (группа 3). Содержание инсулина в ответ на стимуляцию глюкозой per os не отличалось во всех обследованных группах. При стимуляции секреции инсулина аргинином в группах пациенток с гиперпролактинемией и ожирением были получены результаты, достоверно превышающие показатели группы контроля. Площадь под кривой составила 4219,4±631,7 и 4107,3±643,2 млЕД х мин х 1(-1) соответственно, в группе контроля — 2178,1±290,9 млЕД х мин х 1(-1). Полученные данные не позволяют сомневаться в предрасположенности пациенток с ГГ к гиперинсулинемии. Вместе с тем, при оценке показателей углеводного обмена с помощью внутривенного глюкозотолерантного теста у женщин детородного возраста с гиперпролактинемией и не отягощенным по сахарному диабету анамнезом, а также в контрольной группе среди здоровых женщин фертильного возраста не было выявлено отличий исходных уровней глюкозы и инсулина в обеих группах. На фоне нагрузки не зарегистрировано нарушений в толерантности к углеводам или развития сахарного диабета.
Исследование, проведенное M. Orbetzova и соавт., в котором приняли участие 126 пациентов, посвященное выявлению метаболического синдрома у пациенток с гиперпролактинемическим гипогонадизмом, не позволило подтвердить, что пролактин является диабетогенным гормоном, однако продемонстрировало, что гиперпролактинемия сочетается с гиперхолестеринемией — у 19,4% обследованных, с гипертриглицеридемией — в 15,2% случаев, с сочетанной дислипидемией в 10,9% случаев. Избыток массы тела фиксировался в 59,7%, а ожирение — в 23,2% случаев. Повышение содержания гликемии в финале орального глюкозотолерантного теста диагностировано у 82,6% обследованных. Сочетание ожирения, нарушений углеводного обмена и артериальной гипертензии выявлено у 23,2% пациентов. Таким образом, наиболее вероятно, что гиперпролактинемия вмешивается в патогенетический процесс развития липидных нарушений и ожирения, а длительное существование подобных нарушений неизменно ведет к формированию патологии углеводного обмена.
В ретроспективном исследовании Y. Greenman и соавт. проанализировали истории болезней пациентов, прооперированных в период с 1989 по 1996 гг. по поводу пролактинсекретирующих аденом гипофиза, в качестве группы контроля фигурировали пациенты с нефункционирующими аденомами гипофиза. Отмечено преобладание избытка массы тела в первой группе: 93±3,4 кг, по сравнению со второй — 78±2,7 кг. Увеличение массы тела на 8–22 кг имело место у 13 из 42 пациенток с ГГ, в отличие от второй группы, где аналогичную жалобу предъявила только одна пациентка. При назначении терапии, направленной на снижение концентрации пролактина, 17 из 42 пациенток отметили снижение веса, средний показатель составил 8,3±1,5 кг (2–28 кг). У 14 из 18 пациенток масса тела не изменилась, а содержание пролактина осталось повышенным, несмотря на терапию агонистами дофамина. У пациенток с НФА достоверного снижения массы тела выявлено не было. Полученные результаты позволяют включить гиперпролактинемию в список заболеваний, сопровождающихся ожирением, и рекомендовать при дифференциальной диагностике эндокринных форм ожирения определять содержание пролактина сыворотки крови.
В клинике эндокринологии ММА им. И. М. Сеченова проводилось исследование состояния липидного обмена пациенток с гиперпролактинемическим гипогонадизмом различной этиологии. Первую группу с опухолевой формой гиперпролактинемии (n=38) составили женщины репродуктивного возраста с уровнем ПРЛ, превышающим 1000 мкМЕ/мл как минимум дважды, а также наличием инструментально подтвержденной (с помощью МРТ) аденомы гипофиза, микро- или макропролактиномы. Во вторую группу (n=10) вошли женщины репродуктивного возраста с отсутствием объемных образований гипофиза (идиопатическая ГГ) и повышением уровня пролактина до 1000 мкМЕ/мл. При клиническом обследовании больных с различными формами ГГ были выявлены пациентки с избыточной массой тела различной степени выраженности (табл.).
При определении содержания уровня пролактина в сыворотке крови было получено статистически значимое различие в концентрации гормона между группами с опухолевой и идиопатической формами: 1803,3±1182,1 мкМЕ/мл и 3 мкМЕ/мл (р=0,001) соответственно.
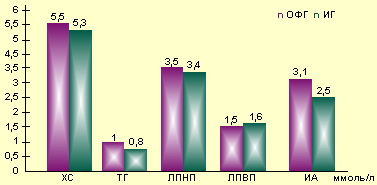
|
| Рисунок 1. Содержание ХС и фракций липопротеидов у пациенток с опухолевой (ОФГ) и неопухолевой (ИГ) формами гиперпролактинемии |
Основной задачей исследования была оценка показателей липидного спектра у пациенток с различными формами гиперпролактинемии, с этой целью было исследовано содержание общего холестерина, триглицеридов (ТГ), липопротеидов низкой плотности, липопротеидов высокой плотности и индекса атерогенности (ИА) у пациенток обеих групп (рис. 1). У пациенток с опухолевым генезом гиперпролактинемии и идиопатической формой заболевания было обнаружено повышение содержания холестерина до 5,5±1,1 и 5,3 ммоль/л соответственно (р=0,9). В концентрации триглицеридов не было отмечено каких-либо отклонений от нормы; в группах с опухолевой и идиопатической ГГ триглицеридемия составила 1,04±0,5 и 0,8±0,3 ммоль/л соответственно (р=0,3). Содержание липопротеидов низкой плотности в первой группе соответствовало верхней границе нормы (3,5±1,2 ммоль/л), во второй группе этот показатель был несколько ниже — 3,4±0,6 ммоль/л (р=0,9). Содержание ЛПВП находилось в пределах нормы: 1,52±0,37 и 1,6±0,4 ммоль/л (р=0,4) соответственно. Индекс атерогенности в группе с опухолевым генезом гиперпролактинемии составил 2,8±1,1, а в группе с ИГ — 2,5±1,1.
Все показатели липидного обмена в группе с опухолевой ГГ, за исключением содержания ЛПВП, превышали соответствующие в группе с идиопатической ГГ. Тем не менее полученные результаты не позволяют утверждать, что нарушения липидного обмена у пациенток с опухолевым генезом гиперпролактинемии превалируют в сравнении с идиопатической ГГ. Возможно, имеют значение не только форма гиперпролактинемии, но и сам факт повышения уровня пролактина, степень увеличения содержания гормона либо длительность заболевания.
Отмеченные при различных формах гиперпролактинемического гипогонадизма нарушения липидного спектра относятся к семейной смешанной гиперлипопротеидемии, в основе которой лежит генетический дефект, характеризующийся избыточной продукцией апопротеина В100. В этом случае имеет место повышение содержания ЛПНП и ЛПОНП, атерогенность которых доказана, фенотип липопротеидов IIa и IIb. Содержание ХС и ТГ при этом может быть нормальным или умеренно повышенным.
В ходе настоящего исследования патогенетическая терапия агонистами дофамина была назначена 38 женщинам с опухолевой формой заболевания, тогда как 10 пациенток с идиопатической гиперпролактинемией не получали лечения вовсе (группа контроля). На фоне назначения агонистов дофамина нормализация содержания пролактина отмечалась у 34 пациенток с опухолевой ГГ. Необходимо сказать, что в группе ИГ происходило спонтанное снижение содержания пролактина. Однако через 6 и 12 месяцев лечения (р=0,004) его средняя концентрация превышала норму и составила 830,5±207,3 мкМЕ/мл (рис. 2).
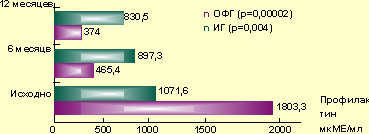
|
| Рисунок 2. Динамика содержания пролактина в обследованных группах на фоне лечения АД (мкМЕ/мл) и без лечения |
За время наблюдения и лечения из 29 пациенток с опухолевым генезом гиперпролактинемии, предъявивших при первом визите жалобы на увеличение массы тела, у 23 зафиксировано снижение веса, в среднем составившее 3,5±1,2 кг (рис. 3).
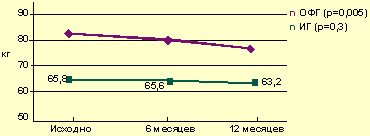
|
| Рисунок 3. Динамика массы тела в группах с опухолевым генезом ГГ и идиопатической формой заболевания |
При анализе изменений, произошедших в содержании фракций липопротеидов у пациенток с опухолевой формой гиперпролактинемического гипогонадизма, на фоне терапии агонистами дофамина были получены данные (рис. 4), свидетельствующие о достоверном снижении содержания холестерина, липопротеидов низкой плотности и индекса атерогенности: ХС1 5,5±1,1 ммоль/л и ХС3 5,3±0,9 ммоль/л (р=0,04); ЛПНП1 3,5±1,2 ммоль/л и ЛПНП2 3,2±1,0 ммоль/л (р=0,03); ИА1 2,8±1,1 и ИА2 2,4±0,8 (р=0,0006). Содержание ЛПВП увеличивалось не достоверно, а концентрация ТГ, снижаясь в течение первого полугодия, вновь нарастала в течение последующих 6 месяцев: ТГ1 1,04±0,5 ммоль/л, ТГ2 0,87±0,3 и ТГ3 1,3±0,5 ммоль/л.
Таким образом, клиника гиперпролактинемического гипогонадизма опухолевой этиологии сводится не только к проявлениям патологии репродуктивной сферы и неврологической симптоматике, но может сопровождаться и разнообразными метаболическими нарушениями: избыточной массой тела различной степени выраженности; развитием дислипо- и гиперлипидемий. Терапия агонистами дофамина приводит не только к снижению пролактина, нормализации менструальной функции, купированию галактореи и восстановлению фертильности, но и к достоверному снижению массы тела, а также нормализации основных показателей липидного обмена.
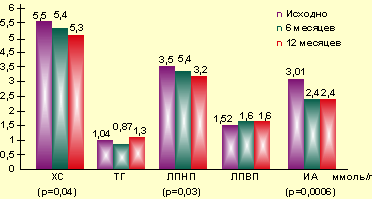
|
| Рисунок 4. Динамика показателей фракций липопротеидов на фоне терапии дофаминомиметиками |
По вопросам литературы обращайтесь в редакцию.
Р. М. Курляндская, кандидат медицинских наук
Т. И. Романцова, доктор медицинских наук, профессор
ММА им. И. М. Сеченова, Москва
Таблица 1. Распределение пациенток с гиперпролактинемическим гипогонадизмом и избыточной массой тела
| ИМТ | Опухолевая форма, n (%) | Идиопатическая форма, n (%) |
| 18,5-24,9 | 9 (23,7) | 8 (80) |
| 25,0-29,9 | 12 (31,6) | 1 (10) |
| 30-34,9 | 10 (26,3) | - |
| 35,0-39,9 | 4 (10,5) | 1 (10) |
| Более 40 | 3 (7,9) | - |
