Состояния, вызванные приемом амиодарона, в практике кардиолога и эндокринолога
27.02.2004
В клинической практике врачам разных специальностей нередко приходится сталкиваться с проблемой назначения препаратов, обладающих не только высокой эффективностью, но и большим спектром побочных действий, которые могут осложнять течение основного заболевания. К таким препаратам относится амиодарон, занимающий ведущее место в лечении потенциально злокачественных и злокачественных форм желудочковых аритмий, но имеющий широкий спектр воздействия на щитовидную железу.
Амиодарон — антиаритмический препарат III класса, был открыт Tondeur и Binon в 1960 г. и с тех пор широко используется в кардиологической практике. Частота его применения достигает 24,1% от общего числа назначений антиаритмических препаратов.
В основном препарат используют для лечения злокачественных форм желудочковых и наджелудочковых аритмий, пароксизмальной суправентрикулярной тахикардии, фибрилляции предсердий, которые рефрактерны к терапии другими антиаритмическими препаратами и сопровождаются высоким риском внезапной сердечной смерти.
Мета-анализ 13 многоцентровых исследований, посвященных первичной профилактике внезапной смерти у пациентов, перенесших инфаркт миокарда или имеющих хроническую недостаточность кровообращения, продемонстрировал способность амиодарона снижать показатели не только аритмической, но и общей летальности.
Так как амиодарон не оказывает выраженного отрицательного инотропного действия на миокард, показано его применение при нарушениях сердечного ритма у больных с застойной сердечной недостаточностью. Он также является средством выбора при лечении и профилактике аритмий у больных с синдромом Вольффа-Паркинсона-Уайта.
Помимо антиаритмического действия у ряда больных препарат оказывает влияние на функцию щитовидной железы, вызывая тиреотоксикоз или гипотиреоз. В течение ряда лет эти изменения являлись одной из причин отмены или отказа от применения амиодарона несмотря на то, что препарат назначался по жизненным показаниям. Продолжающиеся исследования в данном направлении позволили изменить взгляд на проблему и разработать новые подходы к диагностике и лечению указанных нарушений.
Механизм действия амиодарона
Препарат представляет собой йодированную жирорастворимую производную бензофурана, которая по структуре имеет близкое сходство с тироксином. Препарат состоит на 37,5% из йода, приблизительно 10% молекул подвергается дейодированию ежедневно. Высокое содержание йода в амиодароне считается одной из причин возникновения тиреоидной дисфункции. У пациентов, принимающих амиодарон, уровень неорганического йода в моче и плазме увеличивается в 40 раз. Препарат проникает во многие органы и ткани: в печень, легкие, щитовидную железу, миокард, но более всего накапливается в жировой ткани. Период полувыведения амиодарона составляет от 30 дней до 5 месяцев.
Механизм воздействия амиодарона на щитовидную железу
Установлено, что у 1/3 пациентов в процессе лечения амиодароном наблюдается повышение уровня общего и свободного тироксина (Т4), реверсивного (неактивного) трийодтиронина (ТЗ), уменьшение уровня ТЗ. Это обусловлено подавлением активности 5-дейодиназы I типа, нарушающего конверсию Т4 в Т3 в периферических тканях, особенно в печени. Подавление активности 5-дейодиназы может сохраняться на протяжении нескольких месяцев и после отмены препарата. Кроме того, препарат снижает проникновение тиреоидных гормонов в клетки периферических тканей. В конечном итоге оба механизма способствуют развитию доброкачественной формы эутиреоидной гипертироксинемии, с повышенным уровнем общего и свободного Т4, рТЗ, нормальным или субнормальным ТЗ. Не-смотря на повышенный уровень св Т4 [14,7;23,2], у пациентов не отмечается признаков тиреотоксикоза (рис. 1).
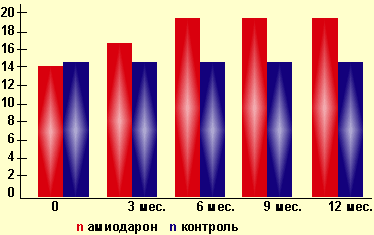
|
| Рисунок 1. Динамика показателей свТ4 у пациентов, принимающих амиодарон (контроль — пациенты с ИБС, не принимающие амиодарон) |
Эутиреоидная гипертироксинемия не требует медикаментозной коррекции, а диагноз тиреотоксикоза не должен основываться на одном только обнаружении повышенного уровня тироксина у больных, получающих амиодарон. По нашим данным, развитие эутиреоидной гипертироксинемии не приводит к утрате амиодароном антиаритмической эффективности и рецидивам предшествующих нарушений сердечного ритма. Пациенты должны оставаться под динамическим наблюдением с периодическим мониторированием функционального состояния щитовидной железы.
В процессе лечения амиодароном у ряда больных может произойти изменение уровня ТТГ в сыворотке крови без клинических проявлений нарушения функции щитовидной железы. Повышение концентрации ТТГ у клинически эутиреоидных пациентов зависит как от дозы, так и от длительности приема препарата. Так, при ежедневном приеме 200–400 мг амиодарона уровень ТТГ обычно находится в пределах нормы. При более высокой дозе препарата увеличение концентрации ТТГ может произойти в первые месяцы приема, с последующим возвращением к норме (табл. 1).
Амиодарон снижает чувствительность клеток, особенно кардиомиоцитов, к тиреоидным гормонам, приводя к «местному», тканевому гипотиреозу. Развитию этого состояния способствуют взаимодействие амиодарона с рецепторами тиреоидных гормонов, сокращение числа катехоламиновых рецепторов и снижение эффекта ТЗ на кардиомиоциты.
На клеточном уровне амиодарон действует как антагонист тиреоидных гормонов. Наиболее активный метаболит амиодарона, диэтиламиодарон (ДЭА), действует как конкурентный ингибитор присоединения трийодтиронина к α-1-ТЗ-рецептору и как неконкурентный ингибитор β-1-ТЗ-рецептора. Действие ДЭА зависит от его концентрации в различных тканях. При низкой концентрации ДЭА может выступать как агонист действия ТЗ и только при больших концентрациях — как антагонист ТЗ. Известно, что α-1-ТЗ-рецепторы находятся в основном в сердечной и скелетной мускулатуре, тогда как в печени, почках и мозге преобладают β-1-ТЗ-рецепторы. Следовательно, при достаточной концентрации амиодарон действует как конкурентный ингибитор Т3, обусловливая развитие «местного» гипотиреоза в сердечной мышце. Кроме того, исследования последних лет показали, что амиодарон вызывает мутацию гена ядерного рецептора Т3.
Снижение проникновения Т3 в кардиомиоциты оказывает антиаритмический эффект за счет изменения экспрессии генов ионных каналов и других функциональных белков. Амиодарон непосредственно влияет на ионные каналы, вне зависимости от его воздействия на тиреоидные гормоны. Экспериментально доказано, что амиодарон способен ингибировать Nа-К-АТФ-азу. Препарат блокирует несколько ионных токов на мембране кардиомиоцита: выход ионов К во время фаз реполяризации, а также вход ионов Na и Ca.
Кроме вышеописанных эффектов амиодарон и его метаболит ДЭА оказывают цитотокическое действие на щитовидную железу.
Экспериментальными исследованиями установлено, что амиодарон и его метаболит вызывают лизис клеток линии человеческих тиреоцитов, а также нетиреоидной ткани. Амиодарон оказывает самостоятельный, токсический эффект, усиливаемый содержанием йода в молекуле, при этом его активный метаболит ДЭА обладает большей цитотоксичностью и его интратиреоидная концентрация выше, чем у самого препарата.
В литературе широко обсуждается вопрос о влиянии амиодарона на течение аутоиммунных процессов в щитовидной железе. Предполагается, что избыток йода, высвобождаемый из амиодарона, может приводить к индукции или манифестации аутоиммунных изменений в щитовидной железе. Классическими маркерами аутоиммунного процесса являются антитела к тиреоглобулину (ТГ) и пероксидазе (ТПО). У ряда пациентов антитела к пероксидазе регистрируются как на ранних этапах лечения, так и в течение 6 мес. после отмены препарата. По мнению ряда исследователей, этот феномен объясняется ранним токсическим эффектом амиодарона на щитовидную железу, приводящим к высвобождению аутоантигенов и последующему запуску иммунных реакций. С другой стороны, у большинства лиц, получающих амиодарон, не отмечается увеличения частоты встречаемости тиреоидных антител.
Амиодарон-ассоциированная дисфункция щитовидной железы
У большинства больных, принимающих амиодарон, сохраняется эутиреоз. Тем не менее у некоторых пациентов могут развиться нарушения функции щитовидной железы.
Возникновение гипотиреоза объясняется длительным блоком органификации йода и нарушением синтеза тиреоидных гормонов (эффект Вольфф-Чайкова). В развитие этого состояния вносит вклад и ингибирование тиреоидных рецепторов в тканях.
По современным представлениям, в основе патогенеза другой дисфункции щитовидной железы — тиреотоксикоза, развивающегося на фоне приема амиодарона, — лежат 2 основных механизма, приводящих к формированию 2 вариантов амиодарон-ассоциированного тиреотоксикоза (АмАТ):
- амиодарон-ассоциированный тиреотоксикоз I типа, обусловленный повышением синтеза тиреоидных гормонов в существующих зонах автономии в железе под действием йода, высвобождаемого из препарата. АмАТ I типа развивается в основном у лиц с исходной патологией щитовидной железы, включая узловой зоб, автономию или диффузный токсический зоб;
- амиодарон-ассоциированный тиреотоксикоз II типа, описанный у пациентов без предшествующих или сопутствующих заболеваний щитовидной железы и связанный с развитием деструктивных процессов, причиной которых является действие самого амиодарона, а не только йода (т. е. форма лекарственного тиреоидита).
Клинические особенности и лечение нарушений функции щитовидной железы на фоне приема амиодарона
Амиодарон-ассоциированный гипотиреоз. Распространенность гипотиреоза на фоне приема амиодарона варьирует от 6% в странах с низким потреблением йода до 13% с высоким потреблением йода.
Наиболее часто гипотиреоз встречается у пожилых людей и женщин, которые наиболее подвержены развитию гипотиреоза (отношение полов 1,5:1).
По данным нашего исследования, среди пациентов с амиодарон-ассоциированным гипотиреозом органическая патология щитовидной железы выявлена в 70,8% случаев (в основном аутоиммунный тиреоидит) (рис. 2).
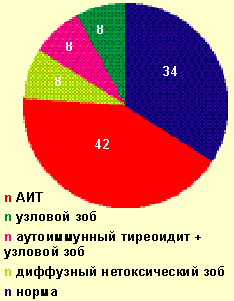
|
| Рисунок 2. Структура патологии щитовидной железы у лиц с гипотиреозом, развившимся на фоне приема амиодарона (%) |
В клинической картине отмечаются классические признаки гипотиреоза: утомляемость, сухость кожи, зябкость, запоры, сонливость, ухудшение внимания, отечный синдром, брадиаритмии и др. Субклинический вариант протекает бессимптомно, но возможно нарушение липидного обмена (повышение ЛПНП, коэффициентов обХс/ЛПВП, ЛПНП/ЛПВП и снижение ЛПВП), ухудшение памяти, депрессия.
Диагностика этого состояния основана на определении сниженного уровня свободного Т4 и повышенного ТТГ (обычно > 10mU/l) или нормального уровня свободного Т4 при повышенном уровне ТТГ при субклиническом варианте течения. Уровень Т3 не является надежным индикатором, так как при гипотиреозе он может быть в пределах нормы или даже несколько повышен в результате компенсаторного дейодирования Т4 в биологически более активный Т3.
Лечение амиодарон-ассоциированного гипотиреоза. С амиодарон-индуцированным гипотиреозом можно бороться 2 способами: либо отменить амиодарон, либо подобрать заместительную терапию тиреоидными гормонами. После отмены амиодарона эутиреоз обычно восстанавливается, но на это могут потребоваться месяцы в связи с длительным периодом выведения лекарства. Часто на практике отмена амиодарона невозможна, так как препарат применяется по жизненным показаниям, особенно для лечения тяжелых желудочковых тахиаритмий. В таких случаях лечение амиодароном продолжают. Пациентам назначается L-тироксин. Уровень ТТГ снижается обычно до верхней границы нормы. Рекомендуется начинать заместительную терапию тиреоидными гормонами с минимальных доз 12,5–25 мкг/сут с постепенным повышением ее под контролем ТТГ с интервалом в 4–6 нед. до достижения эффекта, не допуская при этом декомпенсации кардиальной патологии или развития аритмии. При субклиническом течении гипотиреоза вопрос о заместительной терапии решается индивидуально. Назначение L-тироксина может быть показано при сопутствующем нарушении липидного профиля, депрессии, повышении уровня ТТГ более чем на 10 МЕ/л, причем подбирается минимально эффективная доза для коррекции выявленных нарушений. Пациент должен оставаться под наблюдением с целью оценки динамики состояния на фоне лечения первые 6 нед., а затем каждые 3 мес. При отсутствии изменений в лабораторных показателях липидного спектра и клинической симптоматике препарат отменяют.
Амиодарон-ассоциированный тиреотоксикоз. По статистике АмАТ развивается в 2–12 % случаях при постоянном приеме препарата. Некоторые исследования показали, что распространенность варьирует в зависимости от потребления йода с пищей. В популяции АмАТ превалирует в районах с низким потреблением йода (например, Центральная Европа) и редко встречается в районах, где пища насыщена йодом (например, Северная Америка, Великобритания).
По нашим данным, среди пациентов с АмАТ, проживающих в районе легкого и умеренного йодного дефицита (Москва и Московская область), преобладали лица с измененной щитовидной железой (61%), в основном с узловыми зобами и аутоиммунным поражением щитовидной железы (рис. 3).
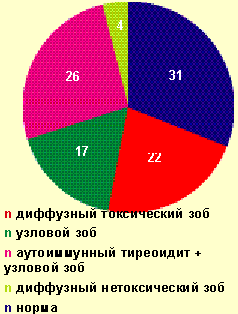
|
| Рисунок 3. Структура патологии щитовидной железы у лиц с тиреотоксикозом, развившимся на фоне приема амиодарона |
Частота тиреотоксикоза не зависит от суточной и кумулятивной дозы амиодарона. Необходимо отметить, что между началом приема препарата и развитием тиреотоксикоза может проходить достаточно долгое время (до 3 лет). Более того, описаны случаи возникновения этого состояния через несколько месяцев после отмены амиодарона.
Клинические особенности АмАТ определяются тем, что это состояние преимущественно развивается у лиц пожилого возраста. Обычные симптомы тиреотоксикоза — зоб, похудание, потливость, тремор пальцев рук — могут быть выражены незначительно или вовсе отсутствовать. В клинической картине доминируют сердечно-сосудистые и психические расстройства. Серьезную опасность представляют именно кардиальные эффекты избытка тиреоидных гормонов, такие, как ухудшение течения сопутствующих форм аритмий, учащение приступов ИБС. Повышенная чувствительность к адренергической стимуляции при тиреотоксикозе может увеличивать частоту желудочковых аритмий, особенно у больных с предшествовавшей сердечной патологией.
Токсическое действие тиреоидных гормонов на центральную нервную систему приводит к развитию тиреотоксической энцефалопатии, которая проявляется нервной возбудимостью, эмоциональной лабильностью, нарушением сна. Однако у больных пожилого возраста, как правило, доминируют противоположные признаки: психическая заторможенность, апатия, отсутствие аппетита, слабость, адинамия, депрессия, что может затруднять диагностику АмАТ.
Дифференциальная диагностика АмАТ I и АмАТ II типов
Для клинициста важно дифференцировать 2 формы АмАТ для выбора правильной тактики ведения пациентов.
Как было сказано выше, АмАТ I типа развивается на фоне существующих или предшествующих заболеваний щитовидной железы. Помимо изменений гормонального спектра и определения повышенного титра антитиреоидных антител (в случаях манифестации диффузного токсического зоба), АмАТ I типа характеризуется нормальным или, гораздо реже, сниженным захватом радиофармпрепарата, при УЗИ отмечаются признаки узлового зоба или аутоиммунного зоба с нормальным или повышенным кровотоком.
АмАТ II типа развивается на фоне интактной железы. Главная клиническая особенность этих форм — внезапное развитие и тяжесть тиреотоксикоза, в том числе развитие болевых форм, клинически похожих на подострый тиреоидит. При исследовании с радиоактивным йодом отмечается снижение накопления препарата в железе. В биоптате щитовидной железы, полученном при тонкоигольной биопсии или после хирургического вмешательства, отмечается большое количество коллоида, инфильтрация макрофагами, деструкция тиреоцитов. Часто наблюдается отсутствие или снижение кровотока в щитовидной железе, определяемое при УЗИ с доплерографией.
Обсуждается роль повышенной концентрации ИЛ-6 как маркера этого состояния, однако в нашем исследовании мы не обнаружили существенных различий в уровне ИЛ-6 и косвенного показателя активности ИЛ-6 — С-реактивного белка у лиц с АмАТ I и II типов и пациентов с аутоиммунным тиреотоксикозом.
Кроме этих 2 форм в практике клинициста могут встречаться смешанные варианты течения этого осложнения с чертами АмАТ I и II типов.
У пациентов с деструктивным тиреотоксикозом из-за действия амиодарона позже может развиться гипотиреоз. Сводные данные об отличии двух форм представлены в таблице 2.
Основным и наиболее ранним проявлением амиодарон-ассоциированного тиреотоксикоза в наших исследованиях стала потеря антиаритмической эффективности амиодарона во всех случаях. У пациентов с пароксизмами желудочковой тахикардии мерцательной аритмии отмечалось рецидивирование нарушений ритма сердца. У больных с желудочковой экстрасистолией по результатам суточного мониторирования ЭКГ наблюдалось увеличение общего количества парных желудочковых экстрасистол и пробежек желудочковой тахикардии на 61,7, 83,5 и 85% соответственно, по сравнению с показателями, регистрировавшимися до развития тиреотоксикоза.
Лечение амиодарон-ассоциированного тиреотоксикоза. В отличие от гипотиреоза, который сравнительно легко лечится заместительной терапией тиреоидными гормонами, компенсация тиреотоксикоза сопряжена со многими трудностями и требует индивидуального подхода в каждом случае.
У пациентов с легким тиреотоксикозом, исходно неизмененной щитовидной железой и небольшим зобом тиреотоксикоз устраняется после отмены препарата. Наоборот, у пациентов с предшествующими заболеваниями щитовидной железы тиреотоксикоз, как правило, не проходит без лечения даже спустя несколько месяцев после окончания терапии амиодароном.
Отмена амиодарона возможна только в тех случаях, когда нарушения сердечного ритма не опасны для жизни и могут быть нивелированы альтернативными антиаритмическими препаратами.
Для лечения тиреотоксикоза применяют тионамиды, пропилтиоурацил, высокие дозы глюкокортикоидов, плазмаферез, оперативное лечение. За рубежом используют конкурентный ингибитор захвата йода щитовидной железой — перхлорат калия.
Для компенсации тиреотоксикоза требуются большие дозы антитиреоидных препаратов (например, метизола 40–60 мг или пропицила 300—600 мг) для ингибирования синтеза гормонов. Для нормализации уровня свободного Т4 может потребоваться 6–12 нед. и более. Длительная терапия высокими дозами тиреостатиков обычно необходима пациентам, которые продолжают получать амиодарон по жизненным показаниям. Некоторые исследователи предпочитают продолжать терапию поддерживающими дозами тиреостатиков, с тем чтобы сохранить полный или частичный блок синтеза тиреоидных гормонов в течение всего периода терапии амиодароном. В случае развития гипотиреоза к лечению добавляется L-тироксин.
Одним из главных фактов патогенеза АмАТ II типа, особенно возникшего у лиц без предшествующих изменений щитовидной железы, служит развитие деструктивного тиреоидита и выход ранее синтезированных гормонов в кровоток. В такой ситуации предлагается использовать глюкокортикоиды. Преднизолон назначается в дозе 30–40 мг/сут. Курс лечения может продолжаться до 3 мес., так как описаны случаи возвращения симптомов тиреотоксикоза при попытке снизить дозу препарата.
В случае развития гипотиреоза у пациентов, перенесших АмАТ II типа, к лечению добавляется L-тироксин. По показаниям к проводимой терапии добавляются пропранолол и другие симптоматические средства.
При тяжелом течении амиодарон-ассоциированного тиреотоксикоза (обычно при сочетании 2 форм) используют комбинацию тионамида и глюкокортикоида. У некоторых пациентов комбинированная лекарственная терапия может быть неэффективной, что требует хирургического вмешательства. Оперативное лечение, как правило, проводится в случае невозможности достижения компенсации заболевания после длительного (около 6 мес.) курса медикаментозной терапии или при сочетании амиодарон-ассоциированного тиреотоксикоза с узловым зобом. Несмотря на риск тиреотоксического криза во время анестезии и хирургического вмешательства, в мире накоплен опыт лечения таких больных, показавший, что субтотальная резекция щитовидной железы позволяет быстро добиться ремиссии тиреотоксикоза и продолжить антиаритмическую терапию. При крайне тяжелом состоянии используют плазмаферез.
Радиоактивный йод обычно не эффективен в лечении пациентов с АмАТ, так как большая концентрация йода предотвращает достаточное поглощение щитовидной железой радиоизотопа. Кроме того, это может привести к усилению тиреотоксикоза в результате высвобождения гормонов. Однако в районах с пограничным уровнем йодного дефицита пациенты с диффузным или узловым зобом, у которых наблюдается нормальное или повышенное поглощение радиоизотопа, несмотря на прием амиодарона, могут отвечать на терапию радиоактивным йодом.
Как было отмечено выше, амиодарон назначается при тяжелых, жизнеугрожающих аритмиях, часто рефрактерных к другой терапии. Отмена препарата в такой ситуации может быть недопустима по жизненным показаниям. Поэтому в лечебной практике в случае невозможности прекращения приема антиаритмика компенсацию тиреотоксикоза проводят на фоне продолжающейся терапии амиодароном. Более того, поскольку препарат и его метаболит ДЭA вызывают развитие «местного гипотиреоза», это, как ни парадоксально, защищает сердце от действия избытка тиреоидных гормонов, поэтому отмена препарата может усилить токсическое действие тиреоидных гормонов на сердце. В литературе описаны случаи успешного ведения пациентов с тиреотоксикозом без отмены амиодарона, поэтому в каждом конкретном случае решение о смене антиаритмического препарата должно приниматься индивидуально, совместно кардиологом и эндокринологом. Ряд авторов предполагают, что даже в тех случаях, когда планируется отмена препарата, пациенты должны принимать амиодарон, пока тиреотоксикоз не будет полностью компенсирован.
Мониторинг тиреоидной функции
Всем пациентам, которым планируется назначение амиодарона, необходимо провести исследование функционального состояния щитовидной железы и ее структуры. Это позволяет не только выявить наличие тиреоидной патологии, но и прогнозировать возможное развитие тиреотоксикоза или гипотиреоза после начала терапии.
План обследования щитовидной железы до назначения препарата включает: определение ТТГ; определение свободного Т4 при измененном уровне ТТГ; УЗИ щитовидной железы; определение уровня антител к ТПО; сцинтиграфию щитовидной железы — при подозрении на автономию (снижение уровня ТТГ, наличие узлового/многоузлового зоба); пункционную биопсию щитовидной железы (при наличии узлов, подозрении на новообразование).
Присутствие антител к ТПО увеличивает риск развития амиодарон-ассоциированного гипотиреоза у пациентов с аутоиммунным тиреоидитом, особенно во время первого года лечения.
Повторное определение уровня свТ4, ТТГ можно повторить через 3 мес. от начала терапии, а затем через каждые 6 мес. При нормальных показателях мониторинг осуществляется по уровню ТТГ 1-2 раза в год, особенно у пациентов с измененной щитовидной железой.
В случае наличия патологии щитовидной железы до лечения или развития ее на фоне приема препарата проводится лечение по вышеуказанным рекомендациям.
Напомним, что появление рефрактерности к антиаритмической терапии может быть ранним признаком манифестации амиодарон-ассоциированного тиреотоксикоза.
Амиодарон на сегодняшний день является наиболее эффективным и широко используемым препаратом для лечения и профилактики угрожающих жизни желудочковых нарушений сердечного ритма и различных других форм сердечных аритмий. Однако, как и любой фармакологический препарат, он может вызывать нежелательные эффекты со стороны различных органов и тканей, что осложняет его использование. Одним из самых распространенных таких эффектов является нарушение функционального состояния щитовидной железы, что обусловлено фармакологическими особенностями препарата — высоким содержанием йода в его молекуле.
Среди пациентов старшей возрастной группы, получающих амиодарон, наиболее часто встречается субклинический гипотиреоз и тиреотоксикоз. Наличие сопутствующей патологии щитовидной железы является безусловным фактором риска нарушения ее функции. Развитие тиреотоксикоза может сопровождаться утратой антиаритмической активности амиодарона и приводить к рецидивированию нарушений ритма сердца. Ухудшение течения предшествующей аритмии, частичная утрата антиаритмической активности препарата должны насторожить кардиолога и направить его поиск на выяснение возможной эндокринной причины неэффективности лечения.
Развитие субклинического гипотиреоза на фоне приема амиодарона протекает без утраты антиаритмической активности препарата, но может сопровождаться дислипидемией с повышением показателей общего холестерина и ЛПНП. В таких случаях проведение заместительной терапии L-тироксином позволяет улучшить показатели липидного спектра.
Для предупреждения и прогнозирования возможных осложнений со стороны щитовидной железы пациенты, которым планируется лечение амиодароном, должны быть направлены к эндокринологу с целью уточнения функционального состояния щитовидной железы и наличия сопутствующей тиреоидной патологии. В дальнейшем на фоне приема препарата необходимо исследовать функцию щитовидной железы не реже 1 раза в 6 мес. и всегда при ухудшении течения аритмии согласно предложенному алгоритму. Выявление тиреотоксикоза является показанием к назначению тиреостатической терапии. При неэффективности монотерапии тиреостатиками к лечению добавляют глюкоамиотикоиды. Рекомендуется проводить лечение тиреотоксикоза в течение не менее 2 лет. В случаях, когда медикаментозное лечение невозможно, необходимо рассмотреть вопрос об оперативном лечении.
В случае развития явного гипотиреоза назначается прием L-тироксина под контролем уровня ТТГ. У лиц старшей возрастной группы при субклиническом гипотиреозе рекомендуется проведение заместительной терапии L-тироксином, если уровень ТТГ выше 10 МЕ/л. Если уровень ТТГ не превышает 10 МЕ/л, относительным показанием к назначению L-тироксина с использованием минимально эффективных доз и хорошей переносимости препарата является наличие зоба и дислипидемии. В остальных случаях проводится динамическое наблюдение с определением ТТГ 1 раз в 6 мес. и УЗИ щитовидной железы 1 раз в год.
В тех случаях, когда амиодарон назначается для первичной или вторичной профилактики фатальных желудочковых нарушений ритма сердца или когда отмена препарата невозможна по иным причинам, компенсацию тиреотоксикоза и заместительную терапию при гипотиреозе проводят на фоне продолжения приема амиодарона. Вопрос об отмене или продолжении лечения амиодароном должен решаться индивидуально для каждого пациента совместно кардиологом и эндокринологом. Клинический опыт показывает, что в большинстве случаев выбор делается в пользу продолжения лечения.
Н. Ю. Свириденко, доктор медицинских наук
Н. М. Платонова, кандидат медицинских наук
Н. В. Молашенко
С. П. Голицин, доктор медицинских наук, профессор
С. А. Бокалов, кандидат медицинских наук
С. Е. Сердюк
Эндокринологический научный центр РАМН, Москва
Институт клинической кардиологии им. А. Л. Мясникова, Москва
