Биохимические маркеры атеросклероза у детей группы высокого риска
27.02.2004
В последние годы отмечается рост остро развивающихся сердечно-сосудистых заболеваний, таких, как инфаркт миокарда, мозговой инсульт. В основе этих грозных состояний лежит атеросклеротическое поражение сосудов [1]. Многочисленными эпидемиологическими исследованиями было показано, что атеросклероз — это полиэтиологическое заболевание [2]. Немало предпосылок к возникновению атеросклеротического процесса закладывается в детском возрасте, аналогично факторам риска развития сердечно-сосудистой патологии у взрослых, в частности дислипопротеинемия, курение, уменьшение физических нагрузок, стрессы, повышение массы тела [12].
У детей с семейной предрасположенностью особенно актуально раннее выявление предвестников атеросклероза. Один из основных механизмов формирования атеросклероза — нарушение липидного обмена, которому, несомненно, следует уделять особое внимание. Дислипопротеинемии представляют собой своеобразный фундамент атеросклеротического процесса. У больных с атеросклерозом нарушения липидного обмена могут иметь различные проявления: увеличение уровня атерогенных фракций — холестерина липопротеинов низкой плотности (ХС ЛПНП), холестерина липопротеинов очень низкой плотности (ХС ЛПОНП), способствующих доставке холестерина в ткани; снижение уровня антиатерогенной фракции — холестерина липопротеинов высокой плотности (ХС ЛПВП), благодаря которым происходит экстракция холестерина из периферии. Нарушение соотношения транспортных белков (апопротеинов), интенсификация окислительной модификации ХС ЛПНП, высокий уровень ЛП(а), который является ингибитором активации плазминогена, что в результате приводит к подавлению фибринолиза и тромбозу [3]. Все выявленные нарушения могут быть обусловлены наследственными факторами, которые, в свою очередь, активизируются под влиянием факторов риска [12].
В последние годы растет интерес к гомоцистеину, как независимому фактору риска атеросклероза. Этот метаболит одновременно оказывает как атерогенное, так и тромбоваскулярное действие, его содержание в сыворотке превышает 10 ммоль/л. Причиной гомоцистеинемии могут являться генетический дефект, вызванный мутацией гена, кодирующего фермент 5,10-метилентетрагидрофолатредуктазу (МТГФР), а также длительный прием различных лекарственных препаратов, например оральных контрацептивов, циклоспоринов, метатрексата, антиконвульсантов, либо болезни почек [4, 5, 6, 7]. Однако вне зависимости от причин, вызывающих гомоцистеинемию, она проявляется снижением активности реакции реметилирования гомоцистеина в метионин, который участвует в различных обменных процессах: метаболизме катехоламинов, синтезе нуклеотидов и нуклеиновых кислот, стимуляции синтеза белков клеточной мембраны, среди которых находятся и ферменты, подавляющие перекисное окисление липидов (супероксиддисмутаза и каталаза) и, как следствие, задерживающие процесс атерогенеза. Недостаточное участие в синтезе белковых компонентов липопротеинов, вследствие недостатка метила, может быть причиной превалирования в мембранах и межклеточном пространстве липопротеидов низкой и очень низкой плотности, способствующих прогрессированию атеросклероза. В эндотелиальных клетках происходит снижение продукции релаксирующего фактора и сульфатированных глюкозаминогликанов (ГАГ) — гепариноидов, с понижением эластичности внутрисосудистой выстилки. Наравне с этим угнетается синтез тромбомодулина, без которого тромбин не образует комплекса, активирующего белковые антикоагулянты протеин С и протеин S, которые, в свою очередь, не оказывают прессорного действия на активность факторов V и VIII [8]. Таким образом, реализуется патогенез тромбоваскулярной болезни при гомоцистеинемии. Масштабные эпидемиологические исследования позволили установить, что при повышении уровня гомоцистеинемии на 5 ммоль/л вероятность заболевания коронарных артерий возрастала в 1,6 раза для мужчин и в 1,8 раза для женщин [9]. Однако сведений о состоянии обмена гомоцистеина у детей, особенно в группах высокого риска по атеросклерозу, в литературе недостаточно, и они разноречивы.
В связи с этим целью работы явилось определение факторов риска раннего развития атеросклероза у детей, отцы которых перенесли инфаркт миокарда в возрасте до 45 лет.
Нами было обследованы 56 семей — 71 ребенок и 44 взрослых (43 мужчины и 1 женщина, перенесшие инфаркт миокарда в возрасте до 45 лет), всего 115 человек.
Обследование детей и родителей было комплексным и включало анализ анамнестических данных и наличия модифицированных факторов риска, клинический осмотр и инструментальные методы обследования.
Состояние сердечно-сосудистой и вегетативной нервной системы оценивалось на основе клинического обследования, электрокардиографии в клино- и ортостазе, мониторинг артериального давления в покое и при проведении клиноортостатической пробы.
Исследование липидного спектра проводилось стандартными методами, с помощью наборов фирмы HUMAN на автоанализаторе AIRON и состояло из определения уровня общего холестерина (ОХ), триглицеридов (ТГ) и холестерина липопротеидов высокой плотности.
Расчетным методом определялись уровни ХС ЛПНП, ХС ЛПОНП, величина индекса атерогенности по следующим формулам: ХС ЛПОНП = ТГ/2,2 (ммоль/л); ХС ЛПНП = ОХ — (ХС ЛПВП + ХС ЛПОНП); ИА = (ОХ — ХС ЛПВП)/ ХС ЛПВП.
Концентрация аполипопротеинов определялась стандартными методами на автоанализаторе BEHRING.
Определение уровня ЛП(а) проводилось методом «ракетного» иммуноэлектрофореза с применением антител к апо(а) и контрольных калибров фирмы POCARD.
В коагулограмме исследовались следующие параметры: протромбиновое время (ПВ), протромбиновый индекс (ПИ), фибриноген, фибринолитическая активность (ФА). Уровень фибриногена в плазме определяли методом Clauss по времени образования сгустка в плазме в ответ на добавление раствора тромбина. Фибринолитическую активность эуглобулиновой фракции цитратной плазмы определяли путем измерения времени спонтанного лизиса. Протромбиновое время измеряется как время образования фибринового сгустка в ответ на добавление к плазме крови тромбопластина с хлористым кальцием. Протромбиновый индекс рассчитывался, как процентное отношение ПВ нормальной стандартизованной плазмы к ПВ пациента.
Определение гомоцистеина в сыворотке крови проводилось методом иммуноферментного анализа с использованием реагентов фирмы AXIS.
Анализ анамнестических данных наблюдаемой группы показал, что низкие физические нагрузки отмечались более чем у 2/3 детей. Свыше половины обследованных детей жаловались на головные боли, возникающие на фоне переутомления. У 8% детей масса тела превышала нормальные значения на фоне несбалансированного питания. По нашим данным, 24% обследованных детей в возрасте от 10 до 14 лет пробовали курить и 50% детей из этой же возрастной группы пробовали алкогольные напитки. Следует отметить, что в семьях, где один из родителей курит, курящие дети встречаются чаще.
Известно, что одной из основных причин патологии сердечно-сосудистой системы является дисфункция вегетативной системы [10]. По результатам нашего исследования, исходная ваготония обнаружена у 45% детей, у 32% детей доминировала симпатикотония, и у 23% определялась эйтония, при этом в группе контроля равновесие вегетативной нервной системы было свойственно 56,4% детей, ваготония — 33,3% и симпатикотония — 10,3% (р > 0,05). Анализ клинортостатической пробы (КОП) показал преобладание гипердиастолического (32%) и гиперсимпатического (17%) вариантов. Данные варианты КОП несут большую информацию о скрытых гипертензивных реакциях и часто обнаруживаются у детей с наследственной отягощенностью по гипертонической и ишемической болезням [10].
Показано, что многолетнее течение артериальной гипертонии увеличивает риск развития ишемической болезни сердца более чем в 2 раза, а также ускоряет развитие атеросклероза, нередко способствуя первичной травматизации сосудистой стенки, проникновению атерогенных липопротеидов под интиму [11]. Среди наших детей 17% имеют давление, превышающее возрастную норму, и 2/3 из их числа имеют в семейном анамнезе артериальную гипертонию.
По данным электрокардиографии, у 17% детей был зафиксирован синдром ранней реполяризации желудочков. Интересно также отметить, что у 18% детей были выявлены ЭКГ-признаки перегрузки правого предсердия. Основу этой группы составили дети с гипердиастолическим видом КОП (10%) и гипертонией (7%).
Одним из ведущих факторов развития атеросклероза является дислипопротеинемия.
При анализе лабораторных данных взрослых пациентов отмечается увеличение уровня ОХ (6,49±0,34 ммоль/л), в основном за счет его накопления в ЛПНП (4,62±0,46 ммоль/л); при этом содержание антиатерогенной фракции ХС ЛПВП было снижено у 41% родителей до 0,79±0,22 ммоль/л. При расчете индекса атерогенности прослеживается корреляция между снижением ХС ЛПВП и увеличением ИА (r = 0,7).
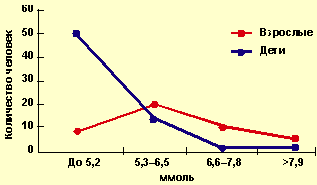
|
| Рисунок 1. Уровни общего холестерина |
При анализе липидограммы родителей обнаружены 2 основных варианта нарушений. При первом из них определялось увеличение общего холестерина за счет ХС ЛПНП и триглицеридов при нормальных уровнях ХС ЛПВП (у 48% взрослых). Второй вариант характеризовался повышением общего холестерина за счет увеличения содержания ХС ЛПНП и триглицеридов в сочетании со снижением уровня ЛПВП (у 41% родителей).
Среди детей повышенный уровень ОХ определялся у 31% обследованных — до 6,13±0,18 ммоль/л (рис. 1). У этих детей отмечались нарушения, идентичные первому варианту липидограммы взрослых, который заключался в увеличении общего холестерина за счет ХС ЛПНП до 3,88±0,33 ммоль/л, при уровнях ХС ЛПВП и триглицеридов, не превышающих нормальных значений. У 4 детей зафиксировано снижение ХС ЛПВП до 0,7+0,4 ммоль/л при нормальном уровне ОХС (рис. 2).
По данным некоторых исследователей, несбалансированность в системе транспортных белков липопротеинов рассматривают как одну из причин дислипопротеинемии, особенно у больных, перенесших инфаркт миокарда [14]. Однако нам не удалось выявить такой закономерности, лишь у 2 взрослых отмечался повышенный уровень апо В.
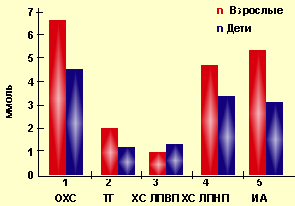
|
| Рисунок 2. Показатели липидного спектра детей и взрослых |
На гомоцистеин, как на фактор риска атеросклероза, исследователи обратили внимание лишь в последние годы. Известно, что высокие уровни гомоцистеина вызывают не только увеличение уровня ХС ЛПНП и ХС ЛПОНП, но и дисфункцию эндотелия [8], способствуя тем самым как нарушению в липидном спектре, так и изменениям в коагулограмме и агрегации тромбоцитов. Исходя из этого, мы исследовали у детей наравне с определением уровня гомоцистеина в сыворотке крови некоторые показатели коагулограммы. Исследование параметров коагулограммы у родителей не проводилось, так как в состав комплексной постинфарктной терапии у них входили антикоагулянты. У 58% родителей уровень гомоцистеина превышал нормальные значения (30,34±0,46 ммоль/л). Среди детей гомоцистеинемия отмечалась у 53% обследованных (до 27,17±0,44 ммоль/л). Изменения в коагулограмме были выявлены у 79% детей. Основные нарушения характеризовались увеличением времени фибринолитической активности изолированно, или в сочетании с нарастанием протромбинового индекса, или с увеличением концентрации фибриногена, что может свидетельствовать о наклонности к тромбозам у детей из данной группы (рис. 3).
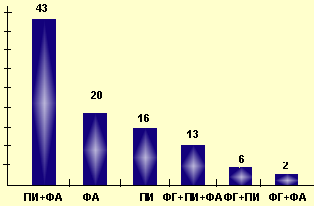
|
| Рисунок 3. Изменения в коагулограмме у детей (%) |
Некоторые авторы полагают, что гомоцистеин способствует связыванию ЛП(а) с фибрином [15]. Многочисленными исследованиями подтверждена связь ЛП(а) с коронарным атеросклерозом, причем в большей степени она выражена у лиц молодого возраста [3], именно с ЛП(а) связывают инфаркты, перенесенные в возрасте до 45 лет. Сходство структуры апо(а) и плазминогена позволяет предположить, что ЛП(а) может быть связующим звеном между атеросклерозом и тромбозом [10]. В связи с чем определенный интерес представляло изучение уровней ЛП(а) в нашей группе. Повышение уровня ЛП(а) отмечалось у 30% родителей (68,41±1,07 мг/дл) и у 20% детей (54,73±0,96 мг/дл) (рис. 4).
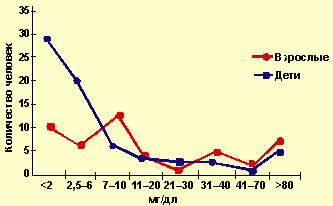
|
| Рисунок 4. Уровни ЛП(а) детей и взрослых |
Любопытно отметить, что существует корреляция между повышением уровня ЛП(а) у родителей и детей (r = 0,77).
Таким образом, у детей из группы высокого риска по раннему атеросклерозу при отсутствии явных клинических маркеров сердечно-сосудистой патологии имеются признаки нарушения обменных процессов: липидного обмена в виде гиперхолестеринемии за счет повышения уровня ХС ЛПНП, при уровне триглицеридов, не превышающих нормальных значений, повышенные концентрации ЛП(а), гомоцистеинемия, следствием которых являются изменения реологических свойств крови. Выявленные нарушения свидетельствуют о том, что у детей с отягощенной наследственностью по атеросклерозу выше риск не только раннего формирования атеросклеротической бляшки, но и осложнения течения атеросклероза тромбозами. В связи с этим обосновано проведение первичной профилактики атеросклероза уже в детском возрасте с применением не только диетической коррекции, оптимизации двигательной и эмоциональной нагрузки, обязательного соблюдения здорового образа жизни, но и включением в программу оздоровления детей препаратов фолиевой кислоты.
Выводы
- Исследование семейного анамнеза показало, что у детей из данной группы имеется отягощенная наследственность по сердечно-сосудистой патологии, особенно по раннему инфаркту миокарда на протяжении второго и третьего поколения.
- Модифицируемые факторы риска развития сердечно-сосудистой патологии встречаются среди детей со следующей частотой: гиподинамия — 59%, ожирение — 8%, психоэмоциональные перегрузки — 49%, пробовали курить — 24% детей.
- У детей из группы риска по атеросклерозу и раннему инфаркту миокарда чаще выявляется вегетососудистая дистония: ваготония (45%), симпатикотония (32%). У 17% детей артериальное давление превышало возрастную норму.
- Выявляется однонаправленность нарушений липидного спектра у детей и их родителей. В большинстве случаев отмечались гиперхолестеринемия за счет повышения ХС ЛПНП, а также увеличение ЛП(а).
- У детей группы риска, а также у их отцов отмечалась гомоцистеинемия, возможно усугубляющая имеющуюся дислипопротеинемию, за счет накопления ХС ЛПНП.
- При анализе коагулограммы у детей из семей с ранними проявлениями атеросклероза выявлена склонность к тромбозам. Возможно, факторами, способствующими тромбообразованию, являются гомоцистеинемия, которая, вызывая эндотелиальную дисфункцию, способствует нарушению секреции тромбомодулина эпителиальными клетками, и/или ЛП(а), обладающего тромботическими свойствами (благодаря способности замедлять лизис эндогенно образованного тромба) и под воздействием гомоцистеина образующего плохо растворимый комплекс с фибрином.
По вопросам литературы обращайтесь в редакцию.
М. Ю. Щербакова, доктор медицинских наук, профессор
А. И. Старцева
Г. А. Самсыгина, доктор медицинских наук, профессор
РГМУ, Москва
