Helicobacter pylori и аллергия
20.04.2004
Многочисленные исследования последних десятилетий показали, что Helicobacter pylori (НР), признаваемый большинством исследователей в качестве этиологического фактора развития хронического гастрита, язвенной болезни и ассоциированной с лимфоидной тканью опухоли MALTомы, может быть причиной заболеваний практически всех органов и систем. В последние годы пристально изучается роль НР в развитии ишемической болезни сердца, атеросклеротического поражения сосудов мозга, ряда аутоиммунных заболеваний, а также аллергических состояний.
Воздействие НР на макроорганизм может быть обусловлено различными механизмами. НР вызывает прямое повреждение слизистой оболочки желудочно-кишечного тракта, в результате которого повышается проницаемость его стенок для крупных молекул с развитием как истинной аллергии, так и псевдоаллергии. Изменение функции эпителия ведет к нарушению процессов переваривания и всасывания с изменением состава желудочного и кишечного содержимого, в том числе кишечной микрофлоры. Эти процессы усугубляют дисфункцию органов пищеварения, также способствуя развитию аллергии. Кроме того, возможна модификация поверхностных антигенов эпителиоцитов с последующей аутоиммунной реакцией. Показана определенная связь НР-инфицирования с развитием аутоиммунных процессов не только в желудочно-кишечном тракте, но и в других системах организма: сахарного диабета 1 типа, аутоиммунного тиреоидита, болезни Сьегрена, тромбоцитопенической пурпуры, аутоиммунных нефропатии и полинейропатии. Даже атеросклероз и ишемическая болезнь сердца могут рассматриваться как аутоиммунный процесс, индуцированный НР.
Чем более выражены факторы вирулентности НР, тем в большей степени вероятно развитие аллергического процесса у инфицированного больного. В то же время аллергические состояния, не связанные с НР, часто характеризуются повышенной проницаемостью кишечной стенки и снижением защитных механизмов, в том числе снижением уровня секреторного IgA. Последнее обстоятельство предрасполагает к инфицированию и колонизации НР в желудочно-кишечном тракте. Слизистая оболочка ЖКТ является барьером для алиментарных антигенов, и воспалительный процесс в желудочно-кишечном тракте любого происхождения может нарушать его целостность, повышать проницаемость слизистой оболочки и увеличивать прохождение через нее пищевых антигенов. Таким образом, НР-инфекция и аллергия представляют собой тесно связанные процессы.
В ряде исследований было показано, что воспалительный процесс в желудочно-кишечном тракте, связанный с НР, может быть причиной возникновения хронической крапивницы [1, 2, 3, 4, 5], которая, по разным данным,в 47% случаев сочетается с НР-инфекцией, в 50% — с выявлением антител к высокоафинному рецептору IgE, в 12–20% — с антитиреоидными антителами. Liutu M. и соавт. у 40 из 107 детей с хронической крапивницей выявили антитела класса IgG к НР. При этом активный гастрит был подтвержден у 30 из 32 НР-позитивных пациентов, а повышенный уровень IgE определялся у 64% НР-позитивных и у 39% НР-негативных пациентов [6]. Сочетание хронической крапивницы с аутоиммунным тиреоидитом достоверно ассоциируется с инфицированием CagA(+)-штаммами НР, но не CagA(-)-штаммами [7]. Эрадикация НР не приводит к полному излечению, но снижает тяжесть процесса и уменьшает потребность в антигистаминных препаратах, что, однако, может быть связано с излечением хеликобактерного гастрита [8].
Описана связь НР с развитием ангионевротического отека у детей, в основе которого лежат изменения в системе комплемента. Эрадикация НР приводит как к купированию клинических проявлений, так и к восстановлению иммунологических показателей [9].
У детей с атопическим дерматитом и пищевой аллергией очень часто встречаются антихеликобактерные антитела [10, 11, 12]. Показано также повышение эффективности лечения атопического дерматита при одновременной эрадикации НР [13].
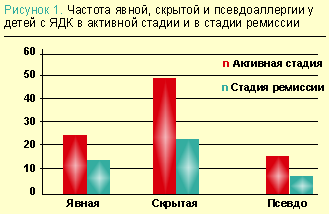
Нами изучалась связь пищевой аллергии с язвенной болезнью двенадцатиперстной кишки (ЯДК) у 63 детей в возрасте 5–16 лет (средний возраст — 12,6±0,13 лет), а также у детей с хроническим гастродуоденитом. Мы дифференцировали явную и скрытую аллергию без клинических проявлений, но с повышением уровня IgE в крови, а также истинную и псевдоаллергию. Было установлено, что суммарная доля пациентов с явной истинной аллергией, со скрытой аллергизацией и с псевдоаллергическими реакциями среди детей с ЯДК в активной стадии заболевания достигает 71%, а при хроническом гастродуодените — 35%. Клинически аллергические проявления аллергии наблюдались у 23% детей с ЯДК в активной стадии и 14% — в стадии ремиссии. У большинства детей аллергия была вызвана пищевыми антигенами. Скрытая аллергия на фоне активной стадии язвенной болезни имела место у 48% больных, в период ремиссии — у 22%, псевдоаллергические реакции наблюдались у 14% детей в активной стадии и 8% — в стадии ремиссии (рис. 1). При этом для детей с ЯДК и пищевой аллергией характерна большая длительность болевого синдрома на фоне проводимого лечения, по сравнению с больными без пищевой аллергии.
Изучение кислотно-пептического фактора показало, что повышение его активности способствует развитию аллергических и, в большей степени, псевдоаллергических реакций, за счет прямого воздействия на слизистую оболочку желудочно-кишечного тракта. Важно также, что для инфицированных НР больных с пищевой аллергией характерны относительно более низкие значения антихеликобактерных IgA-антител в крови по сравнению с пациентами без пищевой аллергии, что говорит об относительном снижении барьерной функции слизистой оболочки желудочно-кишечного тракта у этих детей.
Связь НР и пищевой аллергии при ЯДК может быть представлена схематично (рис. 2 ). Как уже указывалось, пищевая аллергия характеризуется селективным снижением выработки антихеликобактерных IgA-антител, но значительным повышением в крови антихеликобактерных IgG-антител, что указывает на снижение барьерной функции слизистой оболочки желудочно-кишечного тракта, что само по себе провоцирует развитие аллергии. Воспалительный процесс на слизистой оболочке желудка и тонкой кишки (гастрит, дуоденит), индуцированный НР, способствует протеканию как аллергических, так и псевдоаллергических процессов за счет еще большего повышения проницаемости слизистой оболочки. Воспалительный процесс может быть связан как с прямым действием НР на слизистую оболочку желудка и, в меньшей степени, двенадцатиперстной кишки, так и возникать опосредованно, в результате повышения активности кислотно-пептического фактора. Последний механизм реализуется отчасти через активацию гастрин-продуцирующих клеток и повышение кислой секреции, а также секреции пепсиногена.
У многих инфицированных НР лиц отмечается положительный тест на специфические IgE. НР может индуцировать IgE-опосредованный выход гистамина из человеческих базофилов in vitro. Тучные клетки слизистой оболочки участвуют в пищевой аллергии. Ранее было показано, в частности, что у НР-позитивных больных ЯДК количество Ecl-клеток, продуцирующих гистамин, в 3 раза превышает таковое у НР-позитивных лиц без дуоденальной язвы. Уровень гастрина в крови и гистамина в слизистой оболочке желудка при ЯДК выше по сравнению с контрольной группой, тогда как у НР-позитивных лиц без дуоденальной язвы имеют место промежуточные значения. Наблюдения говорят о возможном гистамин-опосредованном действии НР [14].
В работе N. Figura et al. [15] исследовалось, в каких случаях НР-инфекция ассоциируется с пищевой аллергией у взрослых пациентов. Автор показал, что CagA-позитивные пациенты с пищевой аллергией достоверно преобладают по сравнению с инфицированными пациентами без аллергии (р = 0,030, Mantel-Haenszel test). Поскольку штаммы НР, экспрессирующие CagA, обладают более высоким провоспалительным потенциалом, правомерно сделать вывод, что выраженное воспалительное поражение слизистой оболочки желудка способно повышать трансэпителиальную проницаемость и способствовать неселективному пассажу аллергенов, которая у атопиков может прямо стимулировать IgE-опосредованный ответ. При этом CagA-положительная НР-инфекция способствует пищевой аллергии. Таким образом, с одной стороны, на фоне ЯДК или хронического гастродуоденита возможно обострение скрытой аллергии. С другой стороны, пищевая аллергия провоцирует развитие гастрита, дуоденита и поддерживает уже имеющийся процесс. В итоге замыкается порочный патогенетический круг.
Данные отечественной и зарубежной литературы указывают на возможное значение внутрисемейного контакта для инфицирования НР. Было показано, что у родственников больных с ЯДК НР выявляется достоверно чаще по сравнению с родственниками здоровых лиц (71% по сравнению с 58%, p < 0,05). При этом у 34% НР-позитивных родственников имеют место диспептические симптомы, по сравнению с 12% НР-негативных (p < 0,02). Интересно, что у 8 из 18 обследованных супружеских пар был выявлен идентичный штамм НР, а в остальных 10 — различные штаммы. Исследование показывает возможность передачи инфекции в семье. На это же указывают работы других авторов [16]. Можно предположить, что пищевая аллергия у родственников может быть связана не только с наследственной предрасположенностью к аллергическим состояниям, но также с семейным очагом хеликобактера.
На основании полученных данных можно утверждать, что у больных с ЯДК пищевая аллергия встречается достаточно часто и ее развитие непосредственно связано с НР-инфицированием. При этом истинно аллергический процесс регулируется существенно реже псевдоаллергического. ЯДК усугубляет течение пищевой аллергии, а успешное лечение язвенного процесса способствует снижению активности процесса аллергического. Хотя противоаллергическая терапия и не влияет на сроки заживления язвенного дефекта, однако она способствует улучшению самочувствия больного, уменьшая болевую симптоматику.
Исходя из этого, для лечения больных ЯДК в сочетании с ПА патогенетически обосновано проведение адекватной терапии язвенного процесса, включая, при необходимости, антихеликобактерную и антисекреторную терапию, в сочетании с противоаллергическими мероприятиями.
Современная эрадикация НР предполагает применение «тройных» и «квадро-схем» терапии. Тройные схемы могут быть построены на основе препаратов висмута или антисекреторных лекарственных средств, с которыми комбинируются 2 антибактериальных препарата. Базисным препаратом висмута обычно является де-нол (висмута субцитрат), а в качестве антисекреторных средств используются средства из группы блокаторов протонного насоса (омепразол, рабепразол, экозомепразол) или, реже, блокаторов H2-гистаминовых рецепторов (в основном, фамотидин). Среди антибактериальных средств чаще применяются амоксициллин, макролиды (кларитромицин, азитромицин, рокситромицин), нифурател. Ранее широко назначаемый метронидазол в настоящее время не рекомендуется в связи со значительной распространенностью метронидазол-резистентных штаммов НР. Следует отметить, что в последние годы повышается также распространенность кларитромицин-резистентных штаммов, однако она пока не достигла критических значений. Сохраняет свою эффективность амоксициллин. Перспективным считается применение нитрофурановых препаратов, особенно последнего поколения, к которым относится нифуротель (макмирор). «Квадро-схема» антихеликобактерной терапии включает препараты висмута, антисекреторные средства и 2 антибактериальных препарата. Длительность курса обычно составляет 7 дней, а эффективность эрадикации на сегодняшний день приближается к 80–90%.
Таким образом, в настоящее время накоплены данные, указывающие на то, что инфицирование НР способствует развитию аллергии и псевдоаллергии как за счет прямого действия на слизистую оболочку, так и опосредованно, через активацию других патогенных факторов. Эрадикация НР способствует излечению больного, что следует учитывать при составлении плана диагностических и терапевтических мероприятий, включая тесты на НР-инфекцию, и назначении адекватных антихеликобактерных средств.
По вопросам литературы обращайтесь в редакцию.
С. В. Бельмер, доктор медицинских наук, профессор
Т. В. Гасилина, кандидат медицинских наук
М. Аль Хатиб, кандидат медицинских наук
РГМУ, Москва
