Патогенез и нейропротективная терапия критических состояний
04.06.2004
Реаниматология как медицинская дисциплина возникла всего около 50 лет назад, но уже в настоящее время широкое внедрение реанимационных подходов в различные медицинские специальности стало жизненной необходимостью. В данном контексте формулировка «жизненная необходимость» имеет не переносный, а прямой смысл, поскольку только использование наиболее современных методов реанимации и интенсивной терапии позволяет продлевать жизнь тысячам больных, находящихся в критическом состоянии. «Критическим», по концепциям современной реаниматологии, называется состояние, при котором требуется протезирование и коррекция жизнеобеспечивающих функций, таких, как дыхание, сердечная деятельность, выделение. При условии использования высокотехнологичного реанимационного оборудования возможно длительное поддержание адекватного функционирования большинства соматических систем, но задача протезирования работы мозга до настоящего момента не решена, что обусловливает необходимость поиска новых методов эффективной нейропротекции при критических состояниях.
Терапия критических состояний — это вид врачебной деятельности, формирующий у врача особые подходы к лечению больного и особое медицинское мышление (Г. А. Рябов, 1994), характеризующееся недопустимостью малейшего промедления при диагностике и оказании помощи. В этих условиях только нозологический принцип оказания медицинской помощи становится недостаточным. Для проведения экстренной и адекватной терапии необходим синдромный подход, так как степень тяжести состояния больных определяет комплекс синдромов критических состояний, требующих немедленной и максимально эффективной коррекции в связи с тем, что у больных с критическим состоянием любого генеза (инсульт, инфаркт миокарда, эндотоксический шок, перитонит, панкреонекроз, эпилептический статус, приступ бронхиальной астмы, гиповолемия, артериальная гипотензия) выявляются однотипные клинические синдромы, от которых зависят тяжесть течения заболевания, его исход и степень посткритической неврологической инвалидизации.
При критических состояниях практически у всех больных возникают синдромы, связанные с системными и церебральными гипоксическими расстройствами, такие, как респираторной и гемодинамической гипоксии, гипоксии малого сердечного выброса, гипоксии повышенного сосудистого сопротивления. Достаточно часто, вследствие выраженных микроциркуляторных расстройств, имеющих место как на системном, так и на интрацеребральных уровнях, у больных возникают синдромы гипоксии периферического шунтирования и капиллярно-клеточной гипоксии. Прогрессирование комплекса локальных и диффузных гипоксических синдромов, провоцирующих нарушения функционирования эндотелиальной системы и вторичную блокаду микроциркуляции, а также нарушения системной гемодинамики, такие, как синдромы сердечной и сосудистой недостаточности, волемических нарушений, могут обусловливать прогрессирование вторичной церебральной ишемии.
Неадекватные программы инфузионной коррекции, массивная дегидратация, особенно при депрессии сознания, усугубляют у больных гиповолемические расстройства и синдромы нарушения водно-электролитного гомеостаза, прежде всего дегидратации, нарушения ионного состава, осмолярности, кислотно-основного состояния крови. Синдромы системного ответа при воспалении, приводящие к морфологическим изменениям крови, активации катаболизма белков, депрессии гуморального иммунного ответа, возникают у больных с критическими состояниями любого, и особенно неврологического, генеза, в результате утраты мозгом регуляторно-трофических влияний на соматическую сферу. Наиболее тяжелой формой расстройств иммунологической резистентности является синдром полиорганной недостаточности (СПОН), возникающий в результате гиперметаболической системной гипоксии и цитокинового эндотоксикоза, усугубляющий тяжесть расстройств системного гомеостаза и провоцирующий возникновение вторичных церебральных расстройств (С. А. Румянцева, 2002). В среднем у 35% больных, перенесших критические состояния, прогрессирование именно этих синдромов, клинически проявляющихся развитием гнойно-септических и неврологических осложнений, является причиной летальных исходов. Нарушения сознания, считающиеся одними из ведущих клинических синдромов критических состояний, возникают как результат локальных и диффузных очаговых и диффузных церебральных расстройств и системных расстройств гомеостаза.
Таким образом, тяжесть течения и исходы критических состояний, вне зависимости от их этиологии, могут определяться вышеописанными неспецифическими синдромами, большинство из которых ведет к возникновению церебральных постишемических и постгипоксических расстройств, определяемых как постгипоксическая энцефалопатия.
Постгипоксическая энцефалопа-тия — это прогредиентное нарушение функционального состояния и морфологические расстройства церебральных структур, рассматриваемых как совокупность неврологических и психических нарушений, возникающих после воздействия гипоксии. Головной мозг высокочувствителен к содержанию кислорода и глюкозы крови, что определяется высоким уровнем нейронального метаболизма при низком содержании кислорода, в то время как процессы, лежащие в основе специфической деятельности ЦНС, такие, как функционирование синапсов, АТФ-азные реакции нейронального проведения, синтез специфических белков для хранения и переработки информации, трансмембранный перенос нейромедиаторов, аксо- и дендроток, сопряженные с фосфорилированием, одновременно чрезвычайно энергоемки и энергозависимы (Р. Н. Глебов, 1978; И. П. Ашмарин, 1996). Снижение энергетического потенциала нервной ткани при постгипоксической энцефалопатии является триггерным механизмом активации повреждающего каскада с выбросом лактата, увеличением объема неактивных форм гемоглобина, структурными нарушениями митохондрий, дестабилизацией и конформационными изменениями мембран, инициируемыми высокой концентрацией Н+ и высвобождением Са2+ из мембран, с дестабилизацией как самих мембран, так и их ионоселективных каналов со снижением активности АТФ-аз.
В формировании патологических изменений в мозге при постгипоксической энцефалопатии участвуют все уровни его организации и молекулярные механизмы, способные осуществлять фиксацию патологической информации за счет активации быстро и длительно действующих систем коммуникации нейронов и реализацию их в клинических синдромах. Клинические синдромы постгипоксической энцефалопатии являются чаще всего результатом дезинтеграции совокупного ионотропного и метаболотропного воздействия, характеризующегося формированием генераторов патологического нейронального возбуждения, которое считается ключевым звеном в процессе образования устойчивых патологических систем мозга (Г. Н. Крыжановский, 1997). Достаточно часто у больных с постгипоксической энцефалопатией (ПЭ) возникают синдромы трофогенной дизрегуляции (рис. 1).
Особая значимость перекисного окисления и гидролиза фосфолипидов клеточных мембран в процессах формирования клинических проявлений ПЭ определяется очень высоким содержанием липидов, являющихся основным субстратом свободных радикалов и фосфолипаз, в нервной ткани, которая состоит из липидов на 50%. Свободные радикалы — это молекулы или осколки молекул с неспаренным электроном на внешней молекулярной орбите, что резко повышает их реакционную способность. Функционирующая в нормальных условиях по принципу обратной связи система «ПОЛ-антиоксиданты» в критическом состоянии и при гипоксии становится нестабильной, формируется синдром «оксидантного стресса», приводящий к накоплению пероксидов и повреждению нейрональных мембран с формированием устойчивой самоподдерживающейся системы патологических расстройств микроциркуляции и интегративной деятельности мозга.
Сосудистые ансамбли, предназначенные для осуществления церебральной микроциркуляции, обеспечивающей высокую интенсивность взаимодействия между кровью, ликвором и веществом мозга, морфологически функционируют по принципу повторяющихся модулей. Микроциркуляторные нарушения составляют основное звено большинства постгипоксических церебральных расстройств, а реорганизация нейрональных сетей — главным способом хранения информации о патологическом состоянии. Важнейшим звеном в патогенезе отека-набухания головного мозга у больных с критическими состояниями является повышение проницаемости сосудистых и клеточных мембран за счет увеличения содержания эндогенных катехоламинов, серотонина, активации калликреин-кининовой системы, реализации аутоиммунных процессов (И. В. Ганушкина, 1986). В основе развития постгипоксического повреждения гематоэнцефалического барьера лежит также развитие воспалительного процесса микроциркуляторного русла на участках эндотелия, инициированного биологически активными веществами самой сосудистой стенки, прежде всего цитокинами. В результате возникают выраженные клинико-морфологические расстройства по типу цитотоксического или/и вазогенного отека. Конечным этапом постгипоксического поражения головного мозга являются морфологические расстройства нервных и глиальных клеток по типу их апоптоза с формированием клинических синдромов постгипоксической энцефалопатии. Нарушенная в ходе функционально-морфологических постгипоксических расстройств интегративная деятельность головного мозга реализуется в последовательном выключении различных уровней афферентных и эфферентных систем головного мозга, объединяющих основные функциональные церебральные системы, такие, как ассоциативная, лимбическая, двигательная и вегетативная.
Патобиохимические каскады, приводящие к развитию нейрональных расстройств у больных с критическими состояниями, требуют формирования новых концепций их адекватной терапии. Успех лечения больного в критическом состоянии возможен лишь при соблюдении 3 основных условий (Г. А. Рябов, 1994): высокая квалификация врача, техническая и лекарственная вооруженность и наличие исчерпывающей информации о состоянии больного. Нельзя вылечить больного, если врач не понимает, что с ним происходит, невозможно помочь больному, если его нечем лечить.
Адекватная базисная терапия критических состояний является по своей сути синдромной и нейропротективной и должна быть направлена на купирование расстройств или полное протезирование деятельности жизнеобеспечивающих функций организма (дыхания, системной гемодинамики, буферных и детоксицирующих систем, гемостаза, адекватного водно-электролитно-белкового баланса), без которых невозможно поддержание адекватной церебральной перфузии и нейронального гомеостаза, т. е. сохранение структурно-функциональной целостности ЦНС.
Мероприятия синдромной интенсивной терапии должны осуществляться одномоментно и максимально быстро. Приведенная ниже схема синдромной терапии (схема 1) включает много этапов, но для обеспечения адекватной нейропротекции лечение должно проводиться не последовательно, а параллельно.

|
| Схема 1. Основные направления синдромной терапии критических состояний |
Данная терапия обязательно должна проводиться весь острейший период заболевания, так как без ее адекватного проведения меры дифференцированной терапии и, особенно, различные виды специфической нейропротекции у больных с критическими состояниями любого генеза не дадут ожидаемого эффекта. Первоочередное значение и место базисной терапии в системе помощи больным с критическими состояниями определяются тем, что только с ее помощью представляется возможным в той или иной степени купировать посткритические симптомы, влекущие за собой грубую дезорганизацию регионарного и системного гомеостаза, дисфункцию церебральных структур.
Реальным способом коррекции этих расстройств у больных, перенесших любые терминальные состояния, является соблюдение основных стратегических принципов терапии (А. Пирадов, 1998):
- контроль и лечение неврогенных дыхательных расстройств;
- контроль и лечение внутричерепной гипертензии;
- ранняя диагностика и эффективная терапия расстройств интегративной деятельности мозга (коматозных состояний);
- диагностика и лечение основных неосложненных неврологических расстройств;
- лечение тяжелых неврологических осложнений вследствие поражения внутренних органов.
Алгоритмы терапии постгипоксических расстройств включают комплексное воздействие для поддержания нейронального гомеостаза, что становится возможным только в условиях сохранения церебральной перфузии при адекватном системном кислородном, электролитном, ферментативном и белковом гомеостазе, снижении уровня посткритического эндотоксикоза и стабилизации сосудистого тонуса.
Ниже приведены алгоритмы терапии у больных с критическими состояниями, направленные на поддержание церебральной перфузии, сохранение оксигенации и нейрометаболическую защиту мозга на фоне применения антигипоксантов и специфических нейротрансмиттеров.
Основным условием проведения нейропротективной терапии является сохранение адекватной системной и церебральной перфузии, что становится возможным при проведении сбалансированной программируемой инфузионной коррекции в объеме не менее 30 мл/кг/сут, нормоволемической гемодилюции до показателей гематокрита 36% при поддержании реологической стабильности крови. На рисунке 2 представлены препараты, наиболее широко употребляемые в настоящее время в неврологической, нейрореанимационной и реанимационной практике для поддержания адекватной церебральной и системной перфузии, которое является во многом определяющим для сохранения нейронального гомеостаза и, следовательно, социального статуса пациента, пережившего или переживающего при критическом состоянии тяжелую гипоксически-ишемическую агрессию.
На рисунке 3 представлены основные саногенетические направления воздействия и препараты, воздействующие на ткань мозга и его кровеносную систему для поддержания кислородного и ферментативного гомеостаза.

|
| Схема 2. Механизмы действия нейропротекторов |
Комплексная патогенетическая терапия постгипоксических церебральных расстройств у больных с критическими состояниями должна быть направлена на сохранение структурно-функциональной деятельности нейрональных образований, для чего необходимо использование современных нейропротекторов различных групп, механизмы действия которых представлены на схеме 2.
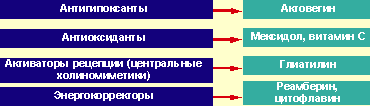
|
| Рисунок 4. Основные направления нейропротективной терапии |
На рисунках 4 и 5 представлены основные препараты для ранней нейропротективной терапии критических состояний и их рекомендуемые дозировки.
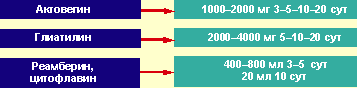
|
| Рисунок 5. Дозирование нейропротекторов |
Использование вышеприведенных схем ранней интенсивной нейропротективной терапии и коррекции нейрональных расстройств позволяет значительно (в среднем на 7%) снизить летальность пациентов в ОРИТ, а также уменьшить выраженность неврологического дефицита у больных, перенесших критические состояния.
С. А. Румянцева, доктор медицинских наук, профессор
РГМУ, Москва
