Лечение гиперактивного мочевого пузыря и императивного недержания мочи у женщин
16.12.2004
Гиперактивный мочевой пузырь (ГМП), проявлениями которого являются симптомы учащения мочеиспускания, императивные позывы и императивное недержание мочи, — частый повод обращения к гинекологам и урологам. Состояние требует длительного лечения, первой линией которого специалисты единодушно считают поведенческую терапию [1].
Применение поведенческой терапии при ГМП основано на предположении, что это состояние вызвано утратой выработанного в детстве контроля коры головного мозга над мочеиспускательным рефлексом или наличием патологически сформированного рефлекса. Известно, что больше половины пациенток с ГМП имеют выраженные психические и социальные проблемы, а у 20% из них гиперактивность связана именно с неправильной моделью мочеиспускания. Чтобы восстановить этот контроль, устанавливают определенный ритм мочеиспусканий и постепенно увеличивают интервалы между ними. Перед началом лечения пациентке объясняют, что в норме диурез составляет 1500–2500 мл/сут, средний объем мочеиспускания — 250 мл, функциональная емкость мочевого пузыря — 400–600 мл, допустимое количество мочеиспусканий — в среднем 7–8 раз в сутки. Если этот объем превышает норму, необходимо научить пациентку избегать употребления жидкости без необходимости: пить только во время приема пищи, отказаться от кофе и чая, особенно вечером, ограничить употребление острой пищи и соли, которые вызывают жажду. Исключением являются пациентки, принимающие диуретики. Важно обосновать и необходимость отказа от «вредных» привычек: мочиться «на всякий случай», перед едой или выходом из дома. Целью тренировки мочевого пузыря является постепенное удлинение интервалов между мочеиспусканиями (в начале лечения интервалы между мочеиспусканиями должны быть короткими, например 1 ч, постепенно их доводят до 2,5–3 ч) и увеличение функциональной емкости мочевого пузыря. Таким образом, больная «приучает» свой мочевой пузырь опорожняться только произвольно. Ночью больной разрешается мочиться только в том случае, когда она просыпается из-за позыва на мочеиспускание.
Основным инструментом при таком методе лечения является дневник регистрации мочеиспусканий, в котором должны быть отмечены не только объем выделенной мочи и время мочеиспускания, но и эпизоды недержания мочи (НМ) и смена прокладок. Дневник в обязательном порядке должен изучаться и обсуждаться с врачом на плановых регулярных осмотрах.
Поведенческая терапия особенно эффективна при идиопатической гиперактивности детрузора. Прогноз, безусловно, определяется тем, насколько точно больная следует рекомендациям врача. Высокая эффективность лечения ГМП отмечается при сочетании тренировки мочевого пузыря и медикаментозной терапии.
Упражнения для укрепления мышц тазового дна имеют большое значение не только при стрессовом НМ, когда с их помощью может быть увеличено уретральное давление. Клиническое применение упражнений при ГМП основано на эффекте рефлекторного торможения сокращений детрузора при произвольных и достаточных по силе сокращениях мышц тазового дна [2].
Система выполнения упражнений Кегеля включает поочередное сокращение и расслабление мышц, поднимающих задний проход. Упражнения выполняются 3 раза в сутки. Длительность сокращений постепенно увеличивают: от 1–2 с, 5 с, 10–15 с и от 30 с до 2 мин. Иногда для контроля правильности выполнения упражнений используют перинеометр. Он состоит из баллончика, соединенного с манометром. Больная вводит баллончик во влагалище и определяет силу мышечных сокращений во время упражнений по манометру. «Функциональные» упражнения в дальнейшем предполагают их выполнение не только в позиции релаксации, но и в ситуациях, провоцирующих НМ: при чихании, вставании, прыжках, беге. Несмотря на простоту и широкую известность, упражнения Кегеля в настоящее время применяют редко. Иногда врач советует больной по нескольку раз в день прерывать и возобновлять мочеиспускание. Однако такие упражнения не только устраняют НМ, но и приводят к нарушениям мочеиспускания.
Основное условие эффективности терапии — регулярное выполнение упражнений и врачебный контроль с постоянным наблюдением и обсуждением результатов.
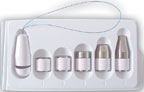
|
| Рисунок 1. Влагалищные конусы |
Пациенткам, которые не могут идентифицировать необходимые группы мышц, вследствие чего оказываются не в состоянии корректно выполнять упражнения, рекомендуется использовать специальные устройства: влагалищные конусы, баллоны и др. (рис. 1). Конусы имеют одинаковый размер и разную массу (от 20 до 100 г). Больная вводит конус наименьшей массы во влагалище и удерживает его в течение 15 мин. Затем используют более тяжелые конусы [3].
По данным различных исследователей, количество пациенток, не способных сокращать m. pubococcygeus, достигает 40% [4]. Это послужило одной из причин широкого использования метода биологической обратной связи (БОС), целью которого является обучение навыкам сокращения специфических групп мышц и обеспечение обратной связи с пациенткой. Эффективность методики обусловлена активной ролью пациенток в процессе лечения путем вовлечения зрительного (картинки, фильмы, анимация) или слухового (голосовая поддержка) анализаторов. Осуществление обратной связи может проводиться моно- и мультиканально путем регистрации активности тазового дна, абдоминального и детрузорного давлений.

|
| Рисунок 2. Видео-компьютерный комплекс |
Нами накоплен опыт проведения тренировки мышц тазового дна (ТМТД) в режиме БОС на видео-компьютерном комплексе «УРОПРОКТОКОР» (рис. 2), представляющем собой стационарный прибор, оснащенный периферийным оборудованием, необходимым для лечения расстройств функций тазового дна, и обладающий возможностями мотивационного подкрепления.
Технология использования прибора заключается во введении во влагалище специального датчика, измеряющего электромиограмму (ЭМГ) окружающих мышц, который выполнен из фарфора с золотым напылением. Его можно использовать многократно после предварительной стерилизации. ЭМГ-сигнал анализируется компьютером, который производит построение графиков на экране монитора, информируя пациентку о том, как работают мышцы промежности. Пациентка периодически напрягает и расслабляет мышцы тазового дна («втягивание» ануса) по командам прибора. При этом размеры кривых на мониторе увеличиваются и достигают индивидуально установленного порога. Для максимальной эффективности процедуры используют технологию мотивационного подкрепления: каждое правильно выполненное упражнение сопровождается показом фильма, слайдов и т. п. При некачественном выполнении задания все поощряющие факторы минимизируются, что стимулирует пациентку к более активной работе мышц. Курс лечения состоит из 15–20 получасовых сеансов.
После проведения ТМТД в режиме БОС нами отмечено: уменьшение количества микций с 14 до 8 раз в сутки, эпизодов НМ — с 4 до 1 раза в сутки; показатель порога абдоминального давления увеличился с 38 до 59 см; H2О, средний объем потери мочи уменьшился с 52 до 8 мл. При анализе данных миографии получены следующие результаты: процент правильной работы мышцами тазового дна при первом сеансе составил 60,1% + 10,2%, при 8-м сеансе — 73% + 8,7%, а к 15-му занятию этот показатель равнялся 82,8% + 7,3% (р < 0,05). При анализе полученных клинических данных стало очевидным влияние терапии БОС как на симптомы гиперактивности мочевого пузыря, так и на состояние тазового дна.
Перспективность терапии БОС заключается не только в ее высокой эффективности и отсутствии побочных эффектов, но и в возможности проведения терапии в домашних условиях с использованием индивидуальных портативных приборов. БОС остается методом выбора для пациенток с тяжелыми сопутствующими соматическими заболеваниями, когда другие виды лечения, в том числе медикаментозный, не могут быть применены [5].
Электрическая стимуляция (ЭС) также является эффективным методом лечения ГМП. Она применяется с целью снижения чувствительности мочевого пузыря и увеличения его функциональной емкости, что достигается путем прямого или опосредованного раздражения нервных волокон слабым электрическим током [6]. Электрод вводят либо во влагалище, либо в прямую кишку, возможно использование наружных накладных электродов. Электрические импульсы подаются непрерывно или периодически. Точками приложения являются: уретральный и анальный сфинктеры, мышцы тазового дна, корешки сакрального отдела спинного мозга. В последнее время популярным методом является тибиальная ЭС. Стимуляция афферентных волокон соматической периферической нервной системы, входящих в состав нервных стволов, вызывает торможение парасимпатической активности тазового нерва и увеличение симпатической активности надчревного нерва, в результате чего снижается сократительная активность детрузора.
При выраженной нейрогенной гиперактивности детрузора ЭС производится путем хирургической имплантации системы для ЭС переднего сакрального корешка S3. Побочными действиями могут быть неприятные ощущения во время процедуры, болевые реакции и ощущение неудобства [7].
Медикаментозная терапия, как и поведенческая, является одним из самых распространенных методов лечения ГМП. Такая терапия направлена на устранение беспокоящих симптомов и улучшение уродинамических показателей, т. е. снижение активности детрузора, увеличение функциональной емкости мочевого пузыря. Центральными мишенями терапии являются зоны контроля мочеиспускания в спинном и головном мозге, а периферическими — мочевой пузырь, уретра, периферические нервы и ганглии. На данные «мишени» могут воздействовать следующие препараты:
- лекарственные средства, воздействующие на ионные каналы клеточных мембран;
- антимускариновые/антихолинергические препараты, в том числе двойного миотропного спазмолитического действия;
- антиадренергические;
- трициклические антидепрессанты;
- ингибиторы синтеза простагландинов;
- аналоги вазопрессина;
- афферентные ингибиторы.
Одна из современных классификаций лекарственных средств, снижающих симптомы ГМП, предлагает разделение таких препаратов на четыре типа [8]:
1-й тип — препараты, снижающие эфферентную стимуляцию детрузора (М-холинолитики, a1-адреноблокаторы);
2-й тип — препараты, повышающие ингибирующий контроль, полисинаптические ингибиторы (антидепрессанты);
3-й тип — препараты, снижающие чувствительность мочевого пузыря (токсины);
4-й тип — препараты, снижающие мочеобразование (например, аналоги вазопрессина).
М-холиноблокаторы (оксибутинин, толтеродин, троспиум) признаны одними из наиболее эффективных средств, использующихся для лечения ГМП. Накоплен большой опыт их применения, а безопасность и эффективность оценена в ходе множества сравнительных, плацебо-контролируемых мультицентровых исследований. Используются селективные М-холиноблокаторы. Препарат атропин, не являющийся селективным, в настоящее время применяется редко из-за выраженного системного действия (только введение путем электрофореза).
Рекомендации Европейской Ассоциации урологов по ГМП и императивному недержанию мочи предлагают М-холиноблокаторы в качестве первой линии терапии, а по оценке с точки зрения доказательности препараты этой группы относят к категории «А» (высокая степень доказательности). В России лекарственными средствами группы М-холиноблокаторов, разрешенными к применению и широко назначаемыми, являются оксибутинин, толтеродин, троспиум (неретардированные формы). Изучены аспекты безопасности и эффективности данных лекарственных средств в различных группах больных.
Основной тенденцией, характеризующей современный подход к применению оксибутинина (дриптан, оксибутин), является изменение дозировки и режима дозирования с целью снижения количества побочных эффектов. Препарат с успехом применяется в дозе 3 мг/сут, предлагается схема приема оксибутинина в дозе 5 мг/сут, в случае хорошей переносимости с последующим увеличением на 2,5 мг каждые 2 нед до достижения клинического эффекта. С целью достижения максимальной эффективности и улучшения переносимости рекомендуется внутрипузырное или трансдермальное применение оксибутинина. Проводятся клинические исследования эффективности и безопасности оксибутинина замедленного высвобождения, который при равной эффективности демонстрирует более благоприятный профиль безопасности.
Последние клинические исследования, посвященные препарату толтеродину (детрузитол), подтвердили его высокую клиническую эффективность при симптомах ГМП. Препарат применяется в стандартной дозировке 2 мг 2 раза в день. Многообещающей можно признать и практику применения толтеродина замедленного высвобождения, который также имеет более высокую эффективность в отношении учащения мочеиспускания и императивного недержания мочи по сравнению со стандартными неретардированными формами препарата.
Особого внимания заслуживает также троспиум (спазмекс), который, являясь четвертичным аммониевым соединением, при хорошей клинической эффективности не имеет побочных эффектов со стороны ЦНС. Так, в ходе исследования на добровольцах, отличные от группы плацебо побочные эффекты проявлялись лишь при дозировках, превышающих 180 мг, что как минимум в 4 раза превосходит стандартное дозирование (H. P. Breuel, S. Bondy). Проведенное нами сравнительное исследование двух дозировок троспиума хлорида (спазмекс, PRO. MED. CS, Praha) — 15 мг/сут и 45 мг/сут показало, что на фоне преобладающей эффективности дозы 45 мг/сут, частота побочных эффектов была сравнимой, а побочные эффекты со стороны ЦНС отсутствовали.
Помимо известных М-холинолитиков, на европейском рынке появляются современные селективные препараты, не так давно прошедшие крупномасштабные плацебо-контролируемые исследования. В их числе — солифенацин, который эффективно снижает количество эпизодов ургентного недержания мочи и частоту мочеиспусканий. Доказана высокая эффективность и безопасность препарата (дозировка: 5, 10, 20 мг 1 раз в день). Отмечен минимальный процент выбывания из исследования по причине побочных эффектов. Исследования также показали хорошие фармакокинетические и фармакодинамические параметры этого средства на фоне высокого профиля безопасности при применении 1 раз в день. Фармакокинетика солифенацина при приеме пищи не изменяется.
При ГМП с успехом также могут использоваться препараты, воздействующие на симпатические рецепторы. Известно, что α1-адреноблокаторы: тамсулозин (омник), теразозин (корнам, сетегис, хайтрин), доксазозин (зоксон, камирен, кардура), альфузозин (дальфаз) — снижают симптоматику при расстройствах мочеиспускания, связанных с наличием гиперплазии предстательной железы у мужчин, оказывают влияние на гиперактивность детрузора, возникающую на фоне инфравезикальной обструкции. В ходе открытого проспективного исследования (S. Serels,1998) был проведен сравнительный анализ эффективности α1-блокатора и холинолитика у женщин. Была показана высокая эффективность применения α1-адреноблокатора при симптомах «императивности». Препараты данной группы могут применяться для лечения симптомов ГМП как у мужчин, так и у женщин, особенно в случаях возникновения симптомов ГМП на фоне уродинамически подтвержденной функциональной инфравезикальной обструкции (ИВО). Полученные данные (А. В. Сивков, 2001; Д. Ю. Пушкарь, 2002) говорят о достоверной эффективности α1-адреноблокаторов при симптомах ГМП у женщин на фоне функциональной ИВО. Так, в группе наблюдения частота мочеиспусканий в сутки снизилась на 25–30%, а ночная поллакиурия — на 50%. Назначение α1-блокаторов проводится с учетом вазоактивности. У пациенток молодого возраста препаратом выбора является тамсулозин (0,4 мг/сут). При назначении вазоактивных α1-блокаторов необходимо титрование дозы.
Трициклические антидепрессанты (имипрамин, амитриптилин) обладают центральным и периферическим антихолинергическим и α-адренергическим действием, а также тормозящим влиянием на ЦНС. Они эффективны при пероральном применении (150 мг/сут) у пациенток пожилого возраста с симптомами ГМП. К группе антидепрессантов относится и дулоксетин — комбинированный ингибитор обратного захвата серотонина и норадреналина. Он воздействует на центры контроля мочеиспускания в пояснично-крестцовом отделе спинного мозга (ядра Онуфа). В этих ядрах осуществляется интеграция активности сфинктера и мочевого пузыря. При ингибировании норадреналина повышается тонус сфинктера, а при блокаде серотонина снижается активность мочевого пузыря. В настоящее время рассматривается возможность применения препарата при стрессовых недержаниях мочи. Вывод о целесообразности его использования при гиперактивном мочевом пузыре можно будет сделать лишь по окончании широкомасштабных клинических исследований.
В последние годы возник интерес к применению токсинов при ГМП. Токсин ботулина (торговые названия botox, dysport), используемый в эстетической медицине, способен нормализовать тонус мышцы путем ингибирования высвобождения ацетилхолина из нервного окончания. Показаниями к его применению являются сфинктерные дисфункции и нейрогенная гиперактивность детрузора. Токсин назначается в виде внутрипузырных инъекций (в среднем 30 точек) под цистоскопическим контролем. Противопоказаниями считаются инфекция мочевых путей и гиперчувствительность к препарату, хотя лишь у 2% пациентов образуются антитела к ботулотоксину.
Аналоги вазопрессина (4-й тип лекарственных средств), такие, как десмопрессин (минирин, эмосинт), имеют весьма ограниченную область применения. Основным показанием к их назначению остается смещение диуреза в сторону ночных часов (никтурия) и связанные с ним нарушения мочеиспускания. В настоящий момент проводится исследование по использованию аналогов вазопрессина для коррекции императивного недержания мочи.
В лечении женщин старшей возрастной группы с ГМП определенное место занимает заместительная гормональная терапия. Дефицит эстрогенов приводит к ряду изменений в мочеполовой системе женщины в виде атрофии влагалища, снижения тонуса сфинктеров и повышения чувствительности мочевого пузыря [9]. Однако многие из положительных эффектов эстрогенотерапии, за исключением воздействия на признаки остеопороза, до настоящего времени недостаточно аргументированы, а мнения по этому поводу следует признать противоречивыми [10]. Эффективность эстрогенотерапии в лечении ГМП можно считать спорной. Исследователи отстаивают целесообразность проведения исследований в соответствии с принципами доказательной медицины и качественной клинической практики.
При выборе метода медикаментозного лечения ГМП необходимо принимать во внимание наличие сопутствующих заболеваний, результаты предшествующего лечения, способность и возможность пациентки следовать назначениям врача. Это поможет осуществить правильный подбор препарата и обеспечить высокую эффективность лечения.
После подбора адекватной и эффективной терапии ГМП требуется последующее диспансерное наблюдение и контрольные обследования с интервалами в 3–6 мес.
В. В. Ромих
И. А. Аполихина, кандидат медицинских наук
В. М. Андикян
НЦАГиП РАМН, ММА имени И. М. Сеченова, НИИ урологии, Москва
Литература
- Janssen C. C., Lagro-Janssen A. L., Felling A. J. The effects of physiotherapy for female urinary incontinence: individual compared with group treatment // BJU. Int. — 2001. — Vol. 87. — N 3. — P. 201–206.
- Hay-Smith E., Вo К., Berghmans L. et al. Pelvic floor muscle training for urinary incontinence in women (Cochrane review) // Oxford: The Cochrane Library, 2001.
- Herbison P., Plevnik S., Mantle J. Weighted vaginal cones for urinary incontinence // Cochrane Database Syst. Rev. — 2000. — Vol. 2. — CD002114.
- Gordon D., Luxman D., Sarig Y., Groutz A. Pelvic floor exercise and biofeedback in women with urinary stress Incontinence // Harefuah. — 1999. — Vol. 136. — N 8. — P. 593–596.
- Wang A. C. Bladder-sphincter biofeedback as treatment of detrusor instability in women who failed to respond to oxybutynin // Yi. Xue. Za. Zhi. — 2000. — Vol. 23. — N 10. — P. 590–599.
- Appell R.A. Electrical stimulation for the treatment of urinary incontinence // Urology. — 1998. — Vol. 51. — 2A Suppl. — P. 24–26.
- Bosch R., Groen J., Sacral (S3) segmental nerve stimulation as a treatment for urge incontinence in patients with detrusor instability: results of cronic electrical stimulation using an implantable neural prothesis //J. Urol. — 1995. — Vol. 154, N2. — PP. 504–507.
- Lai H., Boone T., Appell R. Selecting a medical therapy for overactive bladder. Reviews in urology, 2002; 4 (4): 28–37.
- Grady D., Brown J.S., Vittinghoff E. et al. Postmenopausal hormones and incontinence: the Heart and Estrogen/Progestin Replacement Study // Obstet. Gynecol. — 2001. — Vol. 97. — P. 116–120.
- Kuchel G.A., Tannenbaum C., Greenspan S.L., Resnick N.M. Can variability in the hormonal status of elderly women assist in the decision to administer estrogens? // J. Womens Health Gend. Based Med. — 2001. — Vol. 10. — N 2. — P. 109–116.
