Принципы антибактериальной терапии тяжелых и осложненных пневмоний у детей раннего возраста
04.02.2005
Пневмония — острое инфекционное воспаление респираторных отделов легких, диагностируемое на основании синдрома дыхательных расстройств, патогномоничных физикальных данных и характерных рентгенографических изменений, является одним из самых распространенных и серьезных заболеваний легких у детей [1–6]. При этом установлено, что наиболее высокий уровень заболеваемости и летальности при пневмонии отмечается у новорожденных и детей первых пяти лет жизни. Однако распространенность и прогноз пневмонии у детей в различных регионах неодинаковы и во многом зависят от социально-экономических условий. Так, по данным ВОЗ (1995), заболеваемость пневмонией у детей раннего возраста в экономически развитых странах не превышает 3–4% и составляет не более 8–9% от всех причин смертности. В то же время в государствах с низким культурным и социально-экономическим уровнем, неустойчивой политической обстановкой и продолжающимися военными конфликтами распространенность пневмонии у детей первых пяти лет жизни превышает 10–20%, а ее удельный вес в структуре причин детской смертности составляет более 25% [5–6]. При этом в развивающихся регионах основной причиной летальности от пневмонии является недоступность медицинской помощи. В свою очередь, в развитых странах неблагоприятный исход пневмонии, как правило, отмечается в тех случаях, когда заболевание развивается у детей с иммунодефицитными состояниями, тяжелыми пороками развития, органическими поражениями ЦНС и другими серьезными нарушениями здоровья. Лишь в небольшом проценте случаев при этом причинами тяжелого и осложненного течения пневмонии являются поздняя диагностика и неадекватное лечение, в первую очередь нерациональная антимикробная терапия.

Так, анализ 835 историй болезни детей раннего возраста, находившихся на стационарном лечении в Тушинской детской больнице
г. Москвы по поводу внебольничных пневмоний, проведенный нами совместно с Е. М. Овсянниковой и Е. В. Скоробогатовой, показал, что основными причинами развития тяжелых и осложненных форм заболевания (5,03% среди всех форм пневмоний) являлись поздняя диагностика, несвоевременность назначения антибиотиков и неадекватное их применение. Среди причин поздней диагностики пневмонии были отмечены не только поздняя обращаемость (показатель, свидетельствующий о низком уровне санитарно-просветительской работы поликлиники), но и недооценка педиатрами клинических симптомов заболевания. Так, в ряде случаев поздняя постановка диагноза была обусловлена отсутствием физикальных изменений в легких, хотя одновременно отмечались одышка, лихорадка и проявления интоксикации. Тяжелые формы заболевания также развивались в тех случаях, когда при своевременно диагностированной пневмонии назначалась нерациональная антимикробная терапия (выбор в качестве стартовых препаратов гентамицина или ко-тримоксазола, а также использование антибиотиков пенициллинового ряда в неадекватно низких дозах).
В последние годы в практической работе используется классификация пневмонии, которая учитывает не только клинико-патогенетические и рентгенологические параметры, но и эпидемиологические особенности. Так, отдельно выделяются в отдельную рубрику условия, в которых произошло инфицирование и развитие заболевания, возраст пациента, что имеет четкую практическую направленность, так как позволяет эмпирически определить круг наиболее вероятных возбудителей пневмонии. В соответствии с данной классификацией, в зависимости от условий, в которых произошло инфицирование, выделяют внутриутробные, внебольничные (внегоспитальные) и внутрибольничные (госпитальные, нозокомиальные) пневмонии [7]. Широкое распространение данных терминов связано с выявлением четкой зависимости этиологии пневмонии от возраста и условий, в которых произошло инфицирование и развитие заболевания [1–3, 9–10]. Так, установлено, что этиологическая структура пневмоний у новорожденных и детей первых месяцев жизни имеет существенные отличия, так как может быть представлена очень широким спектром возбудителей (стрептококки группы В, стафилококк, протей, клебсиелла, кишечная и синегнойная палочки, различные вирусы, хламидии и др.). У детей в возрасте 6 мес и старше при инфицировании в обычных условиях (вне лечебных учреждений) наиболее частыми этиологическими факторами пневмонии, в зависимости от возраста, являются пневмококк, гемофильная палочка и микоплазма. При госпитальном инфицировании возбудителями пневмонии чаще являются полирезистентные стафилококки и бациллярная флора (кишечная и синегнойная палочки, протей, клебсиелла и др.).
Среди осложнений пневмонии, в соответствии с современной рабочей классификацией, выделяют легочные и внелегочные формы [7]. Следует отметить, что хотя на практике педиатры считают большинство легочных осложнений проявлением деструкции легочной ткани, возникающим в результате выраженных воспалительных изменений («деструктивные пневмонии»), рубрикация в «Международной статистической классификации болезней и проблем, связанных со здоровьем» 10-го пересмотра (МКБ-10) [8], предусматривает выделение определенных форм гнойно-воспалительных поражений легких в качестве самостоятельных нозологических единиц (например, код J85.1 — абсцесс легкого с пневмонией; код J86 — пиоторакс, включающий абсцесс плевры, эмпиему и пиопневмоторакс). При этом среди гнойно-воспалительных заболеваний органов дыхания рекомендуется отдельно выделять и те состояния, которые должны трактоваться, как первичные заболевания, а не осложнения пневмонии, например абсцесс легкого без пневмонии (код J85.2) [8].
Лечение детей с тяжелыми пневмониями включает рациональную антимикробную терапию, адекватную респираторную поддержку, иммунотерапию, коррекцию и поддержание гомеостатических параметров (водно-электролитный баланс и др.), а также купирование патологических синдромов (гипертермический, геморрагический, судорожный, синдром сердечной недостаточности и др.). Особо следует отметить, что лечение детей с осложненными формами пневмоний (абсцесс легкого, пиоторакс, пиопневмоторакс, эмпиема) должно осуществляться в условиях хирургического стационара или в отделениях интенсивной терапии и реанимации, но с обязательным привлечением детского хирурга. Важным компонентом лечения пневмонии является рациональная антимикробная терапия. При этом в последние годы в практике отечественной педиатрии все шире стали использоваться алгоритмы выбора стартовой антимикробной терапии, разработанные на принципах доказательной медицины [3, 9–11]. Следует подчеркнуть, что при тяжелых и осложненных формах пневмоний должен использоваться только парентеральный способ введения антибиотиков. При этом предпочтение следует отдавать внутривенному или комбинации внутривенного с внутримышечным введением антибиотиков.
Учитывая этиологические особенности пневмонии у детей первых месяцев жизни, характеризующиеся значительной палитрой потенциальных возбудителей (стафилококк, пневмококк, кишечная палочка, клебсиелла, протей, хламидии, пневмоцисты и др.) и возможной их комбинацией, стартовая антибактериальная терапия при тяжелых формах заболевания должна иметь максимально широкий спектр действия. При выборе стартовой антимикробной терапии следует обязательно учитывать анамнез ребенка, его фоновые состояния и клинико-рентгенологические особенности заболевания. Такие симптомы, как лихорадка, токсикоз, четко ограниченные физикальные, а также очаговые и/или сливные воспалительные инфильтраты в легких при рентгенографическом исследовании позволяют с большей достоверностью предполагать, что пневмония вызвана типичной бактериальной флорой. Это определяет выбор антибактериальных комбинаций, включающих ингибитор-потенцированный аминопенициллин (амоксициллин/клавуланат) и аминогликозид или цефалоспорин 2–3-й генерации и аминогликозид (рис.). Использование «защищенных» антибиотиков широкого спектра действия (амоксициллин/клавуланат, цефалоспорины 2–3-го поколения), обусловлено высокой вероятностью участия в генезе заболевания бактерий, продуцирующих β-лактамазы. Антибиотики при этом должны назначаться в таких режимах дозирования, которые создают терапевтические концентрации. Так, амоксициллин/клавуланат (аугментин, амоксиклав) при внутривенном введении применяют в разовой дозе 30 мг/кг (по амоксициллину) с интервалом 6–8 ч. Цефалоспорины 2-го поколения, такие, как цефуроксим (аксетин, зиннат, кефурокс, суперо) и цефамандол (мандол, тарцефандол, цефат), а также цефалоспорины 3-го поколения — цефотаксим (клафоран, талцеф, цефотаксим), цефтизоксим (эпоцелин) и цефтазидим (кефадим, фортум) — назначают в суточной дозе 100 мг/кг в три-четыре введения. В то же время особенности фармакокинетики таких цефалоспоринов 3-го поколения, как цефтриаксон (новосеф, медаксон, офрамакс, роцефин, терцеф) и цефоперазон (медоцеф, цефобид), позволяют использовать их с интервалом введения 12–24 ч, соответственно в одно-два введения в сутки.
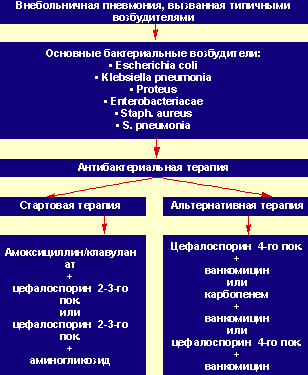
|
| Рисунок. Выбор антибактериальной терапии при лечении тяжелых вариантов типичной пневмонии у детей раннего возраста |
Среди аминогликозидов, назначаемых в комбинации с «защищенными» аминопенициллинами или цефалоспоринами, наиболее часто используются гентамицин (суточная доза 3–5 мг/кг в два-три введения), амикацин (амикин, амикозит, хемацин, селемицин — суточная доза 15 мг/кг в два введения) и нетилмицин (нетромицин — суточная доза 6–7,5 мг/кг в два-три введения). Позитивный клинический эффект и положительная рентгенологическая динамика на фоне проводимой терапии позволяют продолжить курс лечения выбранными «защищенными» аминопенициллинами или цефалоспоринами до 10–14 дней, в то время как аминогликозиды не следует использовать дольше 7 дней в связи с высоким риском развития ото- и нефротоксических эффектов [12].
Отрицательная динамика заболевания, а также появление клинических и рентгенологических признаков деструкции легочной ткани или вовлечение в патологический процесс плевры свидетельствуют о неэффективности проводимой антибактериальной терапии и требуют ее коррекции. При этом следует особо подчеркнуть, что развитие абсцесса, плевропневмонии, пиоторакса и других гнойно-воспалительных изменений в легких является абсолютным показанием для привлечения детских хирургов к курации таких пациентов. Коррекция антимикробной терапии при этом должна обязательно проводиться с учетом данных бактериологического обследования, предварительные результаты которого, как правило, в этот период уже готовы. В тех же случаях, когда приходится подбирать схему антимикробной терапии эмпирически, должны назначаться препараты резерва — антибиотики «сверхширокого спектра действия»: карбопенемы (тиенам, меропенем) или цефалоспорины 4-й генерации — цефепим (максипим), цефпиром (рис.). Тиенам назначается в суточной дозе 60 мг/кг, которая вводится в четыре приема. Суточная доза меропенема (меронем) — 20 мг/кг в три введения. Особо следует отметить, что, несмотря на чрезвычайно широкий спектр антибактериального действия карбопенемов и цефалоспоринов 4-го поколения, метициллинрезистентные стафилококки и энтерококки сохраняют к ним устойчивость. Поэтому в тех случаях, когда одним из этиологических агентов пневмонии является метициллинрезистентный стафилококк, препаратом выбора считается ванкомицин (ванкоцин, ванмиксан, эдицин — суточная доза 40 мг/кг в два приема) [12]. Однако ванкомицин и его аналоги имеют узкий спектр действия, так как не действуют на грамотрицательную флору. Поэтому в подавляющем большинстве случаев ванкомицин используется в комбинации с карбопенемом или цефалоспорином 3–4-го поколения.
При подозрении на пневмонию, вызванную атипичными возбудителями, должны быть обязательно проведены дополнительные исследования по уточнению этиологии заболевания. Своевременная коррекция стартовой антимикробной терапии (подключение препаратов этиотропной направленности) позволит при этом существенно снизить риск развития осложнений. Так, наличие в анамнезе генитального хламидиоза у матери, гнойного конъюнктивита, не купирующегося при использовании традиционных способов лечения, сухой кашель с постепенным нарастанием интенсивности и частоты, медленное развитие других симптомов заболевания и отсутствие типичных рентгенологических признаков пневмонии заставляют задуматься о возможной этиологической роли С. trachomatis. Верификация хламидийной этиологии пневмонии определяет необходимость назначения современных макролидных антибиотиков — мидекамицина ацетат (макропен), азитромицин (азитрал, азитрокс, хемомицин), рокситромицин (ровенал, роксид, рулид) или др.
В тех случаях, когда у иммунодефицитных пациентов, а также у недоношенных или ослабленных детей на фоне неспецифических симптомов интоксикации отмечаются постепенное нарастание тахипноэ, приводящее к увеличению частоты дыхания, превышающей частоту пульса в разгар заболевания (!), вздутие грудной клетки, а при рентгенологическом обследовании — диффузное двухстороннее усиление интерстициального рисунка, неоднородные очаговые тени с нечеткими контурами, участки локализованного вздутия, ателектазы, реже парциальный пневмоторакс («ватное легкое», «крылья бабочки»), следует исключить пневмоцистную этиологию заболевания. Подтверждение пневмоцистной этиологии является основанием для включения в терапию пневмонии ко-тримоксазола (бисептол, бисептин). Препарат следует вводить внутривенно при суточном режиме дозирования 15–20 мг/кг (по триметоприму) на протяжении 2–3 нед. Следует отметить, что применение ко-тримоксазола в таких высоких дозах у детей первых месяцев и лет жизни может сопровождаться возникновением побочных и нежелательных эффектов, которые развиваются из-за нарушений метаболизма фолиевой кислоты и проявляются диспептическими (анорексия, стоматит, диарея и др.) и гематологическими (цитопении) симптомами. Кроме того, из-за возможного образования в ренальных канальцах кристаллов, содержащих ацетилированные метаболиты сульфаметоксазола, могут нарушаться функции тубулярных отделов почек. В случае непереносимости ко-тримоксазола или при отсутствии эффекта от проводимой терапии используется альтернативный препарат — пентамидин (в суточной дозе 4 мг/кг). Однако применение пентамидина может сопровождаться серьезными побочными эффектами (панкреатит, ренальные дисфункции, гипогликемия, гипергликемия, гиперкалиемия, артериальная гипотензия, нейтро- и тромбоцитопении и др.), поэтому препарат должен использоваться только по строжайшим (!) показаниям.
В тех случаях, когда пневмония возникает у детей с дисфагией, гастроэзофагальным рефлюксом, пороками развития верхних отделов ЖКТ, а также при указании на эпизоды апноэ, поперхивание или покашливание во время кормления, можно предположить аспирационный механизм развития пневмонии. В генезе воспалительных изменений в легких при этом могут принимать участие как аэробные (энтеробактерии, стафилококки и др.), так и анаэробные неспорообразующие микроорганизмы (бактероиды, фузобактерии и др.). Это определяет необходимость назначения антибактериальных препаратов широкого спектра действия, которые подавляют не только аэробные, но и анаэробные бактерии. Антианаэробной активностью обладают метронидазол, ингибиторзащищенные аминопенициллины, линкозамиды и карбопенемы. Поэтому при аспирационных пневмониях в качестве стартовой антибактериальной терапии чаще используют амоксициллин/клавуланат в комбинации с аминогликозидом или метронидазол + цефалоспорин 3-й генерации + аминогликозид. Метронидазол при этом назначают в суточной дозе 15–30 мг/кг в три введения. В качестве альтернативной терапии тяжелой аспирационной пневмонии у детей используется комбинация карбопенема с ванкомицином.
В комплексном лечении пневмонии нельзя забывать о дезинтоксикационной и антиоксидантной терапии, использовании отхаркивающих средств и муколитиков.
Симптоматическая терапия показана главным образом при развитии у больных пневмонией различных нарушений со стороны других органов и систем.
Таким образом, анализ анамнестических, эпидемиологических, клинических и рентгенологических данных позволяет предположить вероятную этиологию пневмонии, что определяет рациональный выбор стартовой этиотропной терапии. В свою очередь, своевременно назначенная рациональная антибактериальная терапия пневмонии дает возможность добиться позитивного результата лечения и существенно улучшает прогноз заболевания в целом.
Литература
- Таточенко В. К. Практическая пульмонология детского возраста. — М., 2001. — 268 с.
- Пневмонии у детей/Под ред. С. Ю. Каганова, Ю. Е. Вельтищева. — М., 1995.
- Острые респираторные заболевания у детей: лечение и профилактика/Научно-практическая программа Союза педиатров России. — М.: Международный Фонд охраны здоровья матери и ребенка, 2002. — 69 с.
- Churgay C.A. The diagnosis and management of bacterial pneumonias infant and children. Primary Care. 1996; 4: 822–835.
- The World Health Report 1995: Bridging the gaps. WHO. — Geneva, 1995.
- The management of acute respiratory infections in children. Practical guidelines for outpatient care, WHO. — Geneva, 1995.
- Классификация клинических форм бронхолегочных заболеваний у детей // Рос. вест. перинатол. и педиатр. — 1996. — № 2. — С. 52 — 56.
- Международная статистическая классификация болезней и проблем, связанных со здоровьем. — 10 пересмотр. — ВОЗ, 1994 (пер. на рус.) — М.: Медицина, 1998.
- Страчунский Л. С. Антибактериальная терапия пневмоний у детей: Руководство по фармакотерапии в педиатрии и детской хирургии/ Под ред. С. Ю. Каганова. — М.: Медпрактика, 2002. — Т. 1. — С. 65 –103.
- Антибактериальная терапия пневмонии у детей: Пособие для врачей // Клиническая микробиология и антимикробная терапия у детей. — 2000. — № 1. — С. 77–87.
- Самсыгина Г. А., Дудина Т. А. Тяжелые внебольничные пневмонии у детей: особенности клиники и терапии. — Consilium Medicum. — 2002. — Приложение № 2. — С. 12 — 16.
- Red Book: 2000. Report of the Committee on Infection Diseases. 25rd: American Academy of Pediatrics, 2000, 855 р.
