Проблемы терапии атопического дерматита у грудных детей
29.03.2005
Атопический дерматит (АД) представляет собой заболевание кожи, возникающее, как правило, в раннем детстве у лиц с наследственной предрасположенностью к атопии и имеющее тенденцию к хроническому рецидивирующему течению [1].
В пользу наследственной предрасположенности говорят многочисленные данные о высокой частоте семейных случаев заболевания. В 60–75% случаев в семьях детей с АД выявляются атопические болезни, такие как бронхиальная астма, аллергический ринит, нейродермит и др. [1, 2, 3, 4]. Следует отметить, что примерно у 10% пациентов установить аллергическую природу АД не удается — и механизмы развития этой формы болезни остаются пока не ясными [5, 6, 7].
Под нашим наблюдением в течение двух первых лет жизни находились дети с высокой степенью риска развития атопии [8]. Все матери этих детей страдали бронхиальной астмой или сочетанием бронхиальной астмы с другим атопическим заболеванием. 19,4% отцов также имели атопические заболевания, причем 8,3% из них страдали АД. Более чем у половины старших братьев и сестер наших пациентов (53,8%) также отмечались заболевания атопической природы, при этом в 23% случаев — АД. Наконец, у 24,3% из 252 близких и дальних родственников имелись атопические заболевания, а АД был отмечен в 10,4% случаев.
АД развился у наблюдаемых нами детей более чем в половине случаев (58,3%). Еще у 16,7% детей диагностировался дерматореспираторный синдром. Таким образом, атопический дерматит в «чистом виде» или в сочетании с бронхообструктивным синдромом был зарегистрирован у 75% детей с отягощенной по атопии наследственностью.
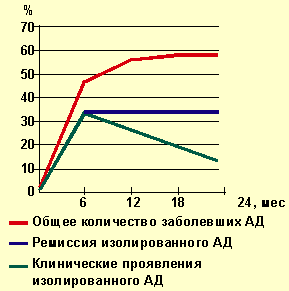
|
| Рисунок 1. Динамика заболеваемости атопическим дерматитом |
На рисунках 1, 2 представлена динамика выявления клинических проявлений АД и дерматореспираторного синдрома у наблюдаемых нами детей с отягощенной наследственностью. Характерно, что в подавляющем большинстве наблюдений АД клинически манифестировал на первом году жизни, т. е. в грудном возрасте. К 6 мес АД страдали 47,2% детей, к 12 мес — 55,6% всех детей, на втором году жизни заболевание клинически проявилось только у 2,7% детей.
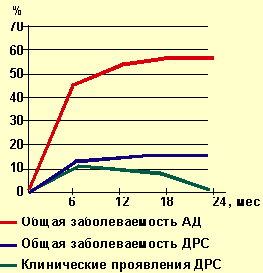
|
| Рисунок 2. Динамика заболеваемости атопическим дерматитом и дермореспираторным синдромом |
К окончанию второго года жизни почти у половины детей с АД отмечалась ремиссия клинических проявлений, а при дерматореспираторном синдроме ремиссия к концу второго года жизни регистрировалась в 2/3 случаев.
Из приведенных данных видно, что максимальной частоты клинические проявления АД достигают в первые 6 мес жизни, причем впервые признаки заболевания выявляются в основном от 8 до 12 нед жизни. Грудной возраст, таким образом, является основным «плацдармом» для развития этой патологии. Обычно заболевание начинается с эритематозного и эритематозно-сквамозного поражения кожи лица в виде «молочной корки». Через 1–2 нед появляются зуд и общая сухость кожных покровов, особенно наружных поверхностей.
И еще через 1–3 нед процесс может распространиться на кожу рук, бедер и голеней. Изменение последовательности высыпаний и появление первичных элементов в начале заболевания на теле, а затем на лице или на теле и на лице одновременно отмечается редко. Но, как правило, прогностически данный признак считается более неблагоприятным: именно у этой группы грудных детей атопический дерматит принимает распространенный и тяжелый характер поражения кожных покровов. К началу второго года жизни обычно наблюдается эволюция высыпаний в виде постепенного формирования синдрома лихенизации с максимальной локализацией в складках суставов конечностей и на шее.
Характерно, что у детей с отягощенным по атопии анамнезом симптомы АД появлялись не только достаточно рано (6–8-я нед жизни), но, как правило, и возникали на фоне грудного вскармливания, так как более 70% наблюдаемых нами детей получали в этот период жизни грудное молоко. Тщательно проанализировав характер и качество вскармливания, мы отметили, что на фоне грудного вскармливания более чем 30% матерей вводили в рацион детей фруктовые соки, пюре и другой прикорм, чтобы «витаминизировать питание». Однако статистически достоверного различия в качестве питания по отношению к группе контроля (дети без отягощенной по атопии наследственности) выявлено не было. Более того, значительная часть матерей практиковали преимущественно грудное вскармливание.
Таким образом, проведенные нами наблюдения показали, что у детей группы высокого риска по развитию АД одной из серьезных проблем является ранняя клиническая манифестация заболевания, которая развивается в большинстве случаев на фоне естественного вскармливания.
Следует отметить, что на практике диагноз АД в подавляющем большинстве случаев устанавливается клинически, так как в грудном возрасте отмечается физиологически более высокий уровень JgE, чем во все последующие периоды жизни. Так, исследование уровня JgE в динамике на протяжении первых 24 мес жизни показало, что в группе риска по развитию атопии уровень JgE был отчетливо выше, чем в контрольной группе. Но и в контрольной группе этот показатель был повышен, а выявленные критерии в целом не имели статистически и диагностически значимых различий. Следует отметить, что среди детей, у которых атопический дерматит или дерматореспираторный синдром клинически выявились в первые два года жизни, уровень JgE оказался наиболее высоким и имел статистически значимое различие с группой контроля. Этот показатель у них был даже выше, чем у детей, также родившихся от матерей, страдающих бронхиальной астмой, но не имевших в первые два года жизни клинических проявлений атопического заболевания. Это согласуется с положением о JgE-опосредованном генезе АД при генетически детерминированной предрасположенности к атопии, но, к сожалению, не обеспечивает надежного лабораторного критерия диагностики АД у детей первых лет жизни.
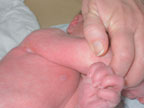
|
| Рисунок 3. Эритематозное поражение кожи при кандидозе |
Наиболее распространенной диагностической ошибкой является ситуация, когда за проявления АД принимают кандидоз кожи у грудных детей. Кандидоз — одно из часто встречающихся инфекционных заболеваний кожи, его распространенность среди грудных детей может достигать 10–24% [9]. Первая отличительная черта кандидоза — более раннее начало, обычно на 2–3-й нед жизни. Вторая — преобладание эритематозного поражения кожи. Оно может проявляться интертригинозным дерматитом, который локализуется в крупных складках и характеризуется наличием эритематозных, отечных участков с мелкими пузырьками и пустулами по периферии (рис. 3). Эту форму кандидоза нередко принимают за опрелости. В отличие от опрелостей эрозивные поверхности имеют четко контурированные, фестончатые края с подрытым эпидермальным венчиком. Поверхность эрозий гладкая, блестящая, напряженная. Другим вариантом поражения является кандидозный пеленочный дерматит. Обычно он развивается у детей, которые являются носителями грибов Candida в кишечнике. Заболевание проявляется эритематозными бляшками с бахромчатой границей и четко выраженным краем. Они формируются при слиянии многочисленных папул и везикул. Пустулы-сателлиты, локализующиеся на окружающей коже, представляют собой очаги локализованной кандидозной инфекции. Обычно в процесс вовлекается кожа перианальной области, паховых складок, промежности и нижней части брюшной стенки (рис. 4). У мальчиков может быть поражена кожа мошонки и полового члена. Третьим вариантом кандидоза кожи является везикулезное и эритематозное поражение гладкой кожи, для которого характерно преобладание влажных эрозивных, гладких, напряженных, блестящих участков темно-красного цвета (эритематозное поражение) или наличие значительного количества мелких дряблых пузырьков (везикулезная форма). Таким образом, особенностями кандидоза являются темно-красный цвет и лаковый блеск, влажная, а не мокнущая поверхность, отчетливые границы и фестончатые очертания; узкая периферическая каемка, представленная воротничком тонкого белого, мацерированного рогового слоя эпидермиса; наличие вокруг основных больших эрозий свежих пузырьков, пустул и мелких эрозий.
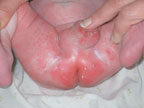
|
| Рисунок 4. Кандидозный пеленочный дерматит |
Третьей отличительной чертой является отсутствие сухости кожи и отсутствие зуда даже при распространенном поражении кожи.
С другой стороны, сам АД нередко осложняется присоединением инфекционного процесса. Причем наиболее часто инфекционные осложнения вызывают стафилококки, особенно St. aureus, грибы рода Candida, вирус простого герпеса. Характерно, что процесс присоединения инфекции усугубляется патофизиологическими расстройствами, лежащими в основе патогенеза АД и квалифицирующимися в настоящее время как суперантигены, усиливающие и пролонгирующие аллергическую реакцию. Поэтому в диагностически сложных случаях целесообразно провести соответствующее дополнительное обследование: посев отделяемого (если таковое есть) или мазка с кожи на среду Эндо и среду Сабуро (селективная среда для грибов) и мазок на полимеразную цепную реакцию на вирус герпеса.
Лечение АД в грудном возрасте — одна из самых сложных и неблагодарных задач для врача-педиатра. Так как клинический дебют АД в большинстве случаев приходится на период грудного вскармливания, многие специалисты — нутрициологи, педиатры и аллергологи рекомендуют назначать матерям строгую элиминационную диету с ограничением не только высокоаллергенных продуктов, таких как шоколад, клубника, цитрусовые и т. д., но и сахара, соли, цельного молока, жирного, копченого, острого и т. д. Нередко дело доходит до того, что кормящей женщине предписывают соблюдение диеты, крайне бедной не только микроэлементами и витаминами, но и основными нутриентами — белками, жирами и углеводами. Это, естественно, отражается на составе грудного молока, которое теряет свое основное назначение — обеспечивать растущий организм ребенка всем необходимым для нормального роста и развития [11]. При этом многочисленные исследования последних лет показали, что четкой зависимости между проведением элиминационной диеты матери и выраженностью АД не существует, поэтому держать мать «на голодном пайке» нет никакой необходимости.
Диета кормящей женщины при развитии АД у ребенка должна оставаться полноценной и разнообразной, с незначительным ограничением основных продуктов питания (табл. 1). Исключение составляют только высокоаллергенные продукты, являющиеся облигатными аллергенами, — шоколад, какао, натуральный кофе, орехи, мед, цитрусовые, красная икра. Их применять не следует. Необходимо также избегать избыточного потребления сахара, конфет и других сладостей, так как при этом возрастает содержание сахара в грудном молоке. Лук, чеснок, редька, редис, пряности, острые приправы, а также крепкие бульоны — мясные, рыбные, куриные и грибные — могут изменять вкус грудного молока, поэтому их вводят в рацион любой кормящей женщины в ограниченном количестве. В то же время кормящим женщинам можно порекомендовать включить в свой рацион специальные продукты: быстрорастворимые молочные напитки «Фемилак» (Россия), «Энфа-мама» (США), «Думил Мама плюс» (Дания) и др., которые способствуют обогащению грудного молока витаминами и микронутриентами. Эти напитки используются как отдельно, так и для приготовления различных блюд. Количество напитков устанавливается индивидуально, с учетом характера питания и состояния здоровья женщины, и составляет, как правило, 1–2 порции (200–500 мл) в день.
Если АД развивается у ребенка, находящегося на искусственном или смешанном вскармливании, особенно в том случае когда установлена пищевая аллергия к белкам коровьего молока, целесообразно перевести малыша на лечебное питание. При этом возможны, по крайней мере, три варианта: использование смесей, основанных на высокой степени гидролиза белков коровьего молока; применение смесей на соевой основе и использование молока других животных или смесей, приготовленных на основе молока других животных. Каждый из этих вариантов имеет свои достоинства и недостатки. Однако у них есть один общий недостаток — ни одна из смесей не служит адекватной заменой грудного вскармливания по своим протективным, биологическим и социальным свойствам.
Смеси, созданные на основе соевого белка, в течение последних десятилетий довольно широко использовались с лечебной целью у детей с непереносимостью белков коровьего молока. Таких смесей довольно много: Алсой (Нестле, Швейцария), Бона-соя (Кюмос, Финляндия), Вайсоя (Вайт Лабораториз, Великобритания), Нутрилак-соя (Россия), Нутрисоя (Нутриция, Голландия), Симилак-изомил (Эббот Лабораториз, США), СМА Нурсой (Вайт Ледерле, США), Соя Семп (Семпер, Швеция), Фрисосой (Фризленд, Голландия), Хумана ЛП (Хумана, Германия), Хайнц-соевая смесь (Хайнц, США), Энфамил-соя (Мид Джонсон, США) и др.
Белковый субстрат этих продуктов представлен изолятом соевого белка. При этом он лишен таких компонентов, как ингибитор трипсина. Нет в соевых смесях и трудно перевариваемых углеводов (рафиноза и стахиоза), которые содержатся в соевых бобах и вызывают у детей метеоризм и диарею. Жировой компонент смесей формируется за счет растительных масел (подсолнечного, соевого, кокосового, кукурузного, рапсового и др.), обеспечивающих оптимальное соотношение полиненасыщенных жирных кислот. Углеводный компонент чаще представлен декстрин-мальтозой, оказывающей благоприятное воздействие на микробный пейзаж кишечника. В отдельных смесях углеводный компонент может быть представлен также глюкозой, сахарозой или фруктозой в различных соотношениях. Все соевые смеси лишены лактозы, поэтому они используются не только при непереносимости белков коровьего молока, но и для лечебного питания детей с лактазной недостаточностью, алактазией и галактоземией. Смеси на соевой основе обогащены витаминами, минералами, микроэлементами, таурином, т. е. максимально адаптированы для питания детей первого года жизни.
Нежелательным эффектом смесей на соевой основе является появление у детей склонности к запорам и нарастающая в последние годы аллергия к белкам сои.
Наиболее радикальным лечебным эффектом при непереносимости белков коровьего молока обладают продукты для искусственного вскармливания на молочной основе с высокой степенью гидролиза белков. К ним относятся такие смеси, как Алфаре (Нестле, Швейцария), Нутрамиген и Прегестимил (Мид Джонсон, США), Пепти-Юниор (Нутриция, Голландия).
Имеются также гипоаллергенные смеси типа Хумана ГА 1, Хумана ГА 2 (Хумана, Германия), ХИПП ГА (Хипп, Австрия), Фрисопеп (Фризленд, Голландия), которые характеризуются низкой степенью гидролиза белков коровьего молока. Показания к назначению смесей с высокой и низкой степенью гидролиза различны:
- гипоаллергенные смеси с высокой степенью гидролиза используются только с лечебной целью при наличии у ребенка аллергии к белкам молока и сои или поливалентной пищевой аллергии;
- гипоаллергенные смеси с низкой степенью гидролиза не являются лечебными и назначаются с целью профилактики пищевой аллергии к белкам коровьего молока у детей группы риска по развитию данной патологии, а именно: малышам с длительной диареей инфекционного и неинфекционного генеза, детям с аллергическим анамнезом, глубоко недоношенным детям.
Молочная основа этих смесей подвергается ферментативному гидролизу, что позволяет существенно снизить антигенный потенциал белкового компонента. Причем чем выше степень гидролиза и меньше размер пептидов, полученных в результате гидролиза, тем ниже антигенный потенциал белкового компонента смеси. В качестве белкового субстрата используются различные источники белка: казеин и сывороточные белки молока, белки мяса, бычий коллаген и др. Специальные технологии (обработка на адсорбентах) предусматривают очистку их от нежелательных продуктов гидролиза. В состав этих лечебных смесей также входят растительные масла, среднецепочечные триглицериды, полимеры глюкозы, витаминно-минеральный комплекс, таурин. Аминокислотный состав таких смесей приближен к таковому у женского молока.
Эти смеси обладают очень низкими антигенными свойствами, легко усваиваются организмом ребенка первого года жизни, не требуют напряжения ферментативной и соковыделительной функций его желудочно-кишечного тракта. Включение полимеров глюкозы (модифицированных крахмалов) способствует снижению осмолярности, а также стимулирует рост нормальной микрофлоры в кишечнике.
Отрицательной особенностью лечебных смесей с высокой степенью гидролиза белков являются неудовлетворительные органолептические свойства. Смеси имеют запах и привкус подгоревшего или прогорклого молока и дети привыкают к ним с большим трудом, даже в первые дни жизни. Необходимы большое терпение, а порой и изобретательность (вплоть до введения различных фруктовых, овощных и иных добавок) со стороны родителей и медицинского персонала, чтобы приучить ребенка к данному продукту питания.
Наконец, существует, как уже говорилось, третий вариант. Можно попытаться заменить коровье молоко в питании ребенка на молоко других животных (козье, кобылье, верблюжье). Но необходимо помнить, что это будет неполноценная замена (неадаптированное питание), которая при большом объеме и/или длительном применении неизбежно приведет к отрицательным последствиям, свойственным использованию неадаптированных смесей (перегрузка белками, жирами, диапедезное желудочно-кишечное кровотечение). Следует отметить, что в настоящее время появились попытки создания адаптированной смеси на основе козьего молока (Нэнни, Новая Зеландия).
К сожалению, при генетически детерминированном АД у детей грудного возраста диетотерапия оказывает весьма ограниченное воздействие. Значительно более эффективна она при АД, ассоциированном с пищевой аллергией. В этом случае диетотерапия является решающей.
Системная терапия АД у грудных детей крайне затруднена в силу возрастных ограничений, накладываемых на использование большинства противоаллергических препаратов. К применению у детей первого года жизни разрешены только некоторые антигистаминные лекарственные средства I поколения. Это димедрол, супрастин, фенистил, пипольфен и кетотифен (табл. 2). Назначение их показано при выраженном зуде у ребенка. При этом следует обратить внимание на две особенности антигистаминов I поколения. Во-первых, все препараты I поколения назначаются на ограниченный период времени — не более 7–10 дней, так как после 7–8-го дня начинается падение их фармакологического эффекта. Во-вторых, в раннем детском возрасте эта группа лекарственных средств может вызывать парадоксальную реакцию — возбуждение, нарушение сна, беспокойство. Особенно часто парадоксальная реакция отмечается при использовании дифенгидрамина (димедрола). Появление такой реакции является поводом к отмене препаратов.

|
| Таблица 2. Антигистаминные препараты, разрешенные к применению у детей грудного возраста |
Таким образом, основное место в терапии АД у грудных детей занимает местное лечение, которое направлено на уменьшение сухости и зуда кожных покровов и местное противовоспалительное воздействие.
Уменьшение сухости, отчасти способствующее также облегчению зуда, достигается благодаря широкому использованию увлажняющих и смягчающих средств. С этой целью прежде всего показано проведение ежедневных ванн с температурой воды, не превышающей 36°С, при этом исключается использование мыла, моющих гелей и пенок.
Процедуру приема гигиенической ванны у детей с АД следует проводить не чаще 1 раза в 10 дней, при этом необходимо использовать специальные мыла, например обогащенное липидами «мыло с кольд-кремом», мыло с нейтральной реакцией pH. Обычное туалетное мыло, мыло «Детское» и другие способны значительно усилить сухость кожи.
Помимо ежедневных ванн, следует в течение дня дополнительно орошать кожу ребенка, используя спреи термальных вод. Появление мокнутий не исключает орошения кожи и даже купания. Однако в этих случаях после купания необходима дополнительная обработка участков, на которых возникли мокнутия, примочками и влажно-высыхающими повязками.
При отсутствии мокнутий сразу после ванны необходимо обработать кожу ребенка смягчающими лечебными кремами, например кремом «Мюстела», применять который рекомендуется с периода новорожденности, или «Атодерм».
В первые дни терапии АД необходимо обрабатывать кожу ребенка смягчающим кремом многократно, до 5–10 раз. Желательно сочетать эти процедуры с орошением кожи и последующим промоканием мягкой пеленкой или салфеткой, а также нанесением смягчающего крема.
Второе направление местной терапии — назначение противовоспалительных средств. Долгое время в лечении грудных детей использовались местные средства, приготовленные на основе нафталана, дегтя, АСД III фракции и т. д. Эти препараты обладают невысокой эффективностью и в большинстве случаев представляют собой нестандартизованные лекарственные средства. Большим шагом вперед явилось появление в последние годы нового нестероидного противовоспалительного препарата — пимекролимуса (ингибитора кальциневрина) в виде 1% крема элидел. Использование этого нестероидного препарата разрешено с
3-месячного возраста. Поэтому не случайно в настоящее время местная терапия АД строится следующим образом [7]:
- при первых проявлениях дерматита рекомендуется проведение интенсивной гидратации и смягчения кожи, как описано выше;
- при прогрессировании процесса, если нет мокнутия, наряду с уходом за кожей ребенка, назначается обработка пораженных участков кремом элидел;
- только при отсутствии эффекта от использования крема элидел в терапию вводятся наружные глюкокортикостероиды.
Следует отметить, что назначение наружных глюкокортикостероидов грудным детям также имеет ряд особенностей: во-первых, используются нефторированные препараты; во-вторых, накладываются ограничения на дозирование препаратов (табл. 3). Это позволило значительно повысить безопасность современных наружных глюкокортикостеродов и использовать их длительное время, необходимое для полного исчезновения кожных проявлений АД.
Также нельзя не отметить совершенствование наружной терапии АД в грудном возрасте: широкое использование увлажнения и смягчения кожных покровов как основу терапии; своевременное (раннее) введение в схему терапии АД нестероидного препарата 1% крема элидел, сдерживающее развитие симптомов АД и существенно сокращающее потребности в использовании глюкокортикостероидных препаратов у детей грудного возраста.
Г. А. Самсыгина, доктор медицинских наук, профессор
РГМУ, Москва
По вопросам литературы обращайтесь в редакцию.
