Инородные тела бронхов у детей
29.03.2005
Клиническими симптомами инородного тела бронхов являются следующие признаки: повторные приступы кашля, повторные приступы асфиксии, повторная рвота, охриплость, одышка, бронхиальный стридор и температура тела. Из аускультативных признаков выделяют: симптом «баллотирования», сухие рассеянные хрипы над всей поверхностью легких, ослабление дыхания над участком легкого, симптом «немого» легкого, региональные сухие и влажные хрипы.
В настоящее время главным вспомогательным методом диагностики аспирированных инородных тел является рентгенологический, который включает рентгеноскопию и рентгенографию органов грудной клетки в состоянии максимального вдоха и выдоха. К рентгенологическим признакам инородного тела бронха относится: симптом «щелчка» (здоровое легкое быстрее наполняется воздухом в момент вдоха, и происходит толчкообразное смещение — «щелчок» средостения в сторону легкого, в котором имеется гиповентиляция, т. е. закупорка бронха инородным телом — положительный симптом Гольцкнехта— Якобсона, который позволяет определить не только наличие инородного тела (особенно рентгеннеконтрастного), но и его локализацию в том или ином главном бронхе); ателектаз доли легкого; ателектаз целого легкого; эмфизема целого легкого; пневмоторакс; рентгенологические признаки пневмонии. В современных условиях для диагностики инородных тел дыхательных путей используется ядерно-магнитный резонанс (ЯМР), однако его практическое применение ограничено из-за отсутствия необходимого оборудования и высокой стоимости исследования.
C. Simecek, J. Rous (1990), исследуя методом денситометрии (денситографии) региональную легочную вентиляцию пациентов в возрасте от 19 мес до 76 лет с подозрением на аспирацию неконтрастного инородного тела, пришли к выводу, что данное исследование безопасно в любом возрасте, в том числе у грудных детей, и даже при неопределенных физикальных и рентгенологических данных позволяет практически со 100% достоверностью судить о наличии инородного тела. Применение таких функциональных методов исследования бронхиальной проводимости, как спирография, пневмотахометрия, общая плетизмография, флюорометрия и др., у детей младшего возраста ограничено, так как эти исследования выполняются только в сотрудничестве с пациентом. Также в настоящее время стали гораздо реже использовать метод селективной контрастной рентгенографии.
И. М. Розенфельдом в 1958 г. была предложена схема дифференциальной диагностики инородных тел гортани, трахеи и бронхов, сохраняющая свое значение до настоящего времени.
Наличие инородного тела в дыхательных путях является показанием для его удаления. Практически важным является вопрос о степени экстренности вмешательства. Главными показаниями для срочного удаления инородного тела являются: асфиксия; баллотирование инородного тела; аспирация рентгеноконтрастных тел; наличие признаков ателектаза или эмфиземы легкого с симптомами внутригрудного напряжения вследствие пребывания инородного тела.
В настоящее время основным методом удаления инородных тел дыхательных путей является эндоскопический с использованием ригидных или фиброэндоскопов (рис.).
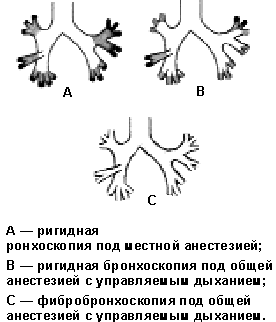
|
| Рисунок. Доступность дыхательных путей для эндоскопического исследования (по Р. А. Бариляк, А. Е. Кицера, 1971, с дополнениями Е. Е. Коломенского с соавт., 2001) |
Зоны, доступные для осмотра, окрашены в белый цвет; доступные для осмотра с помощью оптических ригидных инструментов — в серый; не доступные для осмотра — в черный.
В настоящее время при удалении инородных тел трахеи и бронхов у детей ведущую роль по-прежнему играет ригидная трахеобронхоскопия в условиях общей анестезии. При проведении ригидной трахеобронхоскопии используется объемная, инжекционная искусственная вентиляция легких (ИВЛ), осуществляемая через канал трахеобронхоскопа или через катетер, введенный параллельно тубусу. Важным моментом для производства трахеобронхоскопии является выбор трубок.
Практика показывает, что трубками № 5 из набора завода «Красногвардеец» редко удается проникнуть в гортань детей в возрасте около трех лет. Поэтому в настоящее время все исследования необходимо проводить лишь с помощью дыхательных бронхоскопов Фриделя или Шторца, представленных всеми размерами, как по длине, так и по диаметру. Кроме этого, данные системы имеют специальные оптические телескопы с различными углами осмотра, позволяющие в значительной мере осмотреть все бронхи, включая сегментарные. Создание же оптических щипцов с различными захватывающими цапками внесло революционные изменения и в саму процедуру захвата и извлечения практически всех видов инородных тел. К сожалению, часть их фрагментируется при извлечении — и процедуру удаления приходиться повторять неоднократно. При подборе размера тубуса мы в основном руководствуемся рекомендациями В. Ф. Ундрица (1960), в соответствии с которыми у детей до 1 года используют бронхоскопическую трубку диаметром 5 мм, от года до 3 лет — диаметром 6–7 мм, от 3 до 5 лет — 7–8 мм, от 5 до 8 лет — 8–9 мм, от 8 до 11 — 9–10 мм, старше 11 лет — 10–11 мм.
Вмешательство предпочтительнее производить в условиях тотальной внутривенной анестезии (ТВА) с использованием бензодиазепинов, имеющих преимущество перед нейролептиком дроперидолом на этапах как премедикации, так и общей анестезии ввиду более эффективного и управляемого седативного, гипнотического действия и менее выраженных побочных свойств. Среди транквилизаторов отчетливые преимущества перед традиционным диазепамом выявлены у мидазолама: более быстрый, мощный и хорошо управляемый седативно-гипнотический эффект. Прекрасно себя зарекомендовал в «эндоскопической анестезиологии» гипнотик ультракороткого действия — пропофол, отличающийся минимальной органотоксичностью.
Единым антиноцицептивным компонентом общей анестезии является фентанил. Методы отличаются гипнотическими компонентами, подбираемыми индивидуально: 1-й вариант — мидазолам 0,05 ± 0,01 мг/кг/час (пропофол 1,2 ± 0,6 мг/кг/час; 2-й вариант — диприван 2,34 ± 0,6 мг/кг/час; 3-й вариант — мидазолам 0,13 ± 0,007 мг/кг/час; 4-й вариант — парообразующий анестетик (закись азота). Проведенные ранее исследования показали, что у детей с инородными телами дыхательных путей, особенно при развитии пневмонии, эмфиземы, ателектаза, существенно страдают центральная гемодинамика и дыхание, в том числе и тканевый газообмен. При проведении высокочастотной ИВЛ эти отклонения нивелируются, на что указывают высокие цифры рО2 (сатурация до 100 %), адекватная элиминация СО2, стабильная гемодинамика на протяжении всего оперативного вмешательства. В то же время низкие цифры внутритрахеального давления исключают возможность баротравмы. Большая оптимизация газообмена может быть достигнута благодаря применению чрескатетерной высокочастотной искусственной вентиляции легких, которая в последние годы успешно реализуется в нескольких вариантах. Один из них (в условиях ТВА с применением миорелаксантов) предполагает интубацию трахеи пластиковым катетером с внутренним диаметром 1,4 мм, который заводится в свободный просвет гортани, в трахею, к области бифуркации трахеи. Газовая смесь поступает в дыхательные пути под давлением 0,3–0,5 кГс/см2, с плавным увеличением частоты дыхательных циклов нормовентиляции до 100 в 1 мин посредством респиратора для нормо- и высокочастотной вентиляции «Бриз-301». Увеличение частоты вентиляции способствует созданию постоянного обратного потока газа в атмосферу за счет формирования умеренного положительного внутреннего давления в конце выдоха (ПДКВ). Незначительные цифры ПДКВ (6–8 см вод. ст.) исключают опасность аспирации инородного тела в нижележащие отделы дыхательных путей, что позволяет проводить как ригидную бронхоскопию, так и фибробронхоскопию.
Умеренное ПДКВ при удалении инородного тела трахеобронхиального дерева вполне оправдано, поскольку предохраняет сегментарные бронхи от спадения вследствие разрежения в период аспирации патологического секрета. Тем самым предотвращается снижение функциональной остаточной емкости легких и коллабирование мелких бронхов и бронхиол, нарастание вентиляционно-перфузионных нарушений, развитие артериальной гипоксемии.
С целью повышения эффективности и безопасности эндоскопических вмешательств по удалению инородных тел дыхательных путей у детей в отделении анестезиологии МОНИКИ совместно с ЛОР-клиникой все шире используется методика, заключающаяся в применении ларингеальной маски (ЛМ) в сочетании с высокочастотной ИВЛ.
Ларингеальная маска была предложена в 1983 г. А. Вrain, в отделении анестезиологии МОНИКИ она применяется с 1994 г. Ларингеальная маска представляет собой воздуховод с раздувной манжеткой, который вводится в рото- и гортаноглотку вслепую, без помощи ларингоскопа, после премедикации и вводной анестезии. Правильно введенная ЛМ располагается таким образом, что верхушка раздутой манжетки находится в гипофаринксе у входа в пищевод, а верхний ее край — у корня языка. При введении фиброскопа через ЛМ в подавляющем большинстве случаев хорошо визуализируется надгортанник, который располагается внутри углубления ЛМ, что не препятствует проведению адекватной ИВЛ и манипулированию эндоскопом. Мы не отметили существенных преимуществ того или иного метода ИВЛ при экстракции инородного тела, так как в данном случае решающее значение имеют технические возможности используемой аппаратуры, и прежде всего возможность постоянного (без вентиляционных пауз) манипулирования фибробронхоскопа с инструментальным и аспирационным каналами, что в большинстве случаев ограничено диаметром применяемого воздуховода. Выбор размера воздуховода зависит от веса больного: при весе до 6,5 кг устанавливается ЛМ № 1, до 30 кг — № 2, свыше 30 кг — № 3. Поскольку диаметр трубки этой маски значительно больше диаметра соответствующей интубационной трубки, использование ЛМ № 2 и № 3 позволяет проводить осмотр трахеобронхиального дерева и удаление инородного тела фиброскопом с наружным диаметром 5,0 мм на фоне непрерывной адекватной ИВЛ. Кроме того, вследствие расположения воздуховода выше гортани, при проведении аппарата через ЛМ, в отличие от манипулирования интубационной трубкой, появляется реальная возможность осмотра гортани, ее подскладкового отела и трахеи на всем протяжении, что весьма важно при первичном поиске инородного тела.
К выявленным недостаткам ЛМ можно отнести сброс газовой смеси и перераздувание желудка, значительно чаще наблюдающиеся у детей младшего возраста вследствие анатомических особенностей строения ротогортаноглотки и негерметичности дыхательного контура. Перечисленные симптомы легко устраняются введением желудочного зонда. Следует отметить, что ларингеальная маска не предотвращает регургитации, поэтому исследование следует проводить после опорожнения желудка.
До восстановления адекватного спонтанного дыхания и защитных рефлексов ЛМ находится в гипофаринксе, не препятствуя откашливанию.
При локализации нефиксированного аспирированного предмета в гортани и верхних отделах трахеи методом выбора эндоскопии является прямая ларингоскопия. Манипуляция производится быстро, во время апноэ после масочной гипервентиляции, в течение 3–5 мин, в условиях ТВА. При этом наиболее целесообразно использование комбинации диазепама или мидазолама (дормикума) с кетамином либо диприваном (пропофолом). Препараты бензодиазепинового ряда ребенку назначают с целью премедикации. Схема анестезии на основе кетамина (калипсола) следующая: индукционная доза — 2–3 мг/кг внутривенно, поддерживающая доза — от 1 до 2 мг/кг/час, центральная аналгезия фентанилом в суммарной дозе — 0,008 мг/кг/час. Схема анестезии на основе пропофола: индукционная доза внутривенно — 2–3 мг/кг; поддержание: болюсно или микроструйно из расчета 6–9 мг/кг/ч, аналгезия фентанилом в суммарной дозе — 8 мг/кг/час. После индукции проводится преоксигенация, вслед за этим вводится запланированная доза миорелаксанта (индукционная доза дитилина — 2 мг/кг, поддерживающая — 1 мг/кг). При необходимости продолжения вмешательства пациента вновь гипервентилируют и повторно производят ларингоскопию. Ларингоскопию можно проводить в условиях так называемой назофарингеальной анестезии. В этом случае обычно осуществляется масочная галотанкислородная вводная анестезия, после достижения хирургической стадии наркоза (через один или оба носовых хода ко входу в гортань вводят один или два катетера соответственно). Поддержание анестезии проводится путем подачи газонаркотической смеси через эти катетеры.
Во время данной манипуляции возможны внезапное замыкание голосовой щели — ларингоспазм либо асфиксия, что может потребовать срочной трахеотомии. До сих пор сохраняет свое значение деление трахеотомии на верхнюю, среднюю и нижнюю. Это деление горлосечения относится к перешейку щитовидной железы, который при верхней трахеотомии остается в нижнем углу разреза кожи и рассекаемых колец трахеи (обычно от 2-го до 4-го), при средней — пересекается, а при нижней — остается интактным. Нижняя трахеотомия чаще всего рекомендуется в детской ларингологии (Ю. Б. Исхаки, Л. И. Кальштейн, 1984; М. А. Шустер с соавт., 1989; и др.).
Наша методика вскрытия просвета трахеи заключается в том, что разрез при этом напоминает перевернутую букву «Н». Вначале проводят два П-образных шва, прокалывая переднюю стенку трахеи справа и слева, отступая от средней линии на 3–4 мм с захватом двух трахеальных полуколец. Производятся один вкол у нижнего края нижнего хряща, выкол — у верхнего края верхнего хряща (обычно это 3–4-е кольца трахеи). После этого по средней линии вскрывается передняя стенка с пересечением этих колец. Затем по верхнему краю 3-го кольца и по нижнему краю 4-го в межтрахеальных промежутках проводятся два горизонтальных разреза общей длиной в 4–5 мм с одновременным раздвиганием образовавшихся створок. Нити выкалывают через края кожи и фиксируют створки узловым швом. Через 2-й и 5-й хрящи трахеи по средней линии проводят дополнительные швы, выводя их через кожу в верхнем и нижнем углах трахеостомы. Таким образом, образуется оформленная трахеостома, через которую с помощью киллиановского зеркала, укороченной трубки трахеобронхоскопа либо фиброскопа возможен осмотр всех отделов дыхательных путей, включая ретроградный осмотр гортани (подскладкового и складкового отделов). Л. А. Феркальман и соавт. (1987) предложили изложенную ниже методику трахеотомии единым блоком с помощью ультразвукового скальпеля: «В целях правильной ориентации при проведении операции трахею фиксируют большим и указательным пальцами левой руки. Ультразвуковой скальпель во включенном состоянии генератора и нажатой педали вкалывают в кожу передней поверхности шеи по средней линии в месте предполагаемого разреза и медленно в течение 8–10 сек продвигают сразу через все слои передней поверхности шеи с одновременным вскрытием просвета трахеи. Скальпель проводят в ткани пилящими движениями, с усилием на инструмент примерно 80 г. Вместе со всеми тканями при необходимости пересекают перешеек щитовидной железы без заметного кровотечения из-за выраженного гемостатического эффекта ультразвукового воздействия. При возможных небольших кровотечениях в редких случаях время нахождения инструмента в ране может быть увеличено в 2–3 раза для улучшения гемостаза или ультразвуковой скальпель боковой поверхностью прижимают на несколько секунд к мелким кровоточащим сосудам. После проведения ультразвукового скальпеля в просвет трахеи его извлекают, края раны раздвигают с помощью носового зеркала с удлиненными браншами, после чего вводят трахеостомическую или интубационную трубку. Швы на края раны не накладывают. Лигирование сосудов, как правило, не проводят».
В целях предупреждения остановки дыхания необходимо при проведении срочной трахеостомии бранши носового зеркала, введенные в рану, раздвигать медленно. Если встречаются затруднения при пальпаторном определении местонахождения трахеи и ее фиксации пальцами у больных с толстой шеей, подкожной эмфиземой, патологическими образованиями в области шеи, смещением трахеи и др., существенную помощь может оказать введение в просвет трахеи бронхоскопической трубки, с помощью которой трахея может быть приподнята к передней поверхности шеи или смещена к средней линии. Если у пациента толстая и короткая шея, вначале проводится послойный разрез кожи и подкожной клетчатки, а затем прокалываются мышечный слой и передняя стенка трахеи единым блоком.
При обычном послойном вскрытии просвета трахеи особенно полно проявляются возможности ультразвукового инструмента — речь идет о способности облегчать разделение и препаровку тканей, имеющих различную плотность. Легче отслаиваются мышцы от фасций, мышцы от щитовидной железы, а последняя — от трахеи. Особенно легко отсепаровываются рубцовые ткани и различные новообразования. Техника проведения трахеостомии единым блоком максимально упрощает операцию и сокращает время ее выполнения до 1–1,5 мин, что особенно ценно в реанимационно-анестезиологической практике.
При проведении разреза ультразвуковым скальпелем значительно облегчаются послеоперационный уход и предотвращаются послеоперационные осложнения: отсутствие швов, атравматический разрез и хорошее формирование краев раны и раневой поверхности. Реактивные явления во второй и последующие дни после операции оказываются сведены к минимуму. Заживление раны находится в прямой зависимости от времени нахождения в ней трахеостомической трубки и, как правило, заканчивается формированием нежного рубца.
При чрезвычайно экстренных вмешательствах, при острой тяжелой асфиксии, когда нет времени для трахеотомии, а интубация по тем или иным причинам невозможна, рекомендуется крико-коникотомия, т. е. вскрытие перстневидного хряща и щитоперстневидной мембраны (конической) связки (Д. А. Арапов, Ю. В. Исаков, 1964). Техника вмешательства состоит в том, что одномоментным вертикальным разрезом ниже щитовидного хряща рассекают кожу, щитоперстневидную связку и дугу перстневидного хряща. В разрез вводят любой зажим и раздвигают его бранши, что сразу обеспечивает поступление воздуха, если препятствие расположено во входе в гортань или в области голосовых складок, либо дает возможность аспирировать содержимое дыхательного тракта или даже выкашлять инородное тело. При этом следует отметить, что в середине конической связки, пронизывая ее, проходят перстнещитовидные артерии, ранение которых сопровождается кровотечением (В. К. Трутнев, 1954).
Оптимальной следует считать так называемую «контролируемую трахеотомию» — последняя выполняется уже при функционирующей интубационной трубке, проведенной через гортань в просвет трахеи. Обычно это вмешательство осуществляется у больных, длительно находящихся на ИВЛ в реанимационных отделениях. При этом сохраняется возможность выполнения трахеотомии с соблюдением правил асептики, проведения тщательного гемостаза и полной анатомичности.
В качестве эксквизитного метода удаления металлического шарика авторы предлагают ввести маслянистый йодолипол в соответствующий бронх и затем изменить положение тела таким образом, чтобы инородное тело под воздействием собственной тяжести само выкатилось в более широкий бронх или трахею.
Использование с этой же целью магнитов оказывается эффективным лишь в случае их достаточной длины и возможности удерживать груз, весом не менее 300 г. В то же время некоторые оториноларингологи успешно используют мощные глазные электромагниты МГ-1, приспосабливая к ним специально изготовленные железные сердечники в виде железных палочек.
В клинике, руководимой академиком Ю. Ф. Исаковым, «детям с металлическими инородными телами дыхательных путей (шарики от подшипников, иглы, заколки, гвозди, шурупы и другие металлические предметы) первую попытку удалить инородное тело всегда начинают с применения постоянных магнитов... Диаметр этих магнитов разный, соответственно размерам бронхов детей разного возраста. До введения магнита в бронх необходимо тщательно освободить его просвет от секрета, хорошо видеть инородное тело и только после этого ввести магнит до соприкосновения его с инородным телом».
При удалении таких крошащихся инородных тел, как орехи, фрукты и т. п., часто используется такой прием, как лаваж бронхов. С этой целью применяются стерильные физиологические растворы, которые вводятся при наличии трахеостомы в последнюю в количестве 50 мл 4–8 раз в течение 15 мин. После введения каждой порции через толстый катетер производится отсасывание, причем, по данным ряда авторов (J. O. Simenstad еt аl., 1962), аспирируется лишь 50% от введенного, вследствие того что остальное быстро всасывается. Поэтому мелкие частички инородных тел аспирируются после нескольких пропитываний. Между промываниями больному необходима обязательная дополнительная вентиляция кислородом (Д. А. Арапов, Ю. В. Исаков, 1974). При удалении живых инородных тел из нижних дыхательных путей (пиявок, аскарид, мух и т. п.) следует напомнить, что их необходимо умертвить различными жидкостями и потом удалять с помощью инструментов, лишь захватывающих, а не рвущих инородные тела, во избежание фрагментации последних.
После удаления инородных тел возможно развитие или прогрессирование бронхолегочных воспалительных осложнений. Для их предотвращения в первую очередь показан туалет бронхиального дерева с аспирацией слизи, гноя и удалением пленок сразу после извлечения инородного тела.
Слизистую оболочку бронхов и гортани целесообразно оросить смесью эфедрина, гидрокортизона и пенициллина. В случае если инородное тело привело к ателектазу, после туалета бронхиального дерева с помощью форсированного вдувания кислорода следует расправить ателектаз до восстановления вентиляционной функции легкого, что является профилактикой пневмонии. Эта манипуляция осуществляется анестезиологом.
Если все попытки удаления инородного тела из бронхов окончились неудачей, больной подлежит переводу в хирургическое отделение для торакотомии.
Лишь тесное взаимодействие оториноларинголога, педиатра, рентгенолога, анестезиолога-реаниматолога может обеспечить экстренную и безопасную помощь детям с инородными телами дыхательных путей. Должен осуществляться контроль за качеством игрушек и их соответствием возрасту. Снижение количества пострадавших детей целиком и полностью зависит от правильного воспитания родителей и взрослых, окружающих малышей, поскольку данная проблема носит также социальный характер.
В. Г. Зенгер, доктор медицинских наук, профессор
МОНИКИ, Москва
