Гипоспадия и гинекомастия — маркеры нарушения дифференцировки пола
28.09.2005
Развитие внутренних и наружных органов мужской половой системы, вторичных половых признаков протекает при функционировании пол-детерминирующих генов хромосомы Y и при включении каскада генов (локализованных на других хромосомах), участвующих в генетическом контроле дифференцировки пола и становлении гормональной регуляции, морфогенеза половых органов. Наружные половые органы начинают обособляться на 5-й неделе эмбриогенеза. Разрастание мезенхимы формирует половой бугорок с зачатком головки полового члена и половые складки, преобразующиеся в мошонку. Клетки Лейдига у 8-недельного плода мужского пола под влиянием хорионического гонадотропина (ХГ) продуцируют тестостерон. Под контролем тестостерона происходит развитие мужских половых протоков (из вольфовых каналов и канальцев верхнего участка мезонефроса) и наружных половых органов. Уровень тестостерона у 11–18-недельных плодов мужского пола соответствует таковому в крови половозрелого мужчины. При генетически обусловленном нарушении биосинтеза андрогенов и при недостаточности (или отсутствии) рецепторов к ним в клетках и тканях-мишенях морфогенез органов мужской половой системы нарушается. Мутация определенных генов приводит к недостаточности соответствующих морфогенетических событий, а нарушения структуры или количества хромосом (хромосомные мутации) формируют бисексуальные или женские половые признаки. Различные хромосомные аномалии (ХА), количественные и/или структурные, в первую очередь половых хромосом (X- и Y-гоносом), мутации генов, участвующих в контроле закладки, дифференцировки и развитии органов половой и эндокринной систем (гормоны, рецепторы гормонов), могут быть причиной аномалий пола. Последние зачастую являются следствием мозаицизма по половым хромосомам (например, 45X0/46XY, 46ХY/46ХХ) и/или генных мутаций, а также могут быть обусловлены влиянием эпигенетических факторов, патологических полиморфизмов и гаплотипов (сочетаний аллелей) и прочих генетических нарушений.
Действие других этиопатогенетических факторов, в том числе тератогенных, опосредовано реализуется через генетические механизмы. Вредные воздействия (физические, химические, биологические, из них чаще инфекционные) во время I, II триместра беременности могут сказаться на морфологической характеристике гонадостата в целом. Нельзя также сбрасывать со счетов профессиональные вредности, вредные привычки будущей матери. Большое значение имеет факт приема матерью во время беременности гормональных препаратов: эстрогенов, прогестинов. Недоразвитие кавернозных тел может быть результатом эмбриофетопатии. Генетические, эмбриотоксические и тератогенные факторы способны приводить к нарушению полового развития и нередко к поражениям других органов и систем организма. Согласно современным представлениям, в основе поражений репродуктивной системы, как правило, лежит один из перечисленных ниже механизмов: дисгенезия фетальных гонад, дефицит одного из ферментов синтеза тестостерона, нарушение метаболизма тканевого тестостерона, количественные или качественные изменения андрогеновых рецепторов в клетках-мишенях, а в отдельных случаях — воздействие избыточного количества половых гормонов (врожденная дисфункция коры надпочечников, гормонпродуцирующие опухоли, применяемые гормональные препараты).
Клинически заболевания репродуктивной системы имеют ряд общих признаков и отличаются некоторыми особенностями, связанными со степенью вовлечения в патологический процесс ее отдельных органов. Главными общими признаками являются нарушения в строении или/и развитии наружных половых органов, задержанное или преждевременное половое развитие, нередко по гетеросексуальному типу, отсутствие вторичных половых признаков или асимметрия их развития, вероятность инфертильности при достижении больным периода половой зрелости.
Основная причина формирования гипоспадии заключается в пониженном влиянии андрогенов на ткани плода в период внутриутробного развития. Это может происходить вследствие недостаточной выработки мужских половых гормонов или при нарушении рецепторной чувствительности к ним. Степень маскулинизации наружных гениталий зависит от сроков и выраженности данного состояния, которое может обусловливать развитие дистальных форм гипоспадии или проксимальных (мошоночная, промежностная, которые являются одним из главных признаков ложного мужского гермафродитизма (ЛМГ)). Снижение воздействия андрогенов на клетки-мишени у многих из этих пациентов сохраняется и после рождения (например, при синдроме тестикулярной феминизации (СТФ), дисгенезии яичек, дефекте биосинтеза тестостерона, 5-a-редуктазной недостаточности). Это при отсутствии своевременной и адекватной терапии приводит к относительному преобладанию эстрогеновых эффектов в период полового созревания. Один из них — гинекомастия. Термин складывается из двух составляющих: греческих слов gynes — женщина, mastos — молочная железа — и подразумевает увеличение молочных желез у лиц мужского пола.
До периода половой зрелости молочные железы развиваются одинаково у обоих полов. Данные экспериментальных исследований и клинические наблюдения указывают, что на состояние молочных желез у мужчин влияют те же гормоны, что и у женщин [22, 26, 27]. Около 500 генов кодируют этот процесс (Л. Ф. Курило, 2005). Регуляция роста и развития железы происходит под сложным гормональным контролем. Известно, что основным фактором роста грудных желез являются эстрогены [1, 9, 16], непосредственно воздействующие на клетки их ткани, а также прогестерон, пролактин, соматотропный гормон. Эстрогены отвечают за рост и развитие протоков и соединительной ткани, прогестерон — за рост и развитие железистой ткани, увеличение количества альвеол, рост долек. Основная роль пролактина — стимуляция секреции молока лактоцитами. Кроме того, он увеличивает количество рецепторов эстрогенов в молочной железе. Известно тормозящее влияние пролактина на функцию половых желез посредством блокирования гонадотропинов [4, 24]. Физиологическое воздействие соматотропного гормона сходно с таковым у пролактина [6]. Опосредованно на ткани молочной железы действуют и тиреоидные, глюкокортикоидные гормоны, инсулин. Маммогенный эффект половых стероидов определяется увеличением уровня инсулина и кортизола. При избытке тиреоидных гормонов увеличивается количество эстрогенов за счет стимуляции их синтеза и продукции глобулина, связывающего половые гормоны, а связанный эстрадиол наиболее доступен для клеток-мишеней, поэтому его воздействие на молочные железы будет преобладающим. Эстриол может образовываться из андрогенов и кортикостероидов путем их метаболизма в печени и жировой ткани, содержащей необходимую для этого ароматазу [9, 16].
Сложность и многогранность механизмов регуляции гормонального гомеостаза (рис. 1) обусловливает полиэтиологичность возникновения гинекомастии в различные возрастные периоды жизни мужчины, а также физиологический и патологический ее характер.
Ведущим механизмом возникновения гинекомастии считают относительную и абсолютную гиперэстрогенемию. В первом случае отношение эстрогены/тестостерон повышено вследствие уменьшения выработки тестостерона, во втором — из-за избыточной продукции эстрогенов. Однако чаще речь идет о смешанных состояниях.
Снижение продукции тестостерона отмечают при всех вариантах гипогонадизма. Первичный (гипергонадотропный) гипогонадизм возникает при несостоятельности тестикулярной ткани различного генеза, что может являться следствием ряда врожденных или приобретенных заболеваний. Среди врожденных в первую очередь следует отметить генетические и хромосомные аномалии: синдром Клайнфелтера и его «составляющие», синдром Нунан, WAGR, истинный гермафродитизм, некоторые формы ложного мужского гермафродитизма (нарушения биосинтеза тестостерона, дефицит 5-a-редуктазы, участвующей в превращении тестостерона в активный дегидротестостерон, «чистая» дисгенезия яичек или синдром Тернера (мужской вариант), редко смешанная дисгенезия яичек, синдром рудиментарных яичек). Вторичный (гипогонадотропный) гипогонадизм связывают с патологией гипоталамуса и гипофиза, который может быть врожденным и приобретенным. К первому типу относят изолированный дефицит гонадотропных гормонов с аносмией и гипосмией (синдром Кальмана) или без такового сочетания синдром Паскуалини (изолированный дефицит лютеинизирующего гормона (ЛГ), «синдром фертильных евнухов»), синдром Прадера-Вилли, синдром Лоренса–Муна–Барде–Бидля, пангипопитуитаризм. Перечисленные синдромы, сопровождающиеся врожденным первичным или вторичным гипогонадизмом, зачастую проявляют себя и гипоспадией.
Основной причиной развития гинекомастии при истинном гермафродитизме является экскреция эстрогенов овариальным компонентом гонад, приводящая к абсолютной гиперэстрогенемии у этих больных [8, 16, 19]. Другая причина в подобных случаях — это проявление первичного гипогонадизма, т. е. недостаточная продукция тестостерона порочными мужскими гонадами.
Гинекомастия развивается при генетически детерминированном нарушении андрогеновых рецепторов (синдром тестикулярной феминизации, неполная форма, синдром Рейфенштейна), в результате чего чувствительность клеток-мишеней к тестостерону снижается и превалируют эффекты эстрогенов [5, 7, 8, 11, 12, 14, 16, 19, 21]. Эта же причина зачастую приводит к неполной маскулинизации наружных гениталий во внутриутробном периоде развития у данной категории больных.
Для развития гинекомастии необязательно наличие такого фактора, как постоянно повышенный уровень женских половых гормонов (P. A. Lee, 1975). Обнаружение у многих пациентов нормального уровня эстрогенов в крови, моче натолкнуло ученых на мысль, что, возможно, отношение эстрогенов к андрогенам в крови может играть более важную роль, чем абсолютное содержание женских половых гормонов; такая закономерность выявлялась у определенного процента больных (F. Bidlingmaier, D. Knorr еt al., 1973; S. H. La Franchi еt al., 1975; D. M. Large, D. C. Anderson, 1979). Отметим, что данные о нормальном содержании и соотношении половых гормонов у пациентов с гинекомастией ни в коей мере не являются прямым доказательством непричастности этих факторов к развитию грудной железы. С известной долей вероятности можно предположить, что исходный эстрогенный (или другой гормональный) стимул уже нивелировался к тому моменту, когда производили определение гормонов крови (Е. А. Васюкова, Э. П. Касаткина, А. Н. Матковская, 1980; G. L. Nicolis et al., 1976). Поэтому нормальное содержание эстрогенов необязательно исключает возможность того, что временное его повышение или временный дисбаланс эстрогенов-андрогенов были исходной причиной развития гинекомастии. Когда гинекомастия уже сформировалась, она может сохраняться некоторое время, иногда даже годы, без дальнейшего гормонального стимула (М. А. Жуковский, Н. Б. Лебедев, 1982; S. P. Marynick, 1980). Происхождение гинекомастии нельзя объяснить, опираясь только на данные однократных определений гормонов в крови или моче, взятых в определенное время. Здесь необходимо учитывать не только содержание гормонов или взаимодействие их у конкретного пациента. Нельзя не принимать во внимание такие немаловажные факторы, как связь половых гормонов с их транспортным белком, скорость их инактивации и выделения из организма, количество и чувствительность рецепторов клеток органа-мишени, различия в кровоснабжении, фактор времени (М. А. Жуковский, Н. Б. Лебедев, 1982; S. P. Marynick, 1980; W. A. Miller, 1974).
По данным литературы, прослеживается несомненная связь между двумя этими симптомами нарушения половой дифференцировки (гипоспадией и гинекомастией), определяемая общностью этиопатогенетических факторов, которые отвечают за дисморфогенез первичных половых признаков в эмбриональном периоде (гипоспадия) и гетеросексуальное развитие вторичных — в пубертатном периоде (гинекомастия).
Психосоциальная адаптация пациентов с нарушением половой дифференцировки — сложный и многокомпонентный процесс. Формирование психосексуального статуса человека, по данным ряда исследований, происходит на этапе как пренатального, так и постнатального онтогенеза [3, 13, 17, 29, 32]. Наличие маскулинных признаков строения гениталий той или иной степени выраженности у больных с нарушениями половой дифференцировки обусловлено воздействием андрогенов на ткани плода в период эмбриогенеза. Гормональный фон определяет развитие структур головного мозга, отвечающих за формирование психосексуальной ориентации и поведение человека [2, 13, 20, 23, 30]. Основной биологический фактор у данных пациентов имеет маскулинную направленность. Определенную роль в развитии сексуального сознания индивидуума отводят социальным факторам, включающим отношение к ребенку окружающих людей, что напрямую связано с внешним соответствием его фенотипа с женским или мужским полом [2, 13, 17, 23, 29]. Отождествление себя непосредственно с одним из них начинает складываться в сознании с 2–3-летнего возраста, и далее существенное значение для формирования психологического пола будет иметь оценка своего внешнего вида [19]. Недостаток действия мужских половых гормонов, особенно на этапе формирования вторичных половых признаков в пубертатном периоде, усугубляет сложность психосексуальной реабилитации при установленном мужском поле воспитания. Уверенность родителей и самого пациента после определенного возраста в правильности выбранного пола играет решающую роль. Наличие таковой напрямую связано с адекватностью проведения адаптирующей терапии, что зависит от эффективности взаимодействия и преемственности между различными специалистами (педиатры, генетики, эндокринологи, детские хирурги, андрологи, психологи и др.). Важнейшим этапом реабилитации таких пациентов является своевременная хирургическая коррекция наружных гениталий в соответствии с выбранным полом и воспитанием.
Формирование вторичных половых признаков у пациентов с гермафродитизмом происходит в соответствии с теми определяющими биологическими предпосылками, которые у них есть. Одним из наиболее значимых признаков, отличающих женский фенотип от мужского, является размер молочных желез. Естественно, что их развитие по женскому типу будет усложнять психосексуальную реабилитацию при установлении мужского пола. Предрасполагающими факторами к этому процессу у больных с нарушениями половой дифференцировки может быть своевременно некоррегированный гипогонадизм, сопровождающийся относительным преобладанием эстрогенов при уменьшении выработки тестостерона, и наличием в кариотипе дополнительной
Х-хромосомы, что повлечет за собой как увеличение эстрогенпродуцирующих клеток, так и наличие большего количества эстрогенвоспринимающих рецепторов. Степень гипертрофии молочных желез у больных с различными вариантами гермафродитизма, зарегистрированными в мужском поле, может варьировать от незначительного субареолярного уплотнения до размеров женской груди, что обусловливает проведение корректирующей операции [18].
Под нашим наблюдением с 1998 по 2004 г. находились 98 детей в возрасте от 5 до 16 лет с гинекомастией. Среди них одностороннее увеличение молочных желез было зарегистрировано у 12 мальчиков. Они все вошли в группу больных с неустановленной причиной заболевания, в которой было всего 34 ребенка. Гипоталамический синдром диагностирован у 29 пациентов, гипогонадизм — у 8, ложный мужской гермафродитизм — у 8 (у 4 детей — синдром тестикулярной феминизации, неполная форма; у 3 — смешанная дисгенезия яичек; у 1 — 5-a-редуктазная недостаточность), синдром Клайнфелтера — у 5, заболевания щитовидной железы — у 4 пациентов (у 1 ребенка — диффузный токсический зоб, еще у 1 — узловой зоб, у 2 — аутоиммунный тиреоидит), нарушение толерантности к углеводам — у 4, вирусный гепатит — у 3, гиперпролактинемия неопухолевого генеза — у 2, врожденная дисфункция коры надпочечников — у 1 пациента. Проксимальная гипоспадия отмечалась у всех больных с ложным мужским гермафродитизмом (8 пациентов), дистальная у 2 (1 — с гинекомастией при гипоталамическом синдроме, 1 — с идиопатической гинекомастией).
Нами разработана схема верификации причины гинекомастии у детей с гипоспадией. Для этого необходимо изучить анамнез, отмечая при этом наличие в семье генетической патологии, заболеваний эндокринной системы, молочных желез, опухолевых превращений, факт приема матерью гормональных препаратов, а также воздействие профессиональных вредностей и неблагоприятной экологической обстановки во время беременности. Уточняются сроки начала заболевания, темпы его прогрессирования, соотношение с половым развитием ребенка (до, в течение или после хронологического пубертатного периода), учитывая при этом конституциональные особенности полового созревания у членов семьи. Большое внимание следует уделять наличию сопутствующей патологии и приему лекарственных препаратов, особенно средств, влияющих на метаболизм половых гормонов.
Оцениваются физическое развитие пациента, пропорции фигуры, наличие стигм дизэмбриогенеза, стрий, фолликулита и acne vulgaris на коже, количество и распределение подкожной жировой клетчатки (гиноидный, смешанный или андроидный тип), исследуется неврологический статус (особое внимание следует уделять очаговым симптомам, характерным для опухолевого процесса в головном мозге, а главное — в хиазмальной области), степень развития интеллекта, так как его снижение характерно для генетической патологии и гипотиреоза. Обязательно проверяют симптомы поражения щитовидной железы, визуально и пальпаторно определяют ее размер. По Таннеру оценивают половое развитие, соответствие его возрасту ребенка. Важное значение придают осмотру наружных гениталий: правильность строения по мужскому типу, объем и консистенция яичек, симметрия, характер их поверхности, наличие дополнительных объемных образований, болезненности, наличие жидкости в оболочках и пастозности мошонки. Осматривая молочные железы, особенно при односторонних формах гинекомастии, необходимо удостовериться, что имеет место увеличение именно их ткани, т. е. что оно произошло не за счет дополнительного опухолевидного образования на передней грудной стенке, не связанного с ареолой и соском. Измеряют объем желез по формуле расчета объема полусферы V = 0,54 х L3, где L — расстояние от соска до субмаммарной складки в сантиметрах. Определялся диаметр ареолы, ее цвет, качество соскового рефлекса, наличие отделяемого из соска. Пальпацией оценивают ткань желез, главным образом ее консистенцию, наличие болезненности и уплотнений. Контролируют состояние регионарных лимфоузлов.
Если увеличение молочных желез возникает одновременно с пубертатным периодом, носит симметричный характер и его объем не превышает диаметра ареолы, а также клинически не выявляется никаких симптомов поражения эндокринной системы и общесоматической патологии, то пациенты данной группы не нуждаются в дальнейшем обследовании и наблюдаются у эндокринолога амбулаторно, с контрольными осмотрами 1 раз в 6–12 мес. Обязательное лабораторное и инструментальное обследование проводят всем остальным детям. Оно включает общие анализы крови и мочи, биохимический анализ крови, определение гормонального профиля: ЛГ, фолликулостимулирующий гормон (ФСГ), тестостерон, эстрадиол, тиреотропный гормон (ТТГ), пролактин; цитогенетическое исследование, сонографию молочных желез. В зависимости от клинических проявлений и с учетом предполагаемого сегмента поражения применяют дополнительные методы: более развернутое гормональное обследование (в том числе стимуляционные пробы с ХГ, диферелином, тестенатом), ультразвуковое, рентгенологическое; компьютерную (КТ) и магнитно-резонансную томографию (МРТ); тонкоигольную пункционную биопсию. В обследовании принимают участие врачи различных профилей: эндокринологи, педиатры, генетики, специалисты по лучевой диагностике, неврологи, урологи, онкологи, цитологи, медицинские психологи (оценка полового самосознания, интеллекта, психосексуальной адаптации) и др.
Таким образом, диагностику патологии, сопровождающейся гинекомастией, и решение тактических задач можно представить следующим образом.
- Анамнез.
- Осмотр. Отделение группы наблюдения: группы нуждающихся в дальнейшем неспецифическом обследовании и группы нуждающихся в дальнейшем специфическом обследовании в зависимости от предполагаемого сегмента поражения.
- Общие (неспецифические) методы обследования (общеклинические анализы, вышеперечисленные гормоны, УЗИ молочных желез) — всем, кроме группы наблюдения.
- Специфическое дообследование, наблюдение или лечение основного заболевания и гинекомастии.
- Специфические методы обследования (нестандартное гормональное исследование, гормональные и лекарственные пробы, кариотипирование и цитогенетический анализ, развернутое УЗИ, КТ, МРТ, биопсия и др.).
- Наблюдение или лечение основного заболевания и гинекомастии.
В зависимости от установленного варианта ложного мужского гермафродитизма выбирают основное направление реабилитационных мероприятий: маскулинизация или феминизация. Их успех во многом зависит от своевременности и правильности установления диагноза, а также от адекватности лечения, включающего оперативную коррекцию гениталий в соответствии с выбранным зарегистрированным полом ребенка и необходимую в ряде случаев заместительную гормональную терапию. Немаловажен постоянный контроль физического, полового и психического статуса пациентов.
|
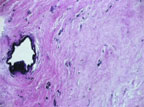
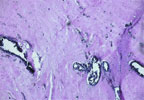
| Рисунок 2. Патоморфологическая картина при гинекомастии (преобладает интерстициальный компонент с явлениями фиброза (а) и гиалиноза(б)) |
Оперативное лечение гинекомастии носит эстетический характер, так как абсолютных показаний к нему мы не выявили. Формулируются они только при желании пациента и его родителей, когда косметический дефект вызывает проблемы психосоциального характера, что подтверждает психологическое тестирование. При этом следует заметить, что вероятность регресса увеличенных молочных желез очень мала, так как их объем зависит в основном от количества интерстициальной ткани, а со временем отмечается нарастание фиброза и гиалиноза, что подтверждают патоморфологические исследования (рис. 2 а, б). По нашим наблюдениям, идиопатическая односторонняя гинекомастия, возникавшая задолго до пубертатного периода (в 5–8 лет), также не исчезает, а наоборот прогрессирует. Немаловажен и тот факт, что возникновение злокачественной опухоли на фоне персистирующей гинекомастии констатируют у взрослых в 3,9–17% случаев. Подавляющее большинство исследователей считают, что в 20–60% случаев рак мужской молочной железы возникает на фоне гинекомастии. Некоторые указывают на повышенную вероятность малигнизации у больных с синдромом Клайнфелтера.
По сути, основная причина развития гинекомастии у пациентов с ЛМГ — несвоевременно или неадекватно коррегированный гипогонадизм, за исключением неполной формы синдрома тестикулярной феминизации, когда консервативное лечение неэффективно, а попытки его проведения следует признать безосновательными. Гормональная терапия гипогонадизма заключается в назначении препарата тестостерона (омнадрен 250) в хронологическом пубертатном периоде после исследования гормонального профиля (ЛГ, ФСГ, тестостерон). Дозу препарата подбирают индивидуально, в зависимости от уровня тестостерона в крови, который на фоне заместительной терапии должен быть приближен к возрастным показателям. Начинают введение омнадрена с 0,5 мл в месяц внутримышечно.
Хирургическую коррекцию гинекомастии проводят после общесоматического обследования и при отсутствии противопоказаний. Необходимо учитывать, что операция проводится под эндотрахеальным наркозом и длится около 1,5–2 ч. В связи с этим перед операцией, во время и после нее ребенку назначают инфузионную терапию глюкозо-солевыми растворами в суточном объеме до 30–50 мл/кг, гемостатическую (викасол — 1 мл 1 раз в сутки в течение 5 дней, этамзилат — 1–2 мл 3 раза в сутки в течение 5 дней, аскорутин — по 1 таблетке 3 раза в сутки в течение 10 дней), антибактериальную терапию препаратом широкого спектра действия (например, цефазолин 50 мг/кг/сут на три введения внутримышечно). В послеоперационном периоде больной длительное время (2–3 нед) носит циркулярную давящую повязку, которая перебинтовывается 1 раз в день. Применяют эластичные бинты средней степени компрессии (24 мм рт. ст.). Непременным условием формирования незаметных рубцов в отдаленном послеоперационном периоде является комплексная противорубцовая терапия (мазь или гель контрактубекс 2 раза в сутки не менее 1 мес, электрофорез с лидазой — 2 курса по 10 сеансов). Ее начинают с 14-х суток после хирургического вмешательства. Для улучшения косметического эффекта важно регулярное выполнение пациентом физических упражнений, направленных на укрепление мышц грудной клетки и плечевого пояса. Физические нагрузки рекомендуют через 1,5–2 мес после операции.
В заключение отметим, что формирование гипоспадии в период эмбрионального развития (первичное внешнее проявление дисморфогенеза половой системы) и гинекомастии у этих пациентов в подростковом возрасте (вторичное проявление) взаимосвязаны, т. е. являются типичными для одного из классических вариантов нарушения дифференцировки пола (как при синдроме тестикулярной феминизации, неполной форме) или могут рассматриваться как необязательные проявления гипогонадизма и нарушения синтеза активного тестостерона, зачастую сопровождающих эту патологию.
Необходимо учитывать возможность возникновения гинекомастии на фоне различных эндокринных и общесоматических заболеваний. Последний факт определяет важность проведения комплекса диагностических мероприятий у больных с гинекомастией. Увеличение молочных желез у больных с нарушениями половой дифференцировки, зарегистрированных в мужском поле с соответствующим воспитанием, является манифестным гетеросексуальным признаком и усложняет их психосексуальную адаптацию. Своевременная и адекватная гормональная терапия гипогонадизма при ложном мужском гермафродитизме, оперативное лечение гинекомастии, как одной из составляющих маскулинизирующей пластики, позволяют повысить эффективность медико-психологической реабилитации этой сложной категории пациентов.
Литература
- Бодяжина В. И., Сметник В. П., Тумилович Л. Г. Неоперативная гинекология: Руководство для врачей. М.: Медицина, 1990. С. 489–490.
- Бухановский А. О., Андреев А. С. Структурно-динамическая иерархия пола человека. Ростов н/Д Дону, 1993.
- Васильченко Г. С. Частная сексопатология. М., 1983. Т. 2.
- Васюкова Е. А., Касаткина Э. П., Матковская А. Н. Персистирующая юношеская гинекомастия и ее лечение//Вопросы охраны материнства и детства. 1980. № 12. С. 7–11.
- Голубева И. В. Гермафродитизм. М.: Медицина, 1980. 159 с.
- Дедов И. И., Мельниченко Г. А. Персистирующая галакторея-аменорея. М.: Медицина, 1985. С. 254.
- Дедов И. И., Мельниченко Г. А., Фадеев В. В. Эндокринология. М.: М
А. Б. Окулов, доктор медицинских наук, профессор
Д. Н. Бровин
Е. А. Володько, кандидат медицинских наук, доцент
РМАПО, МГМСУ, Москва
Врезки:
