Комплексная терапия вирусных гепатитов
24.11.2005
Вирусные гепатиты (ВГ) — это группа инфекционных заболеваний печени, вызываемых мельчайшими внутриклеточными паразитами: вирусами. К настоящему времени наиболее полно изучены вирусы гепатитов А, В, С, Д и Е.
Гепатит А. Инфицирование вирусом гепатита А приводит к развитию заболевания, почти всегда заканчивающегося выздоровлением и стойкой пожизненной невосприимчивостью к повторному заражению. Гепатит А тяжело протекает у грудных детей и пожилых людей. Передается вирус гепатита А фекально-оральным путем, поэтому его называют «болезнью грязных рук». Больной человек становится источником инфекции на очень ранней стадии развития гепатита А. В этот период пациент еще не чувствует себя больным и у него не наблюдается симптомов желтухи. Против гепатита А имеется вакцина хаврикс, которая обладает иммуномодулирующим действием и обеспечивает активный иммунитет против вируса гепатита А длительностью 15–20 лет (при применении двухдозовой схемы вакцинации). Но так как многие люди переносят это заболевание бессимптомно, перед вакцинацией надо удостовериться, что антитела к вирусу гепатита А отсутствуют.
Гепатит В. По расчетам ВОЗ, в мире насчитывается около 300 млн человек — носителей HВsAg, из них в России — около 2 млн. Вирус гепатита В передается от инфицированного человека к здоровому парентерально. Заражение возможно при попадании инфицированной крови на поврежденную кожу, слизистые покровы или непосредственно в кровь. Основную группу риска составляют люди, использующие внутривенные наркотики, токсикоманы, а также лица, ведущие беспорядочную половую жизнь. Вирус гепатита В относится к одним из наиболее контагиозных.
Против вируса гепатита В имеется эффективная вакцина энджерикс В, которая защищает от заражения на 5–8 лет. Некоторые люди из-за особенностей своей иммунной системы не поддаются вакцинированию, поэтому после прививки надо удостовериться в появлении защитных антител в организме.
В результате иммуномодулирующего действия вакцины формируется активный иммунитет против всех видов штаммов. Одна доза суспензии содержит вакцину против гепатита В — очищенный основной поверхностный антиген вируса гепатита В, полученный с помощью технологии рекомбинантных ДНК.
Помимо этого, для вакцинирования используется твинрикс — комбинированная вакцина против гепатитов А и В, считающаяся на сегодняшний день очень перспективной.
Гепатит С. Наиболее коварным и опасным среди всех ВГ считается гепатит С, передающийся парентерально. Это заболевание в 85% случаев приводит к развитию хронического гепатита С, заканчивающегося через 15–25 лет циррозом или первичным раком печени. Острый и хронический гепатит С очень часто протекают бессимптомно, из-за чего инфицированные люди вовремя не обращаются за медицинской помощью и могут заражать окружающих. Из-за скрытого мягкого течения гепатит С был назван «ласковым убийцей». Лечение гепатита С очень дорогостоящее, а вероятность полного выздоровления невысока. Вакцина против гепатита С пока еще не создана.
Гепатит Д. Вирус гепатита Д никогда не инфицирует сам, ему нужен помощник — вирус гепатита В. При этом развивается тяжелое заболевание, которое с большой вероятностью может привести к хроническому гепатиту Д с транформацией в цирроз. Пути передачи и источник инфекции при гепатитах Д и В аналогичны. Лица, имеющие антитела против гепатита В, никогда не заболеют гепатитом Д. Таким образом, вакцинация от гепатита В защищает и от опасного гепатита Д.
Гепатит Е. Вирусный гепатит Е — довольно редкое для нашей страны заболевание. Чаще всего оно встречается в странах Юго-Восточной и Центральной Азии, в Северной и Центральной Африке, Центральной Америке. Передается гепатит Е фекально-оральным путем. Наибольшую опасность это заболевание представляет для беременных женщин. Хронических форм у гепатита Е нет. Вакцина против него еще не создана.
Среди перечисленных разновидностей вирусных гепатитов наиболее опасными и распространенными являются гепатиты В и С. Поэтому рассмотрим более подробно особенности их эпидемиологии, этиологии, патогенеза и лечения.
Вирусный гепатит В (ВГП). Вирус гепатита В является ДНК-содержащим и относится к семейству гепаднавирусов. Его диаметр — 42 нм. Центральное положение занимает нуклеокапсид, или «ядро» (core). Нуклеокапсид имеет 27 нм в диаметре, в его состав входит «сердцевинный антиген HвcAg», а также — антиген HBeAg. Нуклеокапсид окружен оболочкой толщиной около 4 нм, белок которой назван «поверхностным антигеном», или HBsAg. Широко распространено другое его название — «австралийский антиген».
Иногда оболочка вирусной частицы (она же — поверхностный антиген HBsAg) простирается в виде длинного «цоколя лампы» по одну сторону от нуклеокапсида. Поверхностный антиген производится в большом избытке в крови инфицированных людей, его нитевидные и сферические частицы обнаруживаются даже в отсутствие нуклеокапсида. Нитевидные частицы имеют различную длину, их средний диаметр 22 нм.
Основная опасность гепатита В в том, что около 5–10% зараженных им лиц становятся хронически инфицированными. В будущем незначительная часть этих людей выздоравливает, а у остальных на всю жизнь остается хронический гепатит, который может постепенно перейти в цирроз печени.
Источником инфекции являются:
- больные острым гепатитом В;
- инфицированные вирусом гепатита В;
- медицинские инструменты и оборудование, не прошедшие соответствующую санитарную обработку.
Международная Консультативная гепатологическая группа предложила следующую методику обследования пациента со впервые выявленной HBV-инфекцией.
- Детальный сбор анамнеза и осмотр больного, необходимые для оценки болезни и возможных ее внепеченочных проявлений.
- Лабораторные исследования:
– обязательные — в сыворотке крови HВsAg, HВeAg, АЛТ, альбумин, количество тромбоцитов;
– рекомендуемые — HBV-DNA сыворотки (особенно если обнаружен HВeAg), АСТ (полезно при далеко зашедшей стадии заболевания или при злоупотреблении алкоголем), билирубин, щелочная фосфатаза, протромбиновое время, общий анализ крови.
- Биопсия печени. При нормальном уровне АЛТ (если нет других косвенных признаков болезни печени) и наличии декомпенсированного цирроза печени она не проводится. Ее рекомендуется проводить для определения стадии заболевания у больных:
– с повышенной активностью АЛТ сыворотки или другими признаками активной болезни;
– при принятии решения о начале противовирусной терапии.
- Ультразвуковое исследование, назначаемое с целью:
– исключения гепатоцеллюлярной карциномы (ГЦК);
– определения стадии поражения печени: гепатит, цирроз.
Лечение
Цели медикаментозной терапии хронического гепатита В (ХГВ):
уменьшение степени воспалительного процесса в печени, предотвращение прогрессирования заболевания и улучшение его исхода;- достижение иммунологического контроля сероконверсии HВeAg в anti-HВe;
- подавление репликации вируса;
- улучшение качества жизни пациентов, особенно имеющих внепеченочные проявления HBV-инфекции.
В качестве золотого стандарта для лечения больных ВОЗ рекомендует интерферон альфа-2а — роферон А, пегасис — первый из интерферонов (ИФН), полученный рекомбинантным методом. Коммерческие названия интерферона альфа: реаферон, интрон А, пегинтрон. Эффективность этих препаратов объясняется тем, что по последовательности аминокислот они наиболее близки к человеческому ИФН.
Список ИФН, предлагаемых для лечения ВГ, постоянно расширяется. Сегодня появились новые препараты — альфаферон, рекомбинантный ИФН альфа-2 — хеберон-альфа-Р.
Побочные эффекты, требующие прекращения интерферонотерапии:
- депрессия;
- выраженные лейко- и тромбоцитопения;
- тиреоидит;
- системные проявления HBV-инфекции.
Применение препаратов ИФН для лечения ВГВ у детей ограничено из-за вызываемых ими побочных явлений. Для использования в педиатрической практике специально был разработан отечественный препарат виферон.
Виферон представляет собой комбинированный препарат, состоящий из рекомбинантного ИФН альфа-2 (реаферон) и антиоксидантов (токоферола ацетат и аскорбиновая кислота). Препарат применяют в виде ректальных свечей, что дает возможность пролонгировать циркуляцию ИФН в сыворотке крови и избежать побочных явлений, которые возникают при парентеральном введении ИФН.
Противопоказания к назначению ИФН альфа следующие:
- аутоиммунное заболевание в анамнезе;
- почечная недостаточность;
- эпилепсия;
- ранее проводимая длительная иммуносупрессивная терапия;
- гиперчувствительность к препарату;
- тяжелое заболевание сердечно-сосудистой системы.
При наличии противопоказаний к проведению ИФН-терапии рекомендуется применение препарата ламивудин.
Ламивудин (зеффикс) — новый препарат из класса нуклеозидных аналогов, созданный для лечения ХГВ.
Критерии отбора пациентов для проведения терапии ламивудином:
- непереносимость ИФН;
- пациенты с репликацией HBV (наличие HBeAg и HBV-DNA в сыворотке);
- наличие заболевания печени (повышение активности АЛТ сыворотки или патологические изменения в гистологическом исследовании ткани печени);
- декомпенсированный цирроз печени и сохраняющаяся репликация HBV;
- внепеченочные проявления репликации HBV;
- пациенты до и после трансплантации печени.
При выборе терапии очень важно, чтобы пациент имел возможность четко выполнять указания врача, а также удобство терапии (табл. 1). Зеффикс назначается 1 раз в день в виде таблетки, содержащей 100 мг ламивудина. ИФН альфа используется как минимум 3 раза в неделю в дозе 5–10 МЕ подкожно или внутримышечно.
Противопоказанием к назначению ламивудина является гиперчувствительность к препарату.
Критерии, использующиеся для оценки эффективности терапии ламивудином у ранее не лечившихся пациентов:
- выраженное подавление концентрации HBV-DNA;
- снижение концентрации и исчезновение HВeAg и появление anti-HBe;
- уменьшение воспаления в ткани печени;
- снижение прогрессирования фиброза;
- уменьшение прогрессирования в цирроз.
Показания для прекращения терапии ламивудином:
- подтвержденная сероконверсия HвeAg;
- развитие побочных реакций;
- беременность;
- отсутствие эффекта.
Повышение активности АЛТ сыворотки после отмены ламивудина происходит у 25% пациентов. Повышение активности АЛТ наблюдается в первые 4 мес после отмены препарата. Чаще активность фермента возвращается к норме самостоятельно, однако возможно возобновление терапии ламивудином.
Кроме указанных препаратов, в России и некоторых странах СНГ для лечения ХГВ используются индукторы ИФН (амиксин, неовир, ридостин, циклоферон). Данных о применении индукторов ИФН при ХГВ в зарубежной литературе не найдено, а представленные в российской медицинской литературе материалы не позволяют сделать вывод о целесообразности их назначения, так как опубликованные исследования не соответствуют стандартам доказательной медицины.
Пациенту следует рекомендовать полное исключение алкоголя, вакцинацию против гепатита А, а также разъяснить вероятность инфицирования окружающих, посоветовать вакцинацию ближайшим членам семьи. Необходимо разъяснить важность постоянного наблюдения у специалистов и регулярного контроля лабораторных показателей.
У большинства реконвалесцентов гепатита В формируется невосприимчивость к повторному заболеванию.
Вирусный гепатит С. По этиологии вирусный гепатит С занимает лидирующее место в сравнении с алкогольными, лекарственными и другими гепатитами (рис. 1). Согласно имеющимся данным в мире насчитывается около 500 млн инфицированных вирусом гепатита C (ВГС). Примерно у половины из них способ передачи инфекции неизвестен.
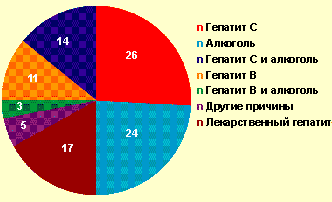
|
| Рисунок 1. Этиологическая структура хронических гепатитов |
В последнее время и в России имеет место резкая активизация эпидемического процесса гепатита C. Отмечен рост показателей заболеваемости острым гепатитом С: с 3,2 случаев на 100 000 населения в 1994 г. до 19,3 на 100 000 в 1999 г.; часто поражаются лица молодого возраста; имеет место высокий уровень хронизации с возможным исходом в цирроз и первичный рак печени.
Вышеперечисленные факторы определяют повышенное внимание к этому заболеванию, актуальность и важность его дальнейшего изучения и подбора рациональных методов диагностики, лечения и профилактики.
Пути заражения следующие:
- инъекции нестерильными иглами;
- гемодиализ;
- татуировки;
- повреждение кожных покровов иглами и острыми краями инструментов;
- передача со слюной;
- перинатальный;
- половые контакты;
- переливания крови и ее препаратов.
К группам риска относятся наркоманы, заключенные, больные, получающие сеансы гемодиализа, медицинские работники, работающие в контакте с иглами, острыми инструментами, реципиенты донорской крови.
ВГС — член семейства флавивирусов. Геном ВГС представлен однонитевой РНК, протяженностью около 10 000 нуклеотидов. ВГС вызывает заболевание только у человека.
По внешним параметрам это обычный мелкий сферический вирус, имеющий оболочку. Свойства живых существ кодируются в генах, совокупность которых составляет геном. У ВГС очень маленький геном, в нем всего один ген, в котором зашифрована структура девяти белков. Эти белки участвуют в проникновении вируса в клетку, в создании и сборке вирусных частиц и в переключении на себя некоторых функций клетки. Три белка вируса, участвующие в формировании вирусной частицы, называются структурными, остальные шесть белков выполняют разные ферментативные функции и носят название неструктурных.
Геном ВГС представлен одной нитью рибонуклеиновой кислоты (РНК), которая заключена в капсулу. Эту капсулу называют капсидом, а образующий ее белок — нуклеокапсидным белком. Для обозначения этого белка используют также названия «кор» или «сердцевинный белок». Этот белок играет очень важную функцию в сборке вируса, регуляции синтеза вирусной РНК и, что самое неприятное, он может нарушать иммунный ответ инфицированного человека. Капсид с РНК, в свою очередь, заключен в оболочку из липидов (жироподобных веществ) и белков. Эти белки имеют свое название — оболочечный белок 1 (краткое обозначение Е1) и оболочечный белок 2 (Е2). Белки Е1 и Е2 образуют комплекс, главными функциями которого являются обеспечение связывания вируса с клеткой и проникновение в нее. Если бы удалось создать лекарственный препарат, нарушающий эти процессы, можно было бы победить гепатит С. Но, к сожалению, до сих пор нет возможности детально изучить процесс связывания вируса с клеткой и проникновения в нее. Вирус, попав в кровь, разносится по всему организму. В печени он присоединяется к поверхностным структурам гепатоцита и проникает в него. Жизнедеятельность гепатоцита нарушается, основные структуры клетки теперь работают на вирус, синтезируя вирусные белки и РНК. Новые собранные вирусные частицы выходят из клетки и начинают заражать здоровые гепатоциты. Длительное присутствие вируса в печени приводит к гибели ее клеток и даже к их перерождению в злокачественные (раковые) клетки. Схематично жизненный цикл вируса гепатита С представлен на рисунке 2.
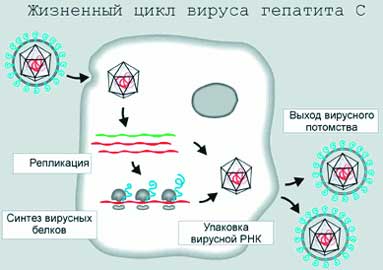
|
| Рисунок 2. Жизненный цикл вируса гепатита С |
В сыворотке крови больного и вирусоносителя концентрация ВГС значительно меньше соответствующих показателей при гепатите В и определяет более высокую инфицирующую дозу ВГС по сравнению с вирусом гепатита В.
Идентифицировано шесть генотипов вируса. В Российской Федерации чаще всего выявляют генотипы 1b и 3a этого вируса.
Лабораторная диагностика гепатита С. Лабораторная диагностика гепатита С основана на выявлении специфических маркеров инфицирования ВГС (анти-ВГС-IgM/G, РНК ВГС) и в основном проводится диагностическими препаратами Elisa, Riba и La Roсhe, разрешенными МЗ РФ.
Алгоритм лабораторного обследования пациентов на наличие ВГС представлен на рисунке 3.
При превышении двух норм показателей биохимического спектра сыворотки крови: АЛТ, АСТ, ЩФ, общего билирубина — проводится иммунно-ферментный анализ (ИФА) на анти-HCV. Наличие нормальных показателей биохимического спектра предполагает наблюдение пациентов лечащим врачом в соответствии с медицинскими стандартами. В случае положительного результата при проведении ИФА, а также для выявления РНК ВГС и определения генотипа и уровня виремии используется полимеразная цепная реакция (ПЦР) с целью подбора противовирусной терапии.
В случае превышения нормы показателей печеночных проб и отрицательного результата ИФА, а также при превышении нормы в показателях печеночных проб, положительного результата ИФА и отрицательного результата ПЦР проводится динамическое наблюдение 1 раз в 3 мес. При повышенных показателях печеночных проб, положительных результатах ИФА и ПЦР проводятся клиническая диагностика, подбор противовирусной терапии и контроль за эффективностью лечения вирусного гепатита С.
Клиническая диагностика гепатитов С. Вирусный гепатит С подразделяется на острый и хронический.
Острый гепатит С (ОГС) — инфекция, вызванная ВГС.
В клинически выраженных случаях характеризуется симптомами острого поражения печени, которое чаще всего протекает с умеренной интоксикацией и в большинстве случаев заканчивается развитием хронического гепатита.
Хронический гепатит С (ХГС) — это диффузное заболевание печени, продолжительностью 6 и более месяцев, причиной которого является ВГС.
Диагноз ОГС основывается на комплексе клинических (увеличение печени и селезенки), биохимических (повышение уровня активности аминотрансфераз — АСТ, АЛТ), вирусологических (наличие в крови РНК ВГС и/или анти-ВГС) данных, которые имеют четкую связь с парентеральными манипуляциями за 1-4 мес до его развития: переливанием крови, хирургическими операциями, первой инъекцией наркотических средств и т. п. Антитела к белкам, кодируемым зоной РНК ВГС NS3 и NS5, не являются абсолютными маркерами как ОГС, так и ХГС.
У большинства пациентов отсутствуют признаки острого гепатита. Обнаружение РНК ВГС на фоне анти-ВГС не позволяет отличить ОГС от обострения ХГС. Диагностика ОГС в большинстве таких случаев должна базироваться на наличии соответствующих данных эпидемического анамнеза за 1–4 мес до впервые выявленных признаков гепатита С — анти-ВГС, гиперферментемии, нарушении пигментного обмена.
Больной ОГС подлежит диспансерному наблюдению в кабинете инфекционных заболеваний.
Критериями для постановки диагноза ХГС являются увеличение печени и селезенки, гиперферментемия и анти-ВГС в крови сроком не менее 6 мес, при исключении других хронических заболеваний печени, согласно международной классификации 1994 г. Точный характер поражения печени, а именно степень некрозо-воспалительных изменений и стадию фиброза, позволяет определить биопсия печени.
Наиболее частыми морфологическими признаками ХГС являются:
- хронический гепатит с минимальными клинико-лабораторными проявлениями (см. ниже);
- лимфоидные фолликулы;
- лобулярные некрозы и лимфоидные инфильтраты, жировая дистрофия, ацидофильные тельца;
- HCV-антиген в ткани печени (гистохимическое свечение);
- HCV РНК (ПЦР).
Современная классификация хронического гепатита, разработанная совместно гепатологами Европы и США, основана на определении степени активности (оценка тяжести) и стадии (оценка прогрессирования) заболевания. Для оценки тяжести хронического гепатита наиболее широко используется индекс гистологической активности Кноделя, имеющий четыре компонента, каждый из которых оценивается по балльной системе (табл. 2). На основании суммарного индекса, полученного при оценке трех первых компонентов, выделяются: минимальный, слабовыраженный, умеренный и тяжелый хронический гепатит (табл. 3). Четвертый компонент (отсутствие или наличие фиброза, цирроз) в действительности характеризует стадию заболевания (табл. 4), коррелируя с другими методами оценки фиброза.

|
| Оценка индекса гистологической активности |

|
| Соответствие индекса гистологической активности степени тяжести хронического гепатита |

|
| Стадии хронического гепатита |
Окончательный диагноз ХГС, согласно предложенной классификации, должен основываться на определении этиологии, степени активности и стадии заболевания.
Наличие или отсутствие РНК ВГС, как правило, не является диагностическим критерием ХГ С, а определяет только фазу процесса (активный, неактивный).
Клиника
Три обстоятельства определяют течение HCV-инфекции.
- Бессимптомное течение острой инфекции: пациенты могут не подозревать о наличии у них инфекции и служить невольным источником заражения окружающих.
- Прогрессирование в хронический гепатит: более чем у 60% инфицированных вирусом после острой фазы не происходит элиминации вируса и развивается ХГС.
- Риск развития цирроза печени и ГЦК: ХГС является потенциально фатальным заболеванием. Неуклонно прогрессирующее поражение печени протекает часто бессимптомно, проявляясь клинически только на стадии цирроза печени или ГЦК, когда лечение становится неэффективным.
К факторам риска хронизации HCV-инфекции относятся:
- посттрансфузионное заражение (попадание большого количества вируса, в отличие от спорадических случаев);
- парентеральное заражение;
- массивные гемотрансфузии;
- тяжелое течение острой инфекции;
- высокий уровень АЛТ во время острой инфекции;
- значительные колебания уровня АЛТ во время острой инфекции;
- выявление anti-HCV.
Инкубационный период при НCV-инфекции длится в среднем около 2 нед, но может достигать и 26 нед.
Острая HCV-инфекция сопровождается желтухой (30% случаев), при этом преджелтушный период у многих больных отсутствует. Характерно изменение уровня печеночных ферментов (АЛТ), которое в целом менее выражено, чем при гепатите В. РНК вируса обнаруживается в сыворотке крови и печеночной ткани очень рано, а продукция антител к неструктурным антигенам HCV является довольно поздней.
В большинстве случаев течение HCV-инфекции является хроническим. Такое течение заболевания наблюдается примерно у 70% пациентов, перенесших острую HCV-инфекцию, но часто развивается и без предшествующей острой формы. Как правило, заболевание протекает клинически бессимптомно и сопровождается периодическим повышением уровня ферментов (преимущественно АЛТ) и характерными гистологическими изменениями. Степень повышения печеночных ферментов при этом не коррелирует с тяжестью повреждения ткани печени.
Хроническая НСV-инфекция примерно у 20% больных приводит к развитию цирроза (вероятность цирроза у пациентов с гепатитом С значительно выше, чем при гепатите В) и у части пациентов — к последующему развитию гепатоклеточной карциномы.
До сих пор остается неясным, насколько часто ВГС может индуцировать фульминантный гепатит, но считается, что такое его течение не является типичным для этой инфекции.
Внепеченочные проявления хотя и встречаются, однако не являются типичными для этой формы вирусного гепатита. К ним относятся:
- артрит;
- сывороточноподобная болезнь;
- мультиформная эритема;
- тромбоцитопения;
- васкулит;
- другие проявления, которые принято называть системными.
У большинства же инфицированных болезнь протекает субклинически.
Лечение
Лечение больных с ХГС должно проводиться в центрах, обеспечивающих соблюдение правил санэпидрежима, специалистами-гепатологами (инфекционистами и гастроэнтерологами).
При наличии у больных тяжелых сопутствующих заболеваний лечение ХГС должно проводиться гепатологами совместно с другими специалистами — согласно профилю заболевания пациента (урологом, онкологом, кардиологом, эндокринологом, венерологом и др.).
Для лечения больных ХГС рекомендуется использовать интерферон альфа-2а — роферон А.
ИФН-терапия безусловно показана:
- взрослым больным от 18 до 60 лет;
- при постоянном повышении уровней АЛТ;
- при наличии РНК ВГС в крови;
- при наличии в биоптате печени умеренно выраженного воспалительного процесса или фиброза.
В случае наличия вышеперечисленных показаний к ИФН-терапии первостепенной задачей клинициста является оценка ее возможной эффективности для каждого конкретного пациента. Основанием для назначения монотерапии ИФН может служить наличие следующих факторов, указывающих с большой долей вероятности на конечный благоприятный лечебный эффект:
- молодой возраст на момент заражения (до 40 лет);
- женский пол;
- отсутствие избыточного веса;
- повышенные уровни γ-глютамилтранспептидазы и АЛТ в сыворотке крови;
- наличие умеренной степени активности процесса и минимального фиброза по данным биопсии печени;
- невысокий уровень РНК ВГС;
- «не 1» генотип ВГС.
Отсутствие этих факторов может рассматриваться как показание к назначению комбинированной терапии.
Стандартной монотерапией ИФН альфа является введение 3 млн МЕ препарата трижды в неделю в течение 12 мес, при условии исчезновения РНК ВГС через 3 мес от начала лечения. В случаях обнаружения РНК ВГС после 3 мес лечения продолжать терапию по указанной схеме нецелесообразно.
Однако применение данного препарата связано с большим количеством проблем:
- инъекционная форма введения, что при длительных курсах лечения создает серьезный дискомфорт для пациента;
- высокая стоимость препарата;
- большой процент рецидивов заболевания после отмены терапии;
- резистентность к препарату;
- выраженные побочные эффекты, в ряде случаев вызывающие необходимость его отмены.
Помимо ИФН альфа для лечения гепатита С в ряде случаев используются рибавирин и ряд других противовирусных препаратов.
Хотя основным препаратом для терапии гепатита С является ИФН альфа, существует несколько схем терапии гепатита С:
- ИФН альфа;
- ИФН альфа или пегелированный ИФН альфа в комбинации с рибавирином;
- только рибавирин — (1000 и 1200 мг/сут в течение 12 нед);
- кортикостероиды в комбинации с рибавирином.
Целесообразность применения этих схем (за исключением первой) оспаривается, и в настоящее время нет единого мнения на этот счет. Однако у части больных такое «альтернативное» лечение дает удовлетворительный результат.
Считается, что наиболее эффективно лечение ИФН альфа у больных с изначально низким уровнем РНК вируса и умеренными гистопатологическими изменениями. Наиболее предпочтительными в настоящее время признаны следующие варианты терапии ИФН альфа:
- 3 МЕ 3 раза в неделю в течение года;
- МЕ 3 раза в неделю в течение 6 мес;
- 3 МЕ 3 раза в неделю в течение 3 мес, затем по 6 МЕ 3 раза в неделю в течение следующих 6 мес.
В настоящее время известны прогностические факторы, наиболее часто сочетающиеся с хорошим ответом на ИФН-терапию:
- низкий титр HCV РНК до начала лечения;
- уровень аминотрансфераз (не более 2–3 норм);
- малая длительность инфекции;
- невыраженный фиброз;
- отсутствие холестаза;
- нормальный уровень железа в сыворотке крови и ткани печени;
- генотип 2 и 4 HCV.
Однако следует помнить, что, независимо от совокупности данных факторов, попытка лечения ИФН альфа должна быть предпринята в отношении каждого больного с репликацией ВГС.
В целом терапия интерфероном оказывается абсолютно эффективной у 35% больных, способствует положительной динамике биохимических показателей в 65% случаев и в 29% случаев оказывает поддерживающий эффект.
Эффективность лечения ИФН альфа с целью наиболее быстрого достижения ремиссии заболевания считается доказанной. Сведения по поводу долгосрочного эффекта при применении ИФН альфа остаются весьма противоречивыми. Несмотря на то что у 33–50 % пациентов отмечается «полноценный» ответ на терапию ИФН альфа, у 50–90% больных после отмены препарата наблюдается повторное обострение. Лечение ИФН альфа в низких дозах (3–5 млн ЕД) в целом несколько менее эффективно по сравнению с более высокими дозами. Отсутствие же ответа на лечение ИФН альфа в течение 4–6 нед говорит о неэффективности этого препарата, и продолжение лечения с увеличением дозировки в этих случаях, как правило, не имеет смысла.
В настоящее время весьма перспективным в плане лечения гепатита С можно считать препарат пегинтерферон (пегасис), представляющий собой комплекс рекомбинантного ИФН альфа-2а (роферон А) с полиэтиленгликолем (ПЭГ), что делает это лекарственное средство более устойчивым к действию протеаз и заметно пролонгирует его эффект. Длительное выведение ИФН из организма благодаря присутствию ПЭГ обусловливает возможность назначения препарата 1 раз в неделю в отличие от стандартного лечения препаратами ИФН.
К преимуществам пегасиса относятся:
- увеличение времени полужизни благодаря снижению почечного и печеночного клиренса;
- снижение антигенной и иммуногенной активности;
- повышение устойчивости;
- устойчивость к протеолизу;
- повышение биодоступности благодаря снижению потерь при подкожном инъекционном введении;
- снижение токсичности.
Добавление инертного ПЭГ с молекулярной массой 40 кД к ИФН альфа-2а не повышает вероятности лекарственного взаимодействия с ИФН альфа-2а. Единственным типом лекарственного взаимодействия пегасиса является взаимодействие с теофиллином.
Пегасис, выпускающийся для клинического применения, поставляется в виде предварительно наполненных шприцов или флаконов для инъекций (135, 180 мкг/мл).
На сегодняшний день предпочтение отдается комбинированной терапии. Оптимальным представляется сочетание пегасиса с рибавирином.
Рибавирин — аналог гуанозина, in vitro обладает широким спектром активности против ДНК- и РНК-содержащих вирусов, включая семейство Flaviviridae.
Рибавирин эффективен против HCV в комбинации с ИФН альфа, его собственный механизм действия пока неясен. Предполагается, что он способен подавлять репликацию HCV и активность провоспалительных цитокинов. По рекомендации согласительной конференции Европейской ассоциации по изучению печени (1999) больным со впервые установленным диагнозом ХГС и при наличии показаний к лечению необходимо назначать комбинацию ИФН альфа с рибавирином сроком на 6 мес — при генотипах 2 и 3; 6 мес — при генотипе 1 и низком уровне виремии; 12 мес — при генотипе 1 и высоком уровне виремии.
Пэг-интерферон альфа-2а имеет сниженную скорость системного клиренса и приблизительно 10-кратное увеличение периода полураспада в сравнении с обычным ИФН альфа. В результате пегилирования молекула ИФН становится более устойчивой к действию разрушающих ее ферментов, имеет повышенную биологическую активность и обладает меньшей иммуногенностью. Эти свойства дают возможность вводить препарат только 1 раз в неделю, что положительно влияет на психологический настрой пациентов перед началом и во время лечения.
Перспективы комбинированной терапии
Комбинированная терапия ИФН с рибавирином в настоящее время является мировым стандартом лечения HCV-инфекции. Важно отметить, что противовирусный эффект рибавирина при ВГС, проявляющийся только в присутствии ИФН (монотерапия рибавирином неэффективна), препятствует формированию резистентности ВГC к терапии. Хотя у больных на фоне монотерапии рибавирином уровень трансаминаз нормализуется, после отмены препарата показатели АЛТ и АСТ снова повышаются.
Механизм действия рибавирина до конца не выяснен, хотя известно, что он является конкурентным ингибитором инозинмонофосфатдегидрогеназы.
Рибавирин уменьшает внутриклеточный пул гуанозина трифосфата, что опосредованно сопровождается снижением синтеза вирусной РНК.
Рибавирин способен избирательно накапливаться в моноцитах, лимфоцитах и эритроцитах, воздействуя таким образом на внепеченочные очаги HCV-инфекции.
Комплексная терапия рибавирина и ИФН в качестве первичной терапии HCV показала увеличение устойчивого ответа в 2 раза. Причем у пациентов с высокой репликативной активностью — более 3 млн gE/мл — выявлено 10-кратное возрастание частоты постоянного ответа по сравнению с монотерапией ИФН .
У больных с низкой концентрацией вирусной РНК — менее 3 млн gE/мл — комплексную терапию нельзя признать более результативной, нежели монотерапию ИФН. У больных HCV с исходно высоким уровнем виремии удлинение сроков комплексной терапии с 24 до 48 нед на 10% повышает эффективность лечения, тогда как у пациентов с низким уровнем виремии существенной разницы в эффективности курсов выявлено не было.
При генотипе 1b комплексная терапия ИФН с рибавирином, проводимая в течение 24–48 нед, в 2–3 раза более эффективна, чем монотерапия ИФН. У пациентов с генотипом 1b 24-недельного курса комплексной терапии может быть достаточно в случае, когда наблюдается исходно низкий уровень виремии (менее 2 млн gE/мл), а при уровне виремии более 2 млн gE/мл требуется 48-недельный курс. При других генотипах бывает достаточно 24-недельного курса, независимо от уровня виремии.
При комплексной терапии в качестве повторной с использованием стандартных доз ИФН альфа и 1000–1200 мг рибавирина в течение 24 нед постоянный ответ наблюдался у не ответивших на первичный курс монотерапии ИФН, так же как у пациентов с рецидивом заболевания. Пациенты с генотипом 1b реже отвечают на комплексную терапию, а наличие цирроза печени не влияет на ее эффективность.
Другой путь проведения комплексной терапии — назначение с самого начала высоких доз ИФН альфа и более интенсивное ежедневное введение. Это позволило добиться снижения концентрации HCV RNA в первые часы и дни лечения и последующего ее исчезновения к концу 4–12-й недели терапии, что явилось благоприятным прогностическим признаком развития стойкого ответа.
Таким образом, комплексная терапия показана при лечении трех групп больных: первичных больных с ХВГС; больных, не ответивших на первый курс монотерапии ИФН; больных с рецидивом заболевания, возникшим после первого курса монотерапии ИФН.
Больные с рецидивом заболевания и инфицированные генотипом 1 HCV требуют более длительного 48-недельного применения комплексной терапии. У пациентов, не ответивших на первичный курс монотерапии ИФН, эффективность комплексной терапии повышается при длительном ежедневном введении ИФН с рибавирином.
Лечение рибавирином позволяет достичь достаточно хороших результатов, однако после отмены препарата у большинства больных наблюдается повторная активация инфекционного процесса.
При отсутствии показаний к ИФН-терапии необходимо проведение динамического наблюдения и базисного, в основном симптоматического, лечения (особенно при сопутствующих заболеваниях). Контрольные исследования биохимических показателей крови целесообразно проводить 1 раз в 3 мес: РНК ВГС, белковый спектр крови, протромбин и альбу-
мин — 1 раз в 6 мес; УЗИ и альфа-фетопротеин — 1 раз в 12 мес. В случаях проведения только базисной терапии при динамическом обследовании рекомендуется повторная биопсия печени через 4–5 лет.
Противопоказания к назначению ИФН-терапии представлены в инструкции по применению препаратов ИФН.
Мониторинг эффективности ИФН-терапии при ХГС включает в себя следующие показатели: уровень АСТ или АЛТ, наличие или отсутствие РНК ВГС, временной фактор.
Биохимическая ремиссия в конце лечения предполагает нормализацию уровней АСТ и АЛТ сразу после окончания терапии; полная ремиссия в конце лечения — нормализацию уровней АСТ и АЛТ и исчезновение РНК ВГС из крови сразу после окончания терапии; стабильная биохимическая ремиссия — сохранение нормального уровня АСТ и АЛТ через 6 мес и более после прекращения терапии; стабильная полная ремиссия — сохранение нормального уровня АСТ и АЛТ, а также отсутствие РНК ВГС через 6 мес и более после прекращения терапии.
В случае достижения стабильной полной ремиссии через 6 мес после окончания лечения рекомендуется продолжать наблюдать за больным в течение не менее 2 лет с периодичностью 1 раз в полгода и последующей биопсией печени.
Рецидив болезни имеет место при повышении уровня АСТ и АЛТ и/или появлении РНК ВГС в крови после прекращения лечения.
Об отсутствии лечебного эффекта свидетельствует отсутствие нормализации уровня АСТ или АЛТ и/или сохранение РНК ВГС в крови в течение 3 мес после начала лечения и/или в конце лечения. Любой эффект, которого удалось достичь при монотерапии ИФН, должен быть учтен клиницистом, так как он имеет значение для определения дальнейшей тактики лечения. Мониторинг безопасности терапии при ХГС проводится так же, как при ОГС.
Лечение урсодезоксихолевой кислотой (УДХК). Использование УДХК в лечении ХГС может рассматриваться как вспомогательное средство. Основным показанием для назначения УДХК следует считать наличие холестаза. Сочетание с ИФН не увеличивает эффективности ИФН альфа в отношении элиминации ВГС, но может снизить частоту биохимического рецидива заболевания.
В заключение следует отметить, что прогрессирование ОГС в ХГС отмечается по меньшей мере у половины инфицированных HCV. При этом наблюдается постоянная угроза развития цирроза печени и ГЦК. Развитие ГЦК имеет место у 20–30% инфицированных HCV. Риск возникновения рака печени у больных с ХГС даже превышает риск развития печеночной недостаточности — у некоторых больных рак может развиваться очень быстро, с последующим метастазированием. Развитие ГЦК связано с прогрессированием цирроза, который возникает по меньшей мере у 20% больных в пределах 20 лет от начала заболевания. Лечение ИФН в дозе 3 ME 3 раза в неделю в течение 12–18 мес приводит к нормализации печеночных аминотрансфераз, улучшению гистологической картины печени и элиминации вируса приблизительно у 60% пациентов. Около 70% этих больных сохраняют ответ после прекращения терапии, а те, у кого имеется рецидив заболевания, обычно отвечают на повторное лечение. Возможно, комбинация ИФН с другими препаратами, такими как тимозин, может привести к еще более положительным результатам. Расходы на лечение ХГС ИФН альфа, позволяющие повысить качество и продолжительность жизни, значительно меньше тех, которые возникают при отсутствии терапии. Элиминация вируса у таких больных также может способствовать уменьшению заболеваемости и ограничению распространения HCV-инфекции.
Т. Е. Полунина, доктор медицинских наук, профессор
Гута-Клиник, Москва
Врезки:
