Тимомегалия и синдром Платтера
28.02.2006
История относительно интенсивного изучения вилочковой железы (glandula thymus, thymus) насчитывает около 400 лет. Начало его относится к 1614 г., когда профессор Базельского университета Феликс Платтер описал происшедшую у него на глазах внезапную смерть 5-месячного ребенка, при вскрытии трупа которого не было найдено никаких причин, способных объяснить смерть, кроме очень большого тимуса. Смерть этого ребенка тогда впервые связали с огромным тимусом, назвав данное состояние тимическим удушьем — asthma thymicum.
В середине XIX в. профессор Венского университета Карл Рокитанский высказал предположение об инкреторной функции вилочковой железы. Данная концепция была положена в основу представлений о тимико-лимфатическом статусе [1, 2] как врожденной особенности конституции, предрасполагающей к внезапной смерти от незначительных причин. В симптомокомплекс тимико-лимфатического статуса включались первичная гиперфункция вилочковой железы, гипоплазия надпочечников, сердца и аорты [1–5]. С этого времени причиной тимической смерти стали считать острую надпочечниковую недостаточность [3, 4]. Однако отсутствие характерных для тимико-лимфатического состояния признаков во многих случаях при такой смерти, в том числе и симптомов надпочечниковой недостаточности, позволило поставить под сомнение и данную концепцию.
В начале 1960-х гг. было доказано, что тимус является центральным органом иммунной системы. С этого времени вилочковая железа рассматривается в качестве железы внутренней секреции, действие гормонов которой направлено на дифференцировку тимических лимфоцитов. Открытие основной функции вилочковой железы — продукции Т-лимфоцитов и регуляции иммунитета, а также принадлежность ее к системе эндокринных желез позволяют рассматривать данный орган как коммутатор иммунной и эндокринной систем. В серии работ отечественных исследователей последних 20 лет доказывается, что дети с большой вилочковой железой относятся к числу иммунодефицитных лиц.
В 1970 г. проф. Т. Е. Ивановской [6] для обозначения увеличенной вилочковой железы вместо вышеуказанных терминов был предложен термин «тимомегалия». Под тимомегалией российские морфологи понимают увеличение объема и массы тимуса выше предельных возрастных значений с сохранением нормальной гистоархитектоники органа. Начиная с 1970 г., этот термин стал широко использоваться как морфологами, так и клиницистами.
Однако проведенные исследования показали, что тимомегалия является лишь одним из симптомов того состояния, которое существует у детей, имеющих увеличенную вилочковую железу [7]. В связи с отсутствием другого термина, отражающего сущность состояния, которое имеет место у детей с увеличенной вилочковой железой (соответствующей тимомегалии в понимании патологоанатомов), предлагаем называть его синдромом Платтера.
Термином «синдром Платтера» следует обозначать состояние, при котором клинические и параклинические методы обследования позволяют выявить у детей и подростков ряд специфических изменений организма, сочетающихся с первичной длительно сохраняющейся тимомегалией. Клиническое понимание тимомегалии при синдроме Платтера отражает морфологическое состояние вилочковой железы, при котором масса и объем тимуса превышают предельные возрастные значения при сохранении нормальной гистоархитектоники органа.
Диагностика тимомегалии в клинической практике
Ориентировочная диагностика тимомегалии может быть проведена с помощью объективного исследования: осмотра, пальпации, перкуссии. Однако оценка результатов во многом субъективна и зависит от опыта исследователя [7].
Из инструментальных методов, позволяющих объективно выявить тимомегалию, используются рентгенодиагностика и ультразвуковое исследование (УЗИ).
Рентгенодиагностика. Методологической основой рентгенодиагностики увеличенного тимуса является следующее положение: в норме у детей любого возраста на стандартных рентгенограммах грудной клетки в прямой проекции тень тимуса не должна выходить за пределы тени сосудистого пучка и сердца.
В целях диагностики тимомегалии на рентгенограммах грудной клетки в прямой проекции мы применяли кардио-тимико-торакальный индекс (КТТИ) по J. Gewolb [8] и вазокардиальный индекс (ВКИ) [7]. Оба индекса определяются на стандартных рентгенограммах грудной клетки в прямой проекции. КТТИ представляет собой частное от деления ширины сосудистого пучка на уровне бифуркации трахеи (точка carina) на ширину грудной клетки на уровне купола диафрагмы. ВКИ представляет собой частное от деления ширины сосудистого пучка на уровне бифуркации трахеи (точка carina) на максимальную ширину тени сердца. Максимальная ширина тени сердца определяется как сумма двух перпендикулярных отрезков, опущенных на вертикальную линию (проведенную через середину позвоночного столба) из максимально удаленных от нее точек сердца слева и справа (рис. 1).
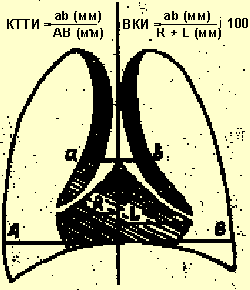
|
| Рисунок 1. Схема вычисления индексов КТТИ и ВКИ |
Выявление в средостении характерной овальной, треугольной или лентовидной тени с прямым, волнообразным или неровным контуром, расположенной с одной или обеих сторон сосудистого пучка, искажающей линию «сердечной талии» слева и/или вазокардиальный угол справа, позволяет сделать заключение о существовании у пациента тимомегалии. Наличие увеличенных значений КТТИ и ВКИ подтверждает данный диагноз. Рентгенологический метод, однако, информативен только для детей грудного и раннего возраста, поскольку у детей в возрасте старше 3 лет, как правило, тимус располагается за тенью сосудистого пучка и сердца. В таблице 1 приведены значения КТТИ и ВКИ у детей первых 3 лет жизни при разных степенях увеличения тимуса.
УЗИ. УЗИ тимуса в нашей стране впервые было проведено у новорожденных детей С. М. Воеводиным [9]. Путем клинико-морфологических сопоставлений нами были разработаны коэффициенты пересчета линейных параметров тимуса в более привычные для клиницистов формы (объема и массы органа). Округленные величины указанных коэффициентов, по нашим данным, равны 0,7 (для массы) и 0,5 (для объема). Таким образом, величины массы и объема тимуса при ультразвуковом сканировании вычисляются следующим образом:
М = 0,7 × a × b × c;
V = 0,5 × a × b × c,
где a, b, c — линейные параметры тимуса (ширина, длина, передне-задний размер, выраженные в см); 0,7 и 0,5 коэффициенты пересчета линейных параметров на массу и объем органа соответственно [10]. Для практических целей массу и объем вилочковой железы достаточно определять так, как это указано выше: без вычисления объема и массы отдельных долей.
Методом центильного распределения нами были определены нормальные значения массы и объема тимуса для детей в возрасте 1–24 мес (табл. 2). При превышении массы и объема тимуса выше верхних предельных значений нормы состояние ребенка следует расценивать как тимомегалию.
На основании анализа более 5000 рентгенограмм, выполненных у детей грудного возраста при подозрении на пневмонию, диагноз которой рентгенологически не был подтвержден, тимомегалия нами была выявлена у 35% пациентов 1 — 3 мес, у 15% детей в возрасте 3–6 мес, у 8% — в возрасте 7–15 мес, у 2% — в возрасте 16 — 36 мес, а в популяции детей старше 3 лет частота выявления тимомегалии не превышала 0,5% [8].
Наблюдение за одними и теми же детьми на протяжении длительного отрезка времени позволило нам сделать вывод, что тимомегалия в детском возрасте может быть как транзиторной, так и стойкой.
В 1993 г. нами совместно с О. В. Зайратьянцем была предложена классификация тимомегалии в детском возрасте на основе клинико-морфологических данных. Несколько измененный вариант указанной классификации приведен в табл. 3 (см. рубрику «Под стекло»). Наиболее частым вариантом тимомегалии в детском возрасте является синдром Платтера.
Анализ родословных позволил выявить у родственников первой и второй линии родства детей с синдромом Платтера высокую частоту встречаемости злокачественных новообразований, аутоиммунных заболеваний и заболеваний системы эндокринных органов. Так, злокачественные новообразования встречаются в каждой третьей семье, где есть дети с синдромом Платтера, с такой же частотой в этих семьях регистрируются эндокринные заболевания (преимущественно сахарный диабет и заболевания щитовидной железы). В семьях детей с синдромом Платтера статистически чаще, чем в семьях детей из выборки общей популяции, распространены аутоиммунные заболевания (диффузные болезни соединительной ткани) и туберкулез. Помимо этого, многие родители детей с указанным синдромом в дошкольном и младшем школьном возрасте относились к группе часто болеющих, т. е. к группе детей имевших повышенную склонность к острым респираторным вирусным инфекциям (ОРВИ).
Характер перечисленных заболеваний (склонность к вирусным, аутоиммунным, онкологическим заболеваниям, туберкулезу) может указывать на существование у близких родственников детей с синдромом Платтера недостаточной активности клеточного звена иммунной системы, поскольку, согласно современным воззрениям, все перечисленные заболевания находятся под контролем Т-клеточного иммунитета, формируемого вилочковой железой. При этом не совсем ясно, чем объясняется высокая отягощенность родственников детей с синдромом Платтера болезнями системы эндокринных органов. Однако не следует забывать о том, что эндокринные заболевания (в том числе сахарный диабет, диффузный токсический зоб, гипотиреоз) могут иметь аутоиммунный генез.
В таком случае у близких родственников детей с синдромом Платтера отчетливо просматривается тенденция к заболеваниям, связанным с иммунными механизмами клеточного типа, контролирующимися вилочковой железой. Это позволяет предполагать возможность передачи детям, у которых развился синдром Платтера, какого-то дефекта Т-звена иммунной системы.
Антенатальный период у большинства детей с синдромом Платтера осложняется хронической гипоксией, обусловленной острыми инфекционными заболеваниями или обострением хронических экстрагенитальных заболеваний матерей, наличием у них сосудистой дистонии, анемии, гестозов.
Осложненное течение интранатального периода отмечается не менее чем у 2/3 детей с синдромом Платтера. Наиболее частыми осложнениями этого периода явились стремительные или затяжные роды, приведшие к наложению щипцов или экстренному кесареву сечению.
Группа детей с указанным синдромом по фенотипу гетерогенна. 90% детей имеют мягкие округлые формы тела, некоторую пастозность тканей, относительно крупные черты уплощенного лица, прямой тип лба, широкоовальные глаза, относительно короткий нос с низким переносьем, средней величины или толстые губы, слабый изгиб профиля, короткую шею. Дети этой группы имеют как бы увеличенные поперечные размеры тела: широкое лицо, широкая грудная клетка, широкие плечи, широкие ладони и стопы, относительно короткие и широкие пальцы. Около 3/4 детей-европеоидов этой подгруппы имеют нежную, но несколько утолщенную, слабопигментированную белую кожу, для которой характерно быстрое развитие ожога после инсоляции, светлую окраску волос и глаз, слабое развитие мускулатуры, сниженную физическую активность. Дети данной подгруппы отличаются хорошим (и даже избыточным) аппетитом и высокими темпами роста.
В дошкольном и младшем школьном возрасте у них отмечаются хорошее развитие подкожного жирового слоя, слабое развитие мускулатуры, снижение общего тонуса и тургора тканей, а также физической активности, замедленная реакция на внешние раздражители, замедленное образование новых условных рефлексов, ослабление процессов внутреннего торможения с преобладанием реакций внешнего торможения.
Клиническая характеристика детей с синдромом Платтера включает характеристику системы лимфоидных органов, которая, согласно мнению большинства исследователей, отличается генерализованной гиперплазией системы лимфоидных органов: лимфатических узлов, лимфатических фолликулов корня языка, задней поверхности глотки, поверхности надгортанника, гипертрофией небных и глоточной миндалин. Наши наблюдения, однако, показали, что состояние периферических лимфоидных органов зависит от воздействия антигенного стимула — при отсутствии такого воздействия генерализованная гиперплазия периферического лимфоидного аппарата не развивается [7].
К числу особенностей физического развития детей грудного и раннего возраста относятся: высокие темпы увеличения длины тела, слабое развитие скелетной мускулатуры, несвоевременность и неправильный порядок прорезывания молочных зубов, относительно позднее начало самостоятельной ходьбы.
В эмоциональной сфере в первые 2–3 мес жизни обращает внимание менее выраженный комплекс оживления (за счет снижения двигательной активности).
Начало становления речи у детей с синдромом Платтера не отличалось от такового у детей соответствующего возраста в популяции в целом: гуление, слоги и первые слова у них появлялись своевременно.
К возрасту 10–11 мес они начинали произносить первые одно- и двусложные слова, к 1 году количество активно произносимых слов достигало 10–12. В дальнейшем 8% детей данной группы до 2-летнего возраста продолжали пользоваться только этими 10–12 словами. В возрасте 4,5–6 лет 25% детей этой группы страдали дислалией, требующей проведения корригирующих логопедических занятий в условиях детской поликлиники или в условиях специализированного детского сада. У отдельных пациентов нарушение, связанное с произношением звуков, сохранялось и в подростковом возрасте.
Состояние здоровья детей с синдромом Платтера. Здесь рассматриваются только те заболевания и патологические состояния, которые достоверно чаще встречались у детей с указанным синдромом, по сравнению с детьми из общей популяции. При анализе структуры выявленных заболеваний наибольшую по численности группу составили аномалии развития (выявлены у 80% наблюдавшихся пациентов) — пороки развития, множественные стигмы дизэмбриогенеза, биохимические дефекты. Пороки развития чаще проявлялись гипоплазией органов и тканей: широкие отверстия паховых каналов и пупочного кольца, септальные дефекты в сердце, гипоплазия аорты, сердца, легких, почек, щитовидной железы и др.
Вторая группа заболеваний была представлена патологическими состояниями нервной системы. Наряду с заболеваниями нервной системы, обусловленными биохимическими дефектами (синдром Менкеса; ганглиозидоз Gm1; фенилкетонурия; галактоземия), обращали на себя внимание такие синдромы, как гипертензионно-гидроцефальный (у 49%), фебрильных судорог (у 20%), мышечной гипотонии (у 18%) и вегетативно-висцеральной дисфункции (у 12,5%). Включение в комплекс обследования электрофизиологических методов, компьютерной и ядерно-магнитно-резонансной томографии привело к существенному увеличению частоты выявления гипертензионно-гидроцефального синдрома (выявлен у 90%). Указанный синдром у 2/3 детей сочетался с синдромами фебрильных судорог и вегетативно-висцеральных дисфункций, однако последние два синдрома у части детей встречались и изолированно.
Изолированный синдром вегетативно-висцеральных дисфункций характеризовался крайне выраженным полиморфизмом проявлений: нарушение терморегуляции, дыхания, сердечной деятельности, функции желудочно-кишечного тракта, пароксизмальное повышение артериального давления и другие расстройства. Мы склонны считать, что синдром вегето-висцеральных дисфункций у детей с синдромом Платтера встречается значительно чаще, чем у указанных 12,5% пациентов. На существование гиподиагностики синдрома вегето-висцеральных дисфункций могут указывать выявленные нами фенотипические особенности детей, в том числе очень хороший (скорее избыточный) аппетит, склонность к задержке жидкости, как бы немотивированный субфебрилитет. Наши наблюдения показали, что у большинства детей с якобы немотивированным субфебрилитетом последний хорошо контролировался мочегонными средствами, что явно указывает на связь этого симптома с ликворной гипертензией, в том числе с повышением давления в области третьего желудочка мозга — месте локализации центра терморегуляции.
У детей с синдромом Платтера обращал на себя внимание и синдром мышечной гипотонии, который у ряда пациентов был настолько сильно выражен, что специалисты высказывали предположение о наличии у них болезни Верднига–Гоффманна или миелодисплазии.
Таким образом, частое выявление у детей с синдромом Платтера внутренней гидроцефалии, изолированного синдрома вегето-висцеральных дисфункций, наличие вегетативных нарушений указывает на возможность нарушения функции диэнцефальной области. Изменения со стороны скелетной мускулатуры трактовать сложнее. Однако если учесть, что средний мозг, примыкающий к области сильвиева водопровода, контролирует регуляцию мышечного тонуса и сигналы к мышцам поступают через ретикулярную формацию по двум ретикулоспинальным путям [11], то это нарушение может быть рассмотрено с позиции существования у данного контингента детей внутренней гидроцефалии и расстройства ликвородинамики, поскольку гипоталамус, таламус и ретикулярная формация являются звеньями единой суперфункциональной системы, корригирующей гомеостатические программы наиболее сложных вегетативных, эндокринных, трофических и психических функций [12].
У 9% пациентов школьного возраста с синдромом Платтера зарегистрированы заболевания нейроэндокринной и эндокринной системы (диэнцефальный синдром, несахарный диабет, транзиторный несахарный диабет, транзиторный гипопаратиреоз, инсулинозависимый сахарный диабет, поликистоз яичников, эутиреоидная струма, диффузный токсический зоб, субкомпенсированный гипокортицизм). У детей с синдромом Платтера, отмечается тенденция к высоким показателям роста и слабой пигментации кожи, что может также указывать на дисфункцию гипоталамо-гипофизарной системы. Кроме того, у этих детей существует ряд симптомов, которые мы назвали торакальными и к числу которых относится синдром сдавления средостения. Этот синдром мы наблюдали только у детей первых 2–2,5 мес жизни при значительном увеличении тимуса.
Все исследователи, занимавшиеся изучением особенностей лиц со стойкой тимомегалией (а основную группу в них, вне всякого сомнения, составляют дети с синдромом Платтера), обращали внимание на их пониженную физическую активность.
При специальном опросе 72 пациентов в возрасте 10–24 лет с синдромом Платтера у 46% из них было отмечено негативное отношение к физическим нагрузкам, особенно к бегу на длинные дистанции и езде на велосипеде. Подростки и лица молодого возраста, способные передать ощущения, появлявшиеся при физической нагрузке, отмечали на ее фоне чувство слабости, ощущение нехватки воздуха.
Когда у 30 подростков с синдромом Платтера, не имевших органических заболеваний сердца, было проведено эхокардиографическое исследование сердца на аппарате 128 х Р — ACUSON (США) с определением массы миокарда левого желудочка сердца, у 27 из них индексированная (относительно массы тела) масса миокарда левого желудочка сердца оказалась достоверно меньше (р < 0,001), чем в выборке детей из общей популяции, а в группе лиц, предъявлявших жалобы на низкую переносимость физических нагрузок, она оказалась еще ниже, чем в общей группе пациентов с указанным синдромом [13]. Этот факт был установлен нами впервые и, безусловно, требует уточнения. На наш взгляд, на него следует обратить серьезное внимание и не допускать у лиц с синдромом Платтера физических перегрузок, поскольку у них, вероятно, имеется объективная причина отказываться от их выполнения.
Из инфекционных заболеваний у детей с синдромом Платтера прежде всего обращают на себя внимание ОРВИ, к которым дети данной группы проявляют высокую восприимчивость. Вероятнее всего, основной контингент группы часто и длительно болеющих детей составляют дети с указанным синдромом. Помимо этого дети с синдромом Платтера проявляют высокую склонность к инфицированию вирусом Эпштейна–Барр [14], у многих из них наблюдается тяжелое течение ветряной оспы со склонностью к генерализации.
Особенности гомеостаза детей с синдромом Платтера. Исследование показателей иммунного гомеостаза детей с синдромом Платтера выявило снижение показателей Т-звена иммунной системы: сниженный уровень Т-лимфоцитов с фенотипами CD3, СD4, СD8, крайне низкий уровень сывороточной тимической активности. Помимо этого, для детей с указанным синдромом характерны некоторые особенности фагоцитоза, проявляющиеся в высокой спонтанной активности клеток в восстановлении нитросинего тетразолия (НСТ-тест) и неоднократной смены фаз в тесте «кожное окно» по J. Rebuc в модификации О. В. Скоробогатовой [7].
У детей с синдромом Платтера выявляются серьезные отклонения в системе гормонального гомеостаза. В крови у них отмечается снижение концентрации альфа-меланоцитстимулирующего гормона, адренокортикотропного гормона, кортизола, повышение уровня соматотропного и тиреотропного гормонов гипофиза, некоторое повышение уровня паратиреоидного гормона (более выраженное у детей первого года жизни) — при нормальном содержании тироксина и трийодтиронина в крови (вероятно, за счет более высокого уровня тиреотропного гормона [7]).
Таким образом, для детей с синдромом Платтера характерны некоторые особенности семейного анамнеза (свидетельствующие о возможной передачи им какого-то дефекта Т-звена иммунной системы), а также личного анамнеза (подчеркивающие возможность отрицательного воздействия на плод как инфекционных агентов, так и различных состояний, способных привести к хронической гипоксии плода); не исключается травматизация в родах. Дети с синдромом Платтера имеют своеобразный фенотип (формирующийся, вероятно, за счет особенностей функционирования нервной, нейроэндокринной и эндокринной систем организма) и дисбаланс иммунной системы и фагоцитоза.
С учетом вышеизложенного механизм формирования синдрома Платтера можно представить в виде схемы (см. рубрику «Под стекло»).
Лечебно-профилактические мероприятия у детей с синдромом Платтера
У детей с синдромом Платтера специальных лечебных мероприятий, направленных на уменьшение размеров вилочковой железы, проводить не следует. Исключение составляют лишь те редкие случаи, при которых у детей развивается синдром сдавления средостения. При появлении признаков сдавления средостения с целью тимолитического действия показано назначение глюкокортикостероидных гормонов (преднизолон из расчета 1–2 мг/кг/cут внутрь или гидрокортизон по 5–10 мг/кг/сут внутримышечно) до наступления стойкого клинического эффекта (в среднем препарат назначается на 3–5 дней).
При возникновении у детей с синдромом Платтера различных заболеваний лечение последних проводится в рамках терапии соответствующих нозологических форм. Следует, однако, иметь в виду, что у указанного контингента пациентов (в связи с существованием целого ряда особенностей) чрезвычайно легко развиваются первичный инфекционный токсикоз и более или менее выраженные проявления надпочечниковой недостаточности.
Проявляющийся в клинике гипертермическим, энцефалическим, менингеальным, кардиоваскулярным или гипервентиляционным синдромами или их сочетаниями первичный инфекционный токсикоз требует проведения общепринятых в таких случаях мероприятий. Однако в связи со склонностью детей с синдромом Платтера к задержке жидкости и с высокой проницаемостью стенок их сосудов (в том числе и за счет эндогенной недостаточности глюкокортикостероидов в условиях инфекционного стресса) явления отека (набухания) мозга, лежащие в основе развития первичного инфекционного токсикоза, у них могут развиваться чрезвычайно бурно. Не исключено, что именно этим обстоятельством у части детей с синдромом Платтера может объясняться скоропостижная смерть в самом начале ОРВИ или других инфекционных заболеваний.
Для предупреждения развития столь грозного осложнения с появлением первых признаков инфекционного заболевания у детей грудного и раннего возраста с синдромом Платтера целесообразно однократное (по показаниям — повторно) введение диуретических средств быстрого действия: фуросемид в возрастных дозах.
Несмотря на существование у детей с синдромом Платтера некоторой гипофункции коры надпочечников, при отсутствии воздействия стресса они бывают достаточно адаптированы к обычным условиям жизни. В условиях воздействия стресса, в том числе и инфекционного, положение меняется. Стрессовые ситуации нередко приводят к клиническим проявлениям надпочечниковой недостаточности, что может создать угрозу для жизни ребенка. В условиях воздействия стресса клинически выраженные проявления надпочечниковой недостаточности чаще всего возникают у детей в возрасте от 4 мес до 4–5 лет жизни. Как правило, они наблюдаются во второй половине дня (чаще после 21–22 ч) в первую-вторую и/или в период реконвалесценции — на 2–3-й неделе от начала заболевания.
Клиническая картина острой надпочечниковой недостаточности характеризуется вялостью, сонливостью, появлением «мраморности» кожных покровов, похолоданием конечностей, появлением участков ограниченного цианоза.
В остром периоде инфекционного заболевания на высоте температурной реакции обычно маскируется такое проявление острой надпочечниковой недостаточности, как гипотермия. Вместе с тем этот симптом одним из первых обращает на себя внимание в периоде реконвалесценции. Наряду с температурой тела ниже 36°С, у детей появляется выраженная бледность кожных покровов, холодный пот, снижение артериального давления. При отсутствии своевременной помощи может наступить летальный исход.
Лечебные мероприятия при возникновении указанного состояния заключаются в согревании ребенка, энтеральном и парентеральном введении аскорбиновой кислоты в разовой дозе от 0,1 до 0,5 г. Желательно давать ребенку крепко заваренный чай. При недостаточном эффекте указанных мероприятий или при полном его отсутствии назначаются глюкокортикоидные гормоны: преднизолон из расчета 0,5 мг/кг или гидрокортизон из расчета 2,5 мг/кг на одно введение. При необходимости повторные введения глюкокортикостероидов назначаются с интервалом 4–6 ч.
В ряде случаев у детей с синдромом Платтера необходимость назначения глюкокортикостероидных гормонов возникает в процессе предоперационной подготовки к плановым хирургическим вмешательствам. Курс лечения глюкокортикостероидами в таких случаях не должен быть длительным, поскольку экзогенно введенные глюкокортикостероиды, с одной стороны, подавляют и без того сниженную функцию коры надпочечников, с другой — длительные курсы глюкокортикостероидной терапии могут препятствовать заживлению послеоперационной раны.
Наши наблюдения показали, что у указанного контингента детей бывает достаточно ввести гормоны за 30–40 мин до наркоза или до операции, проводимой без него. Преднизолон в таких случаях вводится из расчета 1 мг/кг при парентеральном введении или 0,5 мг/кг при энтеральном (на одно введение), гидрокортизон — из расчета 2,5 мг/кг (также на одно введение). Продолжение лечения указанными препаратами в послеоперационном периоде зависит от состояния ребенка. В обычных условиях в послеоперационном периоде дети, как правило, в повторных введениях глюкокортикостероидных гормонов не нуждаются.
Поскольку у данного контингента детей имеет место хроническая тимическая недостаточность, они нуждаются в проведении заместительной терапии препаратами вилочковой железы. Препаратом выбора может быть тактивин — биологически активный, хорошо очищенный полипептид, получаемый из тимуса крупного рогатого скота. Показаниями к назначению тактивина у детей с синдромом Платтера прежде всего являются часто возникающие и длительно протекающие ОРВИ, острые пневмонии, инфекционный эндокардит и другие тяжелые бактериальные инфекции, а также инфекции, обусловленные внутриклеточными и мембранными патогенами. Тактивин может назначаться через 2–3 дня от начала инфекционного процесса. Он вводится из расчета 40 мкг/кг или 1,5–2 мкг/кг на одно введение. Препарат назначается 1 раз в день внутрикожно или подкожно в область сгибательной стороны предплечья или плеча после 16 ч. Курс лечения состоит из 5 ежедневных инъекций. После окончания лечения тактивином или другими препаратами тимуса в течение 2 мес не рекомендуется делать туберкулиновые пробы (могут появиться ложноположительные реакции) и профилактические прививки (в связи с возможностью бурной реакции со стороны лимфоидных органов).
Одним из самых сложных является вопрос о проведении профилактических прививок детям с синдромом Платтера. В целом он требует специального изучения, поскольку, с одной стороны, у многих детей этой группы нередко возникают бурные реакции на вакцинацию, включая энцефалические, кардиоваскулярные, а также обострение аллергических заболеваний. С другой стороны, у детей с синдромом Платтера на фоне существующей тимомегалии наблюдается недостаточная выработка антител против дифтерии и коклюша при нормальной (и даже очень высокой) выработке антител против столбняка, кори, краснухи.
Пока этот вопрос окончательно не решен, при проведении вакцинации и ревакцинации у детей с синдромом Платтера можно рекомендовать следующие мероприятия:
- за 3-5 дней до и в течение такого же времени после вакцинации целесообразно назначить антигистаминные препараты в возрастных дозах;
- непосредственно или в течение часа после введения вакцины показано однократное назначение фуросемида в возрастной дозе;
- у часто и длительно болеющих детей до начала вакцинации целесообразно провести курс лечения препаратами тимуса; введение вакцин в таком случае следует проводить не ранее чем через 2 мес после окончания терапии препаратом тимуса;
- детям с большой степенью увеличения тимуса не должны проводиться профилактические прививки до тех пор, пока вилочковая железа не уменьшится до естественного размера.
Представленные в данной работе сведения указывают на то, что у детей и подростков с синдромом Платтера имеет место нейроэндокринно-иммунная дисфункция, ассоциированная с тимомегалией. Здесь остается много нерешенных вопросов, в частности: сохраняется ли синдром Платтера на протяжении всей жизни человека, или он присущ только детскому и подростковому возрасту? Если это состояние сохраняется на протяжении всей жизни человека, это значит, что мы имеем дело с особой конституцией, предрасполагающей к развитию определенных заболеваний. Указанная проблема требует дальнейшего изучения с целью поиска адекватных профилактических воздействий, направленных на предотвращение развития заболеваний у лиц с указанной конституцией.
Литература
- Paltauf A. Uber die Bezihungen der Thymus zum plotzlichen Tod//Wien. klein. Wschr. 1889; 46: 877-880.
- Paltauf A. Uber die Bezihungen der Thymus zum plotzlichen Tod//Wien. klein. Wschr. 1890; 9: 172-175.
- Агеев А. К. Гистопатология вилочковой железы человека. Л.: Медицина, 1973. 127 с.
- Угрюмов В. П. Патологическая анатомия заболеваний эндокринных желез: Руководство по патологической анатомии/под ред. А. Н. Абрикосова, А. И. Струкова. М.: Медгиз, 1963. Т. 1. С. 121-127.
- Carr J. L. Status Thymico-limphaticus//J. Pediatr. 1945; 27: 1: 1-43.
- Ивановская Т. Е. Гиперплазия вилочковой железы и Status thymico-lymphaticus у детей грудного возраста//Педиатрия. 1970. № 1. С. 23-29.
- Кузьменко Л. Г., Тюрина Н. А. Синдром увеличенной вилочковой железы у детей /под ред. М. И. Мартыновой. М.: РУДН, 1993. 200 с.
- Gewolb J. et al. Thymus sitze and ist relationship to the respiratory distrese syndrome/J. Gewolb, L. K. Lebowitz, H. W. Taeusch//J. Pediatr. 1979; 95: 1: 108-111.
- Воеводин С. М. Возможность эхографического исследования тимуса у новорожденных детей//Вопр. охраны материнства и детства. 1989. № 4. С. 38-43.
- Кузьменко Л. Г. и др. Оценка величины вилочковой железы у детей первых лет жизни по данным ульразвукового сканирования//Педиатрия. 2002. № 6. С. 110-112.
- Ретикулярная формация//БМЭ. 3-е изд. Т. 22. С. 218-223.
- Вантов М. Диэнцефальная патология. София: Медицина и физкультура, 1980. 292 с.
- Кузьменко Л. Г. и др. Особенности сердца у детей, подростков и лиц молодого возраста с тимомегалией в анамнезе//Вестник РУДН. Серия "Медицина". 2003. № 2. С. 98-102.
- Азова М. М. и др. Тимомегалия и раннее инфицирование вирусами Эпштейн-Барр и цитомегаловирусами//Детские инфекции. 2004. № 4. С. 23-24.
Л. Г. Кузьменко, доктор медицинских наук, профессор
РУДН, Москва
Врезки:
