Индивидуальная иммунокоррекция в комплексном лечении вторичного бесплодия
Вторичное бесплодие, являющееся тяжелым последствием воспалительных заболеваний органов малого таза (ВЗОМТ), представляет собой важную медицинскую и социальную проблему. Бесплодие развивается у 13 % пациенток, перенесших один эпизод ВЗОМТ, у 36 % — с двумя эпизодами и у 75 % — с тремя и более эпизодами ВЗОМТ соответственно [1, 2]. Высокая частота ВЗОМТ нередко связана с несвоевременной и неадекватной диагностикой и лечением заболевания. В России более половины женщин, обратившихся в женские консультации, страдают ВЗОМТ, 50 % из них требуется лечение в стационаре [3]. Кроме того, по данным Ставропольской ГМА у 21,7 % больных, оперированных по поводу различной гинекологической патологии, обнаружены признаки воспаления маточных труб, часто протекающего без клинических симптомов. ВЗОМТ, как правило, ассоциированы с условно-патогенными и оппортунистическими возбудителями, обладающими множественной устойчивостью к антибиотикам (E. coli, S. aureus, St. epidermidis, C. trachomatis, M. hominis, M. genitalium, U. urealyticum и др.).

В большинстве случаев ВЗОМТ являются полиэтиологическими, однако ведущая роль в их этиологии отводится гонококковой и хламидийной инфекциям. При наличии хронического воспалительного процесса в различных отделах половой системы женщин в 70 % случаев выявляются хламидийная и уреаплазменная инфекции [4]. При бесплодном браке в различных отделах половых путей супругов чаще всего можно обнаружить хламидии и уреаплазмы [5]. Также у 50 % больных урогенитальным хламидиозом женщин отмечается бесплодие, у 85 % — самопроизвольные выкидыши. В отношении уреаплазменной инфекции эти показатели составляют соответственно 30 и 60 % [6]. C. trachomatis нередко встречаются в ассоциации с другими возбудителями половых инфекций, что осложняет течение заболевания. Сочетание хламидий с гонококком отмечается у 33,7 % пациентов, с уреа- и микоплазмой — у 19,1 %, с трихомонадами — у 31,3 %, с гарднереллами — у 9,9 %, с кандидозом — у 9 % больных. Для ВЗОМТ характерны микст-инфекции, чаще — три, несколько реже — четыре-пять инфекций.
Надо подчеркнуть, что к вышеперечисленным инфекциям не развивается стойкий иммунитет. Резистентность к инфекциям, передаваемым половым путем (ИППП), и к условно-патогенным возбудителям обусловлена у здоровых людей нормальной функцией всех звеньев иммунитета, включая и местные факторы защиты.
Современные схемы лечения ВЗОМТ включают препараты, направленные на элиминацию широкого спектра микроорганизмов [7, 8]. Основной упор делается на антибактериальную терапию, однако к ней быстро развивается устойчивость инфекта, вследствие чего значительно повышается частота латентных и стертых форм ВЗОМТ. Кроме того, сами антибиотики при многократном их использовании со временем дают целый ряд побочных и нежелательных эффектов.
Являясь облигатными внутриклеточными паразитами, многие ИППП (хламидии, уреаплазмы, вирусы герпес-группы и др.) обладают защитными механизмами ускользания от иммунной системы хозяина и подавления иммунного ответа. При отсутствии адекватной терапии и хроническом течении заболевания происходит усугубление иммунодефицита. Кроме того, по мере увеличения продолжительности инфекционно-воспалительного процесса органов малого таза наступают их морфологические изменения. В результате длительно текущего вторичного иммунодефицита (ВИД) и присоединения других очагов инфекции, хронической интоксикации могут нарастать метаболические и гормональные дисфункции, формироваться аутоиммунные реакции, усугубляя течение ВЗОМТ и прогноз вторичного бесплодия. Кроме того, большая роль в поддержании хронического воспалительного процесса в малом тазу принадлежит заболеваниям желудочно-кишечного тракта и дисбиозу кишечной флоры, характерным для ВИД.
С учетом вышесказанного становится очевидным, что применение только этиотропной терапии не может привести к выздоровлению. Следовательно, для успешной терапии больных с вторичным бесплодием необходимо комплексное этиопатогенетическое лечение, включающее иммунокоррекцию и иммунореабилитацию на фоне общего оздоровления и лечения осложнений/маркеров ВИД или сопутствующих заболеваний.
Целью данной работы явилось изучение эффективности комбинированной терапии с применением индивидуально подобранной программной иммунокоррекции у больных с вторичным бесплодием, связанным с хроническими ВЗОМТ.
В исследовании приняли участие 16 супружеских пар с хроническими ВЗОМТ и проблемами репродукции. Из них у 12 женщин при отсутствии каких-либо способов предохранения от 2 до 8 лет не зафиксировано ни одной беременности (у 9 женщин гинекологами по месту жительства было диагностировано трубное бесплодие), у 4 — привычное невынашивание беременности на ранних сроках (до 12 нед).
Вошедшие в исследование женщины (в возрасте от 21 до 35 лет) страдали хроническими ВЗОМТ длительностью в среднем 5,8 лет (от 3 до 12 лет). У всех пациенток выявлялись воспалительные заболевания урогенитального тракта: уретрит, бактериальный вагиноз, эндоцервицит, сальпингит, сальпингоофорит. Кроме того, у них определялись клинические маркеры ВИД: дисбактериоз кишечника, рецидивирующие инфекции респираторного тракта (хронический фарингит, фаринготрахеит, рецидивирующий ларингит, бронхит), хронический пиелонефрит.
Возраст мужчин, вошедших в исследование, составил от 25 до 43 лет. У всех пациентов имелись хронические воспалительные заболевания урогенитального тракта: хронический уретрит, хронический простатит. Проведенное исследование спермы у большинства больных выявило олигозооспермию и/или астенозооспермию и/или лейкоспермию. У 3 пациентов, несмотря на наличие хронического уретрита и катарального простатита, при исследовании спермы патологических отклонений обнаружено не было. Изменения в сперме носили умеренный характер, и через 6–12 мес терапии у большинства из них ранее обнаруженные патологические изменения спермы значительно уменьшились или не выявлялись.
Вошедшие в группу супружеские пары ранее неоднократно получали курсы антибактериальной терапии, включающей фторхинолоны, макролиды, тетрациклины, а также препараты метронидазола по поводу воспалительных процессов урогенитального тракта без существенного положительного эффекта или с непродолжительным клиническим эффектом.
При первичном осмотре всем пациентам проводилось комплексное клиническое и лабораторное обследование, включающее бактериологическое исследование отделяемого из уретры у мужчин, уретры и шейки матки у женщин, ультразвуковое исследование органов малого таза, брюшной полости, почек и др., диагностику инфекций, иммунологическое обследование.
Детекцию вирусных инфекций проводили с помощью полимеразной цепной реакции (ПЦР), иммуноферментного анализа. Материалом для выделения ДНК служили материал из уретры, цервикального канала, осадок мочи, эпителиальные клетки из назофарингеальной области. В работе были использованы диагностические наборы производства ЦНИИ эпидемиологии МЗ РФ «АмплиСенс» и НПФ «Литех» для определения следующих патогенов: C. trachomatis, M. hominis, M. genitalium, U. urealiticum, G. vaginalis, T. vaginalis, N. gonorrhoeae, цитомегаловирус (ЦМВ), вирус простого герпеса 1-го и 2-го типа (ВПГ-1, 2), вирус папилломы человека 16 и 18, вирус герпеса человека (ВГЧ) 6-го типа, вирус Эпштейна–Барр (ВЭБ).
Исследование иммунного статуса включало определение субпопуляций лимфоцитов CD3+, CD4+, CD8+, CD72+, CD16+, активационных маркеров лимфоцитов HLA-DR+, CD11b+, CD 25+, в периферической крови с помощью моноклональных антител серии ЛТ (НИИ иммунологии, ТОО «Сорбент»); подсчет проводился на проточном цитометре «Ortum spectrum». Кроме того, определяли содержание иммуноглобулинов (Ig) А, М, G в сыворотке по Manchini (1963), циркулирующих иммунных комплексов (по В. Гашковой, 1978). Оценивали функциональную активность (авидность) антител к антигенам грамположительных и грамотрицательных бактерий с помощью тест-системы для экспресс-диагностики доклинических и клинически выраженных форм иммунологической недостаточности по оригинальной методике В. С. Гевондяна. Интерфероновый (ИФН) статус определяли микрометодом в цельной гепаринизированной крови по Ф. И. Ершову (1996). Оценка ИФН-статуса включала определение уровня сывороточного ИФН в цельной крови, способности лейкоцитов к продукции a-ИФН под действием вируса болезни Ньюкасла, а также способности продуцировать g-ИФН под воздействием фитогемагглютинина (ФГА).
Комплексная терапия включала проведение по показаниям этиотропной терапии (антибактериальной, противовирусной, противогрибковой терапии), детоксикации, программной иммунотерапии на фоне метаболической, антиоксидантной и витаминотерапии (по показаниям), лечение осложнений ВИД. Проводилась как системная, так и местная терапия.
Условиями терапии были: строгое выполнение пациентом назначений врача, отказ от приема алкоголя и курения, нормализация питания и двигательной активности. Также проводился регулярный мониторинг со стороны лечащего врача (при необходимости ежедневный или еженедельный). Продолжительность лечения пациенток составила в среднем от 0,6 года до 2,5 лет.
Если позволяла клиническая ситуация, до назначения противомикробных средств проводили детоксикацию, антиоксидантную и метаболическую терапию. Детоксикация (энтеросорбция, плазмаферез, гемосорбция, парентеральное введение детоксицирующих растворов) является важным звеном «подготовки» иммунной и других систем к активным медикаментозным воздействиям, она позволяет уменьшить или полностью снять супрессию или гипореактивность иммунокомпетентных клеток, улучшить состояние многих систем организма. При выявлении (по тесту с нитросиним тетразолием (НСТ) и др.) признаков окислительного стресса (повышенного образования нейтрофилами активных форм кислорода) назначали в комбинации 2–3 препарата, обладающих антиоксидантным действием (аскорбиновая кислота, витамин Е, селен, липоевая кислота, иммунофан, полиоксидоний, мексидол, эмоксипин, глутоксим и др.). Витамин Е не применяли у больных с поликистозом яичников. Всем пациентам проводилась также системная энзимотерапия (СЭТ) вобэнзимом или флогэнзимом в дозах не менее 15 драже в сутки 3–4 курса по 2–3 мес (с интервалом 2 мес). Проведение СЭТ при ВЗОМТ патогенетически обосновано, так как СЭТ обладает противовоспалительным и иммуномодулирующим эффектом. Под действием энзимных препаратов уменьшается инфильтрация плазматическими белками интерстициальной ткани и увеличивается элиминация белкового детрита и депозитов фибрина в зоне воспаления [10]. Это обеспечивает улучшение микроциркуляции и ускоряет течение восстановительного процесса. Препараты СЭТ также оказывают регулирующее влияние на ряд цитокинов и экспрессию рецепторов к ним на клетках-мишенях.
При решении вопроса о необходимости проведения иммунокоррекции учитывали клинические маркеры иммунной недостаточности, а также результаты иммунологического обследования. Во избежание ложных выводов проводили исследование показателей иммунитета в динамике до лечения, а также на фоне и/или после лечения.
При острых затяжных инфекционных процессах и наличии показаний к иммунокоррекции (тяжесть заболевания, угроза осложнений, сопутствующие заболевания, ассоциированные с развитием ВИД), а также при тяжелой недостаточности иммунитета назначали заместительную иммунотерапию (ЗИТ), включающую применение иммуноглобулинов для внутривенного введения, тимомиметиков и рекомбинантного α-ИФН при выявлении недостаточности выработки этих факторов в организме. Также по показаниям использовали рекомбинантный интерлейкин-2 (ИЛ-2) или ронколейкин [11], реже — беталейкин и др. Как правило, больные нуждались в повторных курсах ЗИТ. Как уже упоминалось, системная терапия всегда сочеталась с местной (введение антисептиков, эубиотиков, иммунотропных средств).
При затяжных или обострении хронических процессов по результатам лабораторных исследований проводилась заместительная терапия и/или иммунокоррекция выявленных нарушений под контролем иммунного обследования. Назначались повторные курсы детоксикации и антиоксидантной терапии. Объем и длительность вспомогательной терапии определяли на основании клинических данных, по наличию и выраженности маркеров эндотоксикоза, а также по степени продукции активных форм кислорода (по НСТ-тесту, хемилюминесценции нейтрофилов и др.). После повторных обследований при необходимости (если сохранялись клинические и/или лабораторные признаки ВИД) продолжали иммунокоррекцию (программную иммунореабилитацию).
При проведении индивидуальной иммунокоррекции учитывали тяжесть иммунной дисфункции и степень поражения разных звеньев иммунной системы [12]. При угнетении продукции IgG или несостоятельности гуморального иммунитета проводилось внутривенное введение препаратов иммуноглобулина (иммуноглобулин человеческий нормальный, 10–15 г; при необходимости повторяли введение препарата). При недостаточности и дисбалансе Т-системы иммунитета применялись тимомиметики (Т-активин, тимоген, иммунофан). При наличии иммунологических маркеров недостаточности продукции ИЛ-2 назначали ронколейкин в рекомендуемых дозировках (2,5–3,0 млн ЕД на курс) с повторными курсами [11]. В случае недостаточности или супрессии синтеза α-и/или γ-ИФН назначались препараты ИФН (виферон, реаферон), индукторы синтеза интерферона (амиксин, циклоферон, баксин).
При выявлении латентной вирусной инфекции (репликативная фаза), выраженного дисбиоза слизистых ротоглотки, кишечника, мочеполового тракта с наличием патогенной или чрезмерным содержанием условно-патогенной флоры проводили соответствующую терапию. Лечение сопутствующих вирусных инфекций было комплексным, проводилось под лабораторным контролем и включало применение препаратов α-ИФН, индукторов ИФН-генеза, аномальных нуклеотидов (ацикловир при ВПГ-1, 2, валтрекс, фамвир — при выявлении ВЭБ, ВГЧ 6-го типа).
Необходимо отметить, что для большинства иммунокорректоров длительность одного курса устанавливалась индивидуально — от нескольких недель до нескольких месяцев. Кроме того, препараты с активирующим эффектом, а также антиоксиданты отменяли постепенно.
Антибактериальная терапия проводилась с учетом определения чувствительности выделенной флоры к антибиотикам только в фазе выраженного и затяжного инфекционного процесса. Наиболее часто пациенты получали антибиотики из группы макролидов и фторхинолонов — 2–3 курса по 10 дней с интервалом 2 нед в терапевтической дозировке. В нескольких случаях в схему входила противогрибковая терапия (дифлюкан). По показаниям противомикробную и противовирусную терапию получали оба супруга. Активное местное лечение (мирамистин, деринат, энтеросгель и др.) проводилось курсами по 10–14 сеансов до восстановления влагалищной флоры и установления факта отсутствия лейкоцитоза в генитальном мазке.
При микроскопическом исследовании мазков из уретры, шейки матки во всех случаях наблюдалась смешанная кокковая флора, лейкоцитоз, в трех случаях была отмечена грибковая флора. В результате проведения ДНК-диагностики и бактериологического исследования у всех пациенток была выявлена микст-инфекция. Наиболее часто у пациентов определялась хламидийная инфекция, однако в виде моноинфекции хламидиоз имел место только в одном случае. В остальных случаях хламидийная инфекция сочеталась с другими ИППП и бактериальной флорой. Обращает на себя внимание частое выявление N. gonorrhoeae и ВПГ-1, 2 методом ПЦР, а также герпесвирусных инфекций в орофарингеальной области. Так, при ПЦР гонорея была выявлена у 5 из 16 женщин, ВПГ-1, 2 — у 7, а при ПЦР материалов из орофарингеальной области у 14 пациенток были выявлены вирусные инфекции герпес-группы (ВЭБ, ВГЧ 6-го типа, ВПГ-1, 2), ассоциирующейся с рецидивирующим воспалительным процессом верхних отделов дыхательных путей.
При бактериологическом исследовании в мазках из цервикального канала и/или уретры оказалось, что в большинстве случаев у пациентов имела место микст-инфекция (две-три инфекции, а у одной пациентки — четыре инфекции). Обращает на себя внимание отличие в частоте выявления N. gonorrhoeae при ДНК-диагностике методом ПЦР и бактериологическом исследовании: при бактериологическом исследовании N. gonorrhoeae выявлялась реже.
Таким образом, результаты обследования отражают давность инфекционно-воспалительного процесса, наличие морфологических изменений органов малого таза и клинических признаков выраженного иммунодефицита.
При исследовании мужчин из бесплодных пар оказалось, что наиболее часто у них выявлялась хламидийная инфекция (у 12 из 16 больных), как правило, в сочетании с микоплазмозом, уреаплазмозом и/или гонореей, гарднерелезом и др. Кроме того, у 10 больных при ПЦР материала с орофарингеальной области (соскоб из зева, слюна) были выявлены вирусные инфекции герпес-группы (ВЭБ, ВГЧ 6-го типа, ВПГ-1, 2).
При исследовании иммунной системы женщин с вторичным бесплодием определялись изменения в различных звеньях иммунитета, отражающие недостаточность иммунного ответа на инфекцию и являющиеся лабораторными признаками ВИД. В гуморальном звене иммунной системы отмечались дисиммуноглобулинемия, дефицит выработки IgG, преобладание продукции низкоавидных антител, невысокий уровень циркулирующих иммунных комплексов.
В среднем по группе уровень IgA, осуществляющий защитную функцию слизистых оболочек, был достоверно повышен по сравнению со значением у здоровых лиц. Уровень IgM также был повышен у большинства больных изучаемой группы. Однако содержание IgG, являющегося одним из основных факторов нейтрализации и выведения патогенов из организма, а также протективного иммунитета, в среднем по группе оказалось ниже показателя, характерного для здоровых лиц.
|
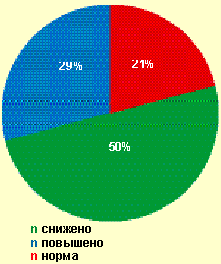
| Рисунок 1. Уровни IgG у женщин с вторичным бесплодием (n = 16) до лечения |
Только у 1/3 больных было отмечено высокое содержание IgG (в среднем 1715,0 ± 10,3 мг%), в то же время у 50% из них содержание IgG в среднем было снижено до 950,71 ± 15,3 мг%, в остальных случаях оно оказалось сопоставимо с показателями у здоровых лиц (рис. 1). Таким образом, у большинства женщин с вторичным бесплодием не наблюдалось повышения IgG в ответ на микст-инфекцию и наличие активного инфекционного воспаления в малом тазу, а также на наличие репликации герпесвирусных инфекций как в генитальном тракте, так и в орофарингеальной зоне.
В результате исследования титров и качества вырабатываемых антител класса IgG к бактериальным антигенам в исследуемой группе оказалось, что несмотря на увеличение титров противобактериальных антител по сравнению с группой здоровых лиц содержание высокоавидных (высокоактивных) антител у данного контингента больных резко снижено. Уровень циркулирующих иммунных комплексов, отражающий эффективность выведения чужеродного антигена из организма, в среднем не превышал показатель группы здоровых, а почти у половины больных был ниже такового (35,0 ± 3,2 усл. ед.).
Таким образом, по данным обследования, у большинства больных, страдающих вторичным бесплодием, была выявлена выраженная недостаточность гуморального звена иммунитета.
При исследовании основных субпопуляций лимфоцитов у больных со вторичным бесплодием были обнаружены нарушения, выражающиеся в дисбалансе между Т-хелперами CD4+ и цитотоксическими лимфоцитами (ЦТЛ) CD8+, недостаточном уровне естественных киллеров, дефиците активированных Т-лимфоцитов CD16+ (табл. 1).
Из таблицы 1 видно, что в среднем по группе отмечается тенденция к снижению процентного содержания основных субпопуляций лимфоцитов.
|
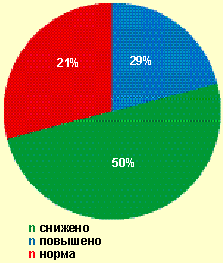
| Рисунок 2. Уровни Т-хелперов у женщин с вторичным бесплодием (n = 16) |
При структурном анализе параметров Т-звена иммунитета (рис. 2) у половины больных было отмечено достоверное снижение уровня CD4+-лимфоцитов (в среднем до 30,36 ± 0,5%), в то время как повышение уровня CD4+-лимфоцитов выявлено только у 21 % женщин.
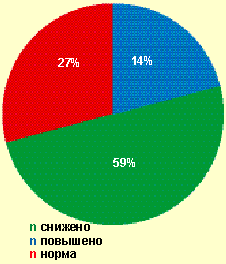
Таким образом, почти у 80% обследуемых женщин уровень CD4+-лимфоцитов был ниже или в пределах нормы, что отражает отсутствие ответа Т-хелперов на активную микст-инфекцию у этих больных. Этот факт подтверждается снижением числа клеток, несущих рецептор «поздней активации» — HLA-DR+. У 59% женщин с вторичным бесплодием уровень HLA-DR+-лимфоцитов, отражающих продукцию ИЛ-2, снижен и у 27 % он не отличается от показателей здоровых лиц (рис. 3).
В то же время только у 14 % больных наблюдалось повышение уровня HLA-DR+-лимфоцитов и соответственно увеличение продукции ИЛ-2, необходимого для нормального иммунного ответа. Известно, что ИЛ-2 является одним из ключевых звеньев цитокиновой сети. ИЛ-2 активирует процессы пролиферации и дифференцировки Т-лимфоцитов и естественных киллеров, повышает активность моноцитов, а также способность плазматических клеток cекретировать Ig и цитокины, регулирует экспрессию на клетках важнейших активационных рецепторов.
|
| Рисунок 3. Уровни HLA-DR+-лимфоцитов у женщин с вторичным бесплодием (n = 16) |
Сходные нарушения были обнаружены при исследовании содержания HLA-DR+-лимфоцитов (рис. 4), что косвенно отражает недостаточность продукции ИЛ-2.
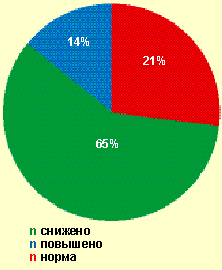
Таким образом, у большинства больных с вторичным бесплодием и ВЗОМТ отмечается недостаточность системы специфической цитотоксичности, так как увеличение ЦТЛ и HLA-DR+-лимфоцитов в ответ на активную микст-инфекцию наблюдается лишь у 14 % пациенток. Также у половины больных выявлялась гипореактивность системы естественных киллеров.
При изучении ИФН-статуса у большинства больных были обнаружены признаки недостаточности ИФН-генеза (табл. 2). В среднем по группе уровень сывороточного ИФН оказался повышен по сравнению с нормой в связи с хронической персистенцией бактериально-вирусной инфекции. Однако повышение наблюдалось только у 1/3 больных этой группы. Продукция α-ИФН в ответ на стимул была достоверно снижена более чем у половины больных. Стимулированная выработка γ-ИФН в среднем по группе также была меньше показателя группы контроля. Выявленные изменения в системе ИФН отражают недостаточность этой системы и требуют адекватной корригирующей терапии.
Выявленные отклонения в работе иммунной системы в виде дисиммуноглобулинемии, нарушения выработки Ig, снижения активности вырабатываемых антител, дефицита ЕК, активированных Т-лимфоцитов, снижения продукции ИФН (у многих женщин был комбинированный ВИД) явились показанием для проведения детоксикационной, антиоксидантной терапии с дальнейшим подключением иммунокорригирующей терапии. Выбор необходимых иммуномодуляторов для индивидуальной схемы лечения производился в зависимости от пораженного звена (звеньев) иммунной системы больного.
|
| Рисунок 4. Уровни цитотоксических лимфоцитов CD8+ у женщин с вторичным бесплодием (n = 16) |
В ходе комплексного программного лечения всем пациентам проводилось динамическое клинико-лабораторное обследование, включая 3–6-месячный период после окончания лечения. Так, по результатам трехкратного лабораторного обследования в динамике после программного лечения и через 3 и 6 мес выявлявшиеся ранее инфекции у женщин с вторичным бесплодием и ВЗОМТ обнаружены не были. Надо отметить, что в процессе терапии при активации иммунной системы отмечались периоды обострения имеющихся инфекций, на этом фоне находили другие ИППП, не выявляемые ранее (по-видимому, из скрытых очагов), например гонорею и хламидиоз, обострение герпесвирусной инфекции, вызванной ВПГ-1, 2. С учетом полученных результатов можно полагать, что временное усиление воспалительного процесса на фоне восстановления и активации тех или иных звеньев иммунитета представляет собой важный фактор для элиминации инфекции.
После окончания терапии у всех пациентов отмечались улучшение клинического состояния и ряда параметров иммунного статуса. Так, уровни IgA и IgM снижались до нормальных значений у большинства больных. Содержание IgG у больных с исходно измененными показателями (повышение или понижение по сравнению с показателями контрольной группы) нормализовалось (до 1160,4 ± 15,2 и 1310,0 ± 20,3 мг% соответственно). Повышенный титр антибактериальных антител класса IgG после терапии снизился до нормальных величин. Также после лечения у многих пациенток нормализовалась продукция высокоавидных (т. е. функционально полноценных) антител класса IgG. В ходе терапии наметилась тенденция к увеличению содержания ЦТЛ CD8+ у лиц с исходным их снижением.
Лечение мужчин из бесплодных пар за этот период также было успешным. Сроки лечения мужчин составили от 0,6 года до 2,5 лет.
Планирование беременности рекомендовалось при устойчивом отсутствии инфекций в исследуемых материалах в динамике, ремиссии ВЗОМТ.
После проведенного комбинированного общего и местного лечения у 10 пациенток наступила беременность, окончившаяся рождением доношенных детей; у 2 женщин были повторные беременности, в результате родились здоровые доношенные дети, у одной пациентки — срок беременности на данный момент составил 36 нед, 2 пациентки — на стадии планирования беременности, у 3 женщин (3 пар) комбинированная терапия продолжена.
Таким образом, проведение комплексного этиопатогенетического лечения (системного и местного), включающего индивидуально подобранную программную иммунокоррекцию и иммунореабилитацию на фоне общего оздоровления и лечения осложнений/маркеров ВИД и сопутствующих заболеваний, привело у большинства женщин с вторичным бесплодием к восстановлению репродуктивной функции и позволило им родить здоровых детей.
Литература
- Чеботарев В. В., Гоннова Л. Н., Беляева Н. В. и др. Отечественные и зарубежные взгляды на лечение воспалительных заболеваний органов малого таза//Инфекции, передаваемые половым путем. 1999. № 6. С. 28–31.
- Агаджанова А. А. Современные методы терапии больных с привычным невынашиванием беременности//РМЖ. 2003. Т. 11. № 1.
- Яглов В. В. Воспалительные заболевания органов малого таза//Гинекология. 2001. Т. 1. № 3.
- Тихомиров А. Л. Современное лечение воспалительных заболеваний органов малого таза у женщин с использованием офлоксацина//Гинекология. 2000. Т. 2. № 6.
- Молочков В. А., Ильин И. И. Хронический уретритогенный простатит. М.: Медицина, 1998.
- Машкиллейсон А. Л., Мартынова В. Р., Гомберг М. А. и др. Урогенитальные хламидийные инфекции. Диагностика и лечение. М., 1996.
- Кисина В. И. Урогенитальные инфекционные заболевания: современное состояние проблемы//Consilium Medicum. 2001. Т. 3. № 7.
- Тихомиров А. Л., Юдаев В. Н., Лубнин Д. М. Современный алгоритм терапии воспалительных заболеваний половой системы//РМЖ. 2003. Т. 11. № 1.
- Малашенкова И. К., Дидковский Н. А. Принципы иммунокорригирующей терапии вторичных иммунодефицитов, ассоциированных с хронической вирусно-бактериальной инфекцией//РМЖ. 2002. Спец. вып. Т. 10. № 21. С. 973–977.
- Системная энзимотерапия/под ред. В. И. Мазурова, А. М. Лила, Ю. И. Стернина. СПб.: Моби Дик, 1997.
- Бабаченко И. В., Егорова В. Н., Козлов В. К. Рекомбинантный интерлейкин-2 человека. СПб., 2001. С. 46.
- Малашенкова И. К., Дидковский Н. А., Левко А. А. К вопросу о роли индивидуального подбора иммунокорректоров//Фарматека. 2004. С. 118–122.
И. К. Малашенкова, кандидат медицинских наук
А. В. Ледов
И. Н. Зуйкова
Ж. Ш. Сарсания, кандидат биологических наук
Н. А. Дидковский, доктор медицинских наук, профессор
НИИ физико-химической медицины, ММА им. И. М. Сеченова, поликлиника Климовской ЦГБ, Москва, Климовск
Врезки:
