Метаболический синдром у женщин в постменопаузе: влияние моксонидина и метропролола
Возросший интерес к проблеме метаболического синдрома у женщин в период менопаузы обусловлен большим количеством фактических данных, свидетельствующих о существенном влиянии его на развитие атеросклероза, а также тем, что за последнее время заметно увеличилась его распространенность. Термин «метаболический синдром» используют в том случае, когда у одного больного имеется несколько факторов риска, таких, как артериальная гипертония (АГ), инсулиновая резистентность, дислипидемия, абдоминальное ожирение, оказывающих синергидное действие на процессы атерогенеза.
Распространенность сердечно-сосудистых заболеваний, в том числе АГ, у мужчин в средних возрастных группах превышает таковую у женщин. Однако наступление менопаузы сопровождается заметным ростом кардиоваскулярной заболеваемости у женщин, что происходит на фоне неблагоприятных метаболических изменений, выражающихся прежде всего в нарушениях липидного и углеводного обмена. Начало менопаузы у женщин сопровождается снижением уровня эстрогенов и ростом уровня андрогенов, что способствует увеличению массы тела. За последние несколько десятилетий во всех странах наблюдается увеличение числа лиц, страдающих ожирением, что сопровождается ростом распространенности инсулинорезистентности и сахарного диабета (СД) 2 типа.
В ряде исследований было продемонстрировано, что резистентность тканей к инсулину имеет важное значение в патогенезе АГ, возникающей у больных с метаболическим синдромом. Длительная гиперинсулинемия, возникающая у больных с инсулинорезистентностью, вызывает парадоксальную вазоконстрикцию, стимуляцию симпатической нервной системы, увеличение объема циркулирующей крови за счет увеличения реабсорбции ионов натрия и воды в дистальных канальцах нефронов. Кроме того, инсулин является фактором, стимулирующим клеточный рост, поэтому гиперинсулинемия способствует пролиферации сосудистых гладкомышечных клеток и увеличению сосудистого сопротивления. Инсулин оказывает влияние на механизмы трансмембранного ионного транспорта, и увеличение его концентрации приводит к повышению внутриклеточной концентрации ионов натрия и калия, с чем связывается повышение чувствительности гладкомышечных клеток артериол к прессорному влиянию катехоламинов и ангиотензина II [1–4].
Сочетание АГ и инсулиновой резистентности у одного больного повышает требования к медикаментозной терапии, которая в этих условиях, влияя на один из компонентов метаболического синдрома, не должна усиливать действие другого. Основные требования к препарату выбора для лечения АГ у женщин с метаболическим синдромом в постменопаузе заключаются в том, что он должен обладать выраженным антигипертензивным эффектом, способностью улучшать метаболизм глюкозы, не ухудшать инсулиновую резистентность тканей, ограничивать влияние на сердечно-сосудистую систему нейрогуморальных факторов, снижать активность симпатической нервной системы, уменьшать задержку натрия и воды, не ухудшать симптомы менопаузы.
В качестве антигипертензивных средств новой генерации, обладающих указанными свойствами, рассматриваются агонисты I1-имидазолиновых рецепторов. Как было продемонстрировано в ходе плацебоконтролируемого исследования, проведенного N. De Luca, R. Izzo, D. Fontana и соавторами (2000) и включавшего 72 пациента с АГ и избыточной массой тела, лечение агонистом I1-имидазолиновых рецепторов моксонидином в течение 8 нед вызывало достоверное улучшение чувствительности периферических тканей к инсулину [16].
Целью исследования стали сравнительная характеристика антигипертензивной активности и влияния на показатели углеводного обмена агониста I1-имидазолиновых рецепторов моксонидина (физиотенза) и β-адреноблокатора метопролола у женщин с метаболическим синдромом в постменопаузальном периоде.
В исследование были включены 40 женщин, в возрасте от 48 до 58 лет (средний возраст 55 ± 5,4 года), с увеличением массы тела (индекс массы тела (ИМТ) 32 ± 3 кг/м2), наличием АГ I–II степени (при измерении аускультативным методом — систолическое АД (САД) составило 153,9±10 мм рт. ст.; диастолическое АД (ДАД) — 95,7 ± 5 мм рт. ст.; по данным суточного мониторирования АД (СМАД) среднесуточное САД составило 37±12,7 мм рт. ст., среднесуточное ДАД — 82,6 ± 9 мм рт. ст.), уровнем глюкозы натощак — 6,1 ± 0,9 ммоль/л. У всех женщин наступила естественная менопауза и никто из них не получал гормонозаместительную терапию. Больные были рандомизированы в группы лечения моксонидином (физиотенз, Solvey Pharma) 0,2–0,4 мг/сут либо метопрололом 100–150 мг/сут. В первую группу вошла 21 больная, во вторую группу — 19 больных. В выделенных группах больные статистически достоверно не различались по таким показателям, как возраст, длительность анамнеза АГ, масса тела. Началу активного лечения предшествовал 2-недельный контрольный период, на это время отменялась ранее назначенная антигипертензивная терапия. Включенные в исследование пациентки получали моксонидин либо метопролол в виде монотерапии; комбинации указанных препаратов с другими антигипертензивными средствами не назначались.
Сбор анамнестических данных и клиническое обследование больных с анализом проявлений менопаузальных симптомов проводились при включении пациенток в исследование, а также в конце контрольного периода, через 2, 6 и 12 нед терапии. При 3-м и 4-м визитах при уровне АД 140/90 мм рт. ст. и выше (по данным казуальных измерений) дозу препаратов увеличивали до 0,4 мг моксонидина и 150 мг метопролола в сутки.
Клиническое артериальное давление (АДкл.) определяли как среднюю величину трех измерений АД ртутным сфигмоманометром по методу Короткова, выполненных в положении обследуемого сидя после 5 мин отдыха в отсутствие терапии или спустя 2–3 ч после приема препарата.
СМАД проводилось с помощью прибора CardioTens-01 (Mediteck, Венгрия). Средняя продолжительность мониторирования составила 24 ± ± 0,5 ч. В период с 10 до 22 ч АД регистрировалось каждые 15 мин, с 22 до 5 ч — каждые 30 мин, с 5 до 10 ч — каждые 10 мин.
При проведении СМАД оценивались такие параметры, как среднесуточный, среднедневной, средненочной уровни САД и ДАД, а также показатели нагрузки давлением (индекс времени и индекс площади гипертонии), вариабельности АД, и вычислялся суточный индекс. Уровень среднесуточного АД более или равный 130 мм рт. ст. для САД и более или равный 80 мм рт. ст. для ДАД рассматривался как повышенный [6, 7].
Велоэргометрическая проба (ВЭМ) проводилась с целью определения характера изменений АД в условиях динамической физической нагрузки. ВЭМ выполнялась после мониторирования АД, при отсутствии противопоказаний к проведению нагрузочной пробы, в утренние часы, после легкого завтрака, в положении лежа с использованием метода ступенчато-возрастающей нагрузки. Исследование проводилось исходно через 14 дней после отмены антигипертензивной терапии и на фоне терапии препаратом, через 3–4 ч после приема его очередной дозы. Пробу начинали с нагрузки 25 Вт, мощность нагрузки повышали на 25 Вт с интервалом в 3 мин. АД и ЧСС регистрировались исходно и с интервалом в 1 мин во время нагрузки и в течение каждой минуты восстановительного периода. Мониторирование электрокардиограммы в 12 стандартных отведениях проводилось в течение всей пробы, регистрация — на 3 минуте каждой ступени нагрузки.
Для оценки гипертензивной реакции АД использовали критерии гипертензивной реакции, которые заключались в повышении АД более 200/100 мм рт. ст. при ВЭМ на фоне нагрузки 100 Вт и превышение предела 140/90 мм рт. ст. для АД на 5-й минуте восстановительного периода [8].
Изометрическая проба проводилась следующим образом. С помощью динамометра определяли максимальную силу в правой руке пациента. Затем в течение 3 мин пациент сжимал динамометр с силой, составляющей 30 % от максимальной. АД и ЧСС регистрировалось непосредственно перед пробой исходно и в конце 3-й минуты сжимания динамометра. ЭКГ регистрировалось в течение 3 мин восстановительного периода. Оценивались максимальные САД, ДАД, ЧСС, измеренные на высоте нагрузки (в конце 3-й минуты), а также прирост САД, ДАД, ЧСС — разница максимального САД, ДАД, ЧСС и исходных значений.
Оценка параметров углеводного обмена и инсулинемии включала в себя проведение стандартного глюкозотолерантного теста (ГТТ) с параллельным определением уровня глюкозы и инсулина в сыворотке крови натощак и на 30, 60 и 120-й минутах ГТТ.
Уровень глюкозы крови определялся стандартным глюкозооксидазным методом. Уровень инсулина в сыворотке крови устанавливали радиоиммунологическим методом с использованием стандартных наборов реактивов РИО-ИНС-ПГ1251. По результатам проведенного исследования были рассчитаны интегральные показатели: площадь под кривой глюкозы (ППКГ) и площадь под кривой инсулина (ППКИ) [10]. Расчеты производили по методу суммы трапеций с применением следующих формул:
ППКГ = 1/2 х (Г30–Г0) х 30 + Г0 х 30 + 1/2 х (Г30–Г60) х 30 + Г60 х 30 + 1/2 (Г60–Г120) х 60 + Г120 х 60,
где Г0 — уровень глюкозы в крови натощак; Г30, Г60, Г120 — уровни глюкозы в крови через 30, 60 и 120 мин после нагрузки глюкозой;
ППКИ = 1/2 х (И30 — И0) х 30 + И0 х 30 + 1/2 х (И30 — И60) х 30 + + И60 х 30 + 1/2 (И60–И120) х 60 + И120 х 60,
где И0 — уровень инсулина в сыворотке крови натощак; И30, И60, И120 — уровни инсулина в сыворотке крови через 30, 60 и 120 мин после нагрузки глюкозой.
Статистический анализ проводили с помощью пакета программ Exсel 7.0 и Statgraphics 2.1 с использованием рекомендованных критериев. Различия считали достоверными при p < 0,05. Результаты представлены в виде M ± SD.
По данным клинического измерения АД, терапия моксонидином и метопрололом характеризовалась положительным антигипертензивным эффектом (табл.). При этом доля пациентов, у которых удалось достигнуть снижения АД до уровня менее 140/90 мм рт. ст. в группах моксонидина и метопролола существенно не различалась и составила 71 и 80% соответственно. Межгрупповые различия по изучаемым показателям как до лечения, так и спустя 3-месячный период терапии были статистически недостоверны. Существенной динамики ЧСС в группе лиц, получающих моксонидин, отмечено не было, тогда как на фоне приема β-адреноблокатора данный показатель достоверно снизился.
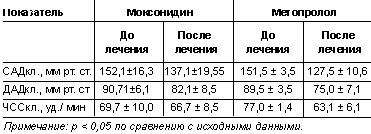
|
| Таблица. Динамика измерений АД и ЧСС на фоне терапии моксонидином и метопрололом |
Полученные результаты свидетельствуют о том, что оба препарата оказывают сопоставимый антигипертензивный эффект, особенность которого заключалась в преимущественном влиянии на уровень систолического АД в дневной период суток.
В настоящем исследовании не было отмечено достоверного влияния изучаемых препаратов на такие показатели, как вариабельность АД, суточный индекс, индекс гипертонии, индекс площади гипертонии, а также двойное произведение, что мы объясняем отсутствием выраженных изменений данных параметров в обеих группах исходно.
С целью оценки влияния препаратов на функционально-адаптационные возможности кровообращения гемодинамические показатели регистрировались в ходе проведения ВЭП. При этом были установлены значительные преимущества β-адреноблокатора в отношении подавления гипертензивной реакции, возникающей в условиях данного варианта стресс-тестирования. Подобный вывод можно было сделать при анализе гемодинамических показателей, зарегистрированных уже при мощности нагрузки 50 Вт.
С другой стороны, результаты пробы с изометрической нагрузкой не позволяли однозначно судить о преимуществах метопролола и отражали сопоставимый эффект сравниваемых препаратов в отношении подавления гипертензивной реакции.
В ходе исследования не было выявлено статистически значимого изменения уровня гликемии на фоне приема как моксонидина, так и метопролола, что отражает представленная на рисунке 1 динамика интегрального показателя ППКГ. Тем не менее в группе лечения моксонидином отмечалась тенденция к уменьшению (7,6 %), а в группе метопролола — повышение (3,6 %) уровня глюкозы в сыворотке.
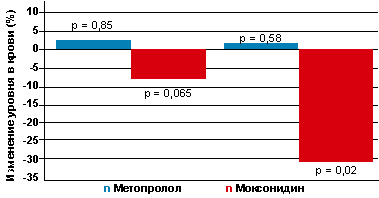
|
| Рисунок 1. Динамика измений уровня глюкозы и инсулина в крови (%) до лечения и на фоне приема метопролола и моксонидина через 12 недель терапии |
Сравнительный анализ влияния препаратов на гиперинсулинемию — критерий инсулинорезистентности — свидетельствовал о статистически достоверном снижении уровня инсулина в плазме только в группе больных, получавших моксонидин (рис. 2). Это отражает важную сторону эффекта данного препарата, имеющую значение в контексте патогенетической терапии артериальной гипертонии у лиц с метаболическим синдромом.
Применение моксонидина и метопролола не сопровождалось развитием серьезных побочных эффектов, требовавших отмены препарата; переносимость препаратов в целом оценена как хорошая. У 3 больных на фоне приема моксонидина, отмечалось появление сухости во рту, которая возникла в первые дни лечения и исчезла при продолжении терапии. У 6 пациенток, получавших метопролол, наблюдались явления мышечной слабости, нарушения сна, неприятные ощущения в нижних конечностях.
Принимая во внимание значение СД 2 типа для развития кардиоваскулярных осложнений, разработка мероприятий, направленных на первичную профилактику данного заболевания, является актуальной и чрезвычайно важной задачей. В значительной мере успех ее решения при лечении больных с метаболическим синдромом определяется эффектами антигипертензивных препаратов, и в частности их способностью оказывать влияние на процессы углеводного и липидного обмена.
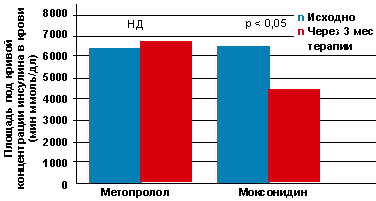
|
| Рисунок 2. Сравнительная динамика инсулинемии на фоне терапии метопрололом и моксонидином, по результатам расчета ППКИ |
С этих позиций включение в терапию лиц, страдающих АГ, препаратов, обладающих не только выраженной антигипертензивной активностью, но и положительно влияющих на метаболический профиль, соответствует цели лечения больных АГ [9].
Результаты настоящего исследования свидетельствуют о высокой антигипертензивной эффективности как агониста I1-имидазолиновых рецепторов моксонидина (физиотенза), так и β-адреноблокатора метопролола у женщин с метаболическим синдромом в периоде постменопаузы. Данный контингент больных можно рассматривать как категорию лиц, имеющих высокий риск развития СД 2 типа и его кардиоваскулярных осложнений. Поэтому представляется важным тот факт, что у большей части больных использование этих препаратов в режиме монотерапии позволяет достигнуть целевых значений АД.
Результаты СМАД подтверждают вывод о том, что антигипертензивная активность агониста I1-имидазолиновых рецепторов моксонидина (физиотенза) и β-адреноблокатора метопролола сопоставимы. В ходе некоторых исследований удалось [10, 11] продемонстрировать влияние β-адреноблокаторов и агонистов I1-имидазолиновых рецепторов на среднедневной уровень диастолического АД. Отсутствие подобной тенденции в нашем исследовании можно объяснить тем, что среди обследованных больных были лица с исходно невысоким уровнем диастолического АД. О положительном антигипертензивном эффекте исследованных препаратов свидетельствуют также результаты нагрузочных проб (ВЭМ и пробы с изометрической нагрузкой).
Тот факт, что большая выраженность антигипертензивного эффекта препаратов совпадала с периодом максимальной активности нейрогуморальных систем, в значительной степени определяет их клиническое значение. С другой стороны, отсутствие чрезмерного снижения АД в периоды преимущественно вагусной активности, позволяет использовать агонисты I1-имидазолиновых рецепторов, наряду с β-адреноблокаторами в тех ситуациях, когда выраженный гипотензивный эффект нежелателен (в частности, суточный профиль АД имеет вид over-dipper).
Особенностью гемодинамической реакции в ответ на применение агониста I1-имидазолиновых рецепторов моксонидина в дозах 0,2–0,4 мг/сут в сравнении с использованием β-адреноблокатора метопролола следует считать отсутствие статистически значимого урежения ЧСС. Отсутствие отрицательного хронотропного эффекта при использовании агониста I1-имидазолиновых рецепторов при назначении его в средних терапевтических дозах позволило ряду авторов сделать вывод о большем значении снижения периферического сосудистого сопротивления в механизме антигипертензивного действия моксонидина [12].
Важной стороной клинической эффективности агонистов I1-имидазолиновых рецепторов является благоприятное влияние на показатели углеводного обмена, которое уже было продемонстрировано в целом ряде исследований [13]. Однако в краткосрочных исследованиях достоверного влияния препаратов данной группы на метаболизм глюкозы выявить, как правило, не удается [14]. В нашем исследовании изменения гликемии на фоне лечения агонистом I1-имидазолиновых рецепторов и β-адреноблокатором были не достоверными, носили характер тенденций, хотя и противоположных. Поэтому особое значение имело изучение характера влияния данных групп препаратов на гиперинсулинемию, как основной лабораторный маркер инсулинорезистентности.
При этом нами отмечено статистически достоверное снижение степени гиперинсулинемии на фоне приема моксонидина и отсутствие подобного эффекта у метопролола. Это указывает на уменьшение выраженности инсулинорезистентности под влиянием терапии агонистом I1-имидазолиновых рецепторов моксонидином и отражает корригирующее влияние данного препарата в отношении основного звена патогенеза метаболического синдрома.
Механизм влияния моксонидина на состояние инсулинорезистентности тканей в настоящее время до конца не изучен. Предполагается, что имеют место как центральный, так и периферические эффекты препарата, связанные с влиянием на имидазолиновые рецепторы в поджелудочной железе и других тканях. Кроме того, моксонидин повышает чувствительность инсулиновых рецепторов, оптимизирует процессы утилизации глюкозы, улучшает секрецию инсулина [15].
Результаты нашего исследования свидетельствуют также о хорошей переносимости моксонидина при лечении им в течение нескольких месяцев. Это особенно важно для оптимизации терапии женщин в климактерическом периоде, имеющих проявления метаболического синдрома. На основании вышесказанного можно сделать следующие выводы.
- Агонист I1-имидазолиновых рецепторов моксонидин (физиотенз) при использовании в качестве монотерапии АГ I–II степени у женщин в период постменопаузы, имеющих проявления метаболического синдрома, обладает высокой антигипертензивной эффективностью, сопоставимой с таковой у β-адреноблокатора метопролола. Это отражает динамика АД при клинических измерениях, СМАД, а также его регистрация во время нагрузочных проб.
- Моксонидин (физиотенз) при длительном применении характеризуется хорошим профилем безопасности и низкой частотой развития побочных эффектов.
- Применение моксонидина (физиотенза) в течение 3-месячного периода сопровождается уменьшением выраженности резистентности тканей к инсулину, что отражает положительная динамика инсулинемии.
При выборе средств антигипертензивной терапии для женщин с метаболическим синдромом в период менопаузы необходимо учитывать влияние лекарственных препаратов на обмен липидов и чувствительность тканей к инсулину. Поэтому важное место в лечении таких больных должны занимать агонисты I1-имидазолиновых рецепторов, обладающие выраженным антигипертензивным эффектом и повышающие чувствительность тканей к инсулину.
Литература
- Kaplan N. M. The deadly quartet: upper-body obesity, glucose intolerance, hypertriglyceridemia and hypertension //Arch. Intern. Med.1989;149 : 1514–1520.
- Зимин Ю. В. Происхождение, диагностическая концепция и клиническое значение синдрома инсулинорезистентности или метаболического синдрома Х. //Кардиология. 1998. № 6. С. 71–81.
- Williams B. Insulin resistance: the shape of things to come //Lancet. 1994; 344 : 521–524.
- Sowers J. R., Standley P. R., Ram J. L. et al. Hyperinsulinemia, insulin resistance and hyperglycemia: contributing factors in pathogenesis of hypertension and atherosclerosis // Am. J. Hypertens. 1993; 6 : 260–270.
- Ernsberger P., Damon T. H., Graff L. M. et al. Moxonidine, a centrally acting anti-hypertensive agent, is a selective ligand for Il-imidazoline sites. J Pharmacol Exp Ther 1993;264:172–82.
- Gerin W., Rosofsky M., Pieper C., Pickering T.G. A test of reproducibility of blood pressure and heart rate variability using a controlled ambulatory procedure. J. Hypertens. 1993, Oct; 11(10):1127–31.
- Staessen J. A., Fagard R. H., Lijnen P. J, Thijs L., Van Hoof R., Amery A. K. Mean and range of the ambulatory pressure in normotensive subjects from a meta-analysis of 23 studies. Am. J. Cardiol., 1991, Apr 1;67(8):723–7.
- Аронов Д. М., Лупанов В. . Функциональные пробы в кардиологии. М., 2002. С. 132–134.
- 2003 European Society of Hypertension — European Society of Cardiology guidelines for the management of arterial hypertension. Guidelines Committee. J. Hypertension 2003; 21 (6): 1011–1053.
- Кашерининов Ю. Р., Шаварова Е. К., Шаваров А. А., Конради А. О., Шляхто Е. В. Динамика показателей углеводного и липидного обмена у больных гипертонической болезнью на фоне терапии рилменидином в сравнении с атенололом//Артериальная гипертензия. 2004. Т. 10. №1. С. 28–32.
- Куликов А. Н., Бобров Л. А. Действие некоторых антигипертензивных средств на суточный профиль артериального давления у больных гипертонической болезнью//TERRA MEDICA nova. 2003. № 4. С. 3–7.
- Динамика показателей углеводного и липидного обмена у больных гипертонической болезнью на фоне терапии рилменидином в сравнении с атенололом//Артериальная гипертензия. 2004. Т. 10. № 1. С. 28–32.
- Friedman J. E., Ishizuka T., Liu S. et al. Anti-hyperglycemic activity of moxonidine: metabolic and molecular effects in obese spontaneously hypertensive rat//Blood Pressure, 1998 (Suppl. 3). 32–39.
- Prichard B., Graham B., Owens C. Moxonidine: a new antiadrenergic antihypertensive agent. J. Hypert.1999. 17 (Suppl. 3): 41–54.
- Шевченко О. П., Праскурничий Е. А., Шевченко А. О. Метаболический синдром. М.: Реафарм, 2004. 141 с.
О. П. Шевченко, доктор медицинских наук, профессор
Е. А. Праскурничий, кандидат медицинских наук
В. А. Жукова
РГМУ, КБ УД Президента РФ, Москва
