Омега-3 полиненасыщенные жирные кислоты в профилактике и лечении болезней детей и взрослых
Как показывают результаты исследований последних лет, полиненасыщенные жирные кислоты (ПНЖК) являются важным эссенциальным фактором питания в связи с их участием в формировании мембран клеток головного мозга, зрительного анализатора и биологических мембран других органов и тканей [1]. Напомним, что жирные кислоты (ЖК), являясь основным компонентом всех видов липидов, различаются по длине углеродной цепи (короткоцепочечные, среднецепочечные, длинноцепочечные), по наличию двойных связей (насыщенные, мононенасыщенные и ПНЖК: ди-, три-, тетра-, пента- и гексаеновые) (табл. 1).
В зависимости от расположения первой двойной связи у 3, 6, 7 или 9-го атома углерода относительно метильного конца молекулы ПНЖК делятся на семейства ω-3, ω-6, ω-7 и ω-9 соответственно [2].
Синтез насыщенных ЖК происходит в клетках печени, стенки кишечника, легочной и жировой ткани, в тканях мозга, почек, лактирующей молочной железы путем последовательного удлинения углеродной цепи, а затем, под действием ферментов-десатураз, может идти образование моноеновых ЖК (например, олеиновой кислоты 18:1 семейства ω-9). Однако организм человека не способен синтезировать линолевую (18:2 семейства ω-6) и a-линоленовую (18:3 семейства ω-3) кислоты, которые являются вследствие этого незаменимыми для человека и должны поступать с пищей [2]. Основные источники ПНЖК приведены в таблице 2, из которой видно, что источниками ПНЖК семейства ω-6 являются преимущественно различные растительные масла, тогда как ПНЖК ω-3 в больших количествах встречаются в рыбе, морепродуктах, яичном желтке [3, 4].
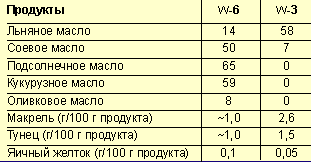
|
| Таблица 2. Основные источники незаменимых ПНЖК (% от общего содержания жира) |
Однако, попадая в организм, незаменимые ЖК способны метаболизироваться с помощью процессов десатурации и элонгации в более длинноцепочечные и ненасыщенные производные. Все ПНЖК — производные линолевой кислоты относят к семейству ω-6, а производные a-линоленовой кислоты — к семейству ω-3. Процессы десатурации и элонгации идут с участием соответствующих ферментов — десатураз и элонгаз, общих для представителей различных семейств ЖК, вследствие чего они конкурируют за указанные ферменты, а соотношение в диете и организме ЖК разных семейств определяет преимущественное образование производных того или иного семейства. Это обстоятельство является важным, поскольку оказывает влияние на проявление присущей ПНЖК регуляторной функции, которая связана с образованием из ЖК с 20 углеродными атомами (эйкозановых) биологически активных веществ — эйкозаноидов [5]. Синтез эйкозаноидов из ПНЖК может идти по двум основным путям — циклооксигеназному и липоксигеназному (рис. 1).
Под действием фермента циклооксигеназы образуются простаноиды (простагландины, простациклины и тромбоксаны), а ферментов липоксигеназ — лейкотриены, гидроксиэйкозатетроеноаты и липоксины. Как видно из рисунка 2, предшественниками эйкозаноидов являются дигомо-α-линоленовая кислота (С20:3 ω-6), арахидоновая (АК) (С20:4 ω-6) и эйкозапентаеновая (С20:5 ω-3) кислоты (ЭПК). Из первой образуются простаноиды 1-й серии, из АК — простаноиды 2-й серии и лейкотриены 4-й серии; ЭПК метаболизируется в простаноиды 3-й серии и лейкотриены 5-й серии. ЖК разных классов конкурируют и за ферменты, участвующие в синтезе эйкозаноидов. Способность различных ЖК образовывать различные классы эйкозаноидов, в свою очередь оказывающих множественные физиологические воздействия на организм взрослых и детей, предопределяет возможность активного влияния ПНЖК-рационов на многие физиологические функции в организме, или иначе регуляторные функции ПНЖК [2, 7].
Интересно, что простаноиды и лейкотриены разных серий, образованные из разных предшественников, выполняют сходные биологические функции, однако интенсивность их действия существенно отличается. В ряде случаев простаноиды и лейкотриены разных серий оказывают прямо противоположное воздействие на клетки-мишени [5]. Кроме того, образование эйкозаноидов, до некоторой степени, — тканеспецифичный процесс. Так, простациклин образуется клетками сосудистого эндотелия, тромбоксаны — тромбоцитами; простагландины вызывают сокращение гладкой мускулатуры, стимулируют или ингибируют адгезию тромбоцитов и вызывают сокращение или расслабление стенок артерий и тем самым влияют на кровяное давление. Тромбоксаны вызывают агрегацию тромбоцитов, увеличивают свертываемость крови, повышают кровяное давление, вызывая сокращение стенок артерий. Лейкотриены вызывают сокращение гладкой мускулатуры бронхов, кишечника и сосудов, стимулируют или подавляют образование в печени положительных реактантов острой фазы воспаления. Некоторые эйкозаноиды действуют как хемотаксические агенты, стимулируя или подавляя активность отдельных звеньев иммунной системы [2].
Эйкозаноиды играют важную роль в развитии неспецифической системной воспалительной реакции.
Под действием инфекционных агентов или других триггеров воспаления активируется фермент фосфолипаза А2, отщепляющая от мембранных фосфолипидов АК либо ЭПК, или при их отсутствии эйкозатриеновую кислоту (20:3 ω-9), из которых под действием циклооксигеназы и липоксигеназы образуются простаноиды и лейкотриены соответствующих серий. Под действием простагландинов и лейкотриенов активируются клетки иммунной системы — участники воспаления: макрофаги, нейтрофилы, Т- и В-лимфоциты. Наиболее сильным провоспалительным действием обладают простагландин Е2 и лейкотриен В4. Активированные клетки вырабатывают цитокины и другие регуляторные соединения, приводящие к развитию системной реакции воспаления. Эффекты эйкозаноидов относятся не только к воспалительной реакции, но затрагивают и многие другие физиологические функции, причем действие эйкозаноидов различных серий существенно различается. Так, тромбоксан А2 обладает сильным вазоконстрикторным и агрегирующим действием на тромбоциты, в то время как тромбоксан А3, образующийся из ЭПК семейства ω-3, действует значительно слабее по сравнению с метаболитом семейства ω-6.
В то же время простациклины I2 (PGI2) и I3 (PGI3) обладают примерно одинаковым вазодилатирующим эффектом, в итоге диета, богатая ПНЖК ω-3, изменяя баланс между эйкозаноидами различных классов в сторону повышенного образования ТХА3 и PGI3, оказывает вазодилатирующее и антитромботическое действие. Кроме того, подавление продукции лейкотриена В4 при использовании такой диеты ведет к уменьшению выработки фактора агрегации тромбоцитов, фактора некроза опухоли и интерлейкина–1β под действием простагландина Е3.
Приведенные данные о способности ПНЖК ω-3 выступать в качестве предшественников различных классов физиологически активных эйкозаноидов лежат в основе использования ПНЖК ω-3 в профилактике и комплексной терапии целого ряда заболеваний у детей и взрослых. Первые публикации о связи между высоким уровнем потребления жирных сортов рыбы, богатой ПНЖК ω-3, и более низким уровнем триглицеридов в крови у эскимосов по сравнению с датчанами появились более 30 лет назад в результате эпидемиологических исследований Bang and Dyerberg, 1972, 1976. В 1989 г. в исследовании DART (Burr и соавторы) было показано, что относительно низкие дозы ПНЖК ω-3 снижают риск рецидива сердечно-сосудистых заболеваний.
В 1996 г. в обзоре Harris были проанализированы уже 72 плацебо-контролируемых исследования, в которых использовалась комбинация ЭПК и докозагексаеновой кислоты (ДГК) в количестве от 1 до 7 г в день в течение как минимум 2 нед. Гиполипидемический эффект был продемонстрирован у 25% пациентов с нормальным уровнем липидов в крови и у 28% пациентов с гиперлипидемией. В настоящее время ПНЖК ω-3 используются в профилактике и комплексной терапии следующих патологических состояний:
- дислипопротеинемия, гипертоническая болезнь;
- сахарный диабет;
- системные заболевания соединительной ткани (системная красная волчанка, ювенильный ревматоидный артрит);
- атопический дерматит, бронхиальная астма;
- язвенная болезнь, неспецифический язвенный колит, болезнь Крона;
- гломерулонефрит, хроническая почечная недостаточность;
- синдром гиперактивности и гипервозбудимости.
Терапевтический эффект ПНЖК обусловлен их способностью оказывать следующие воздействия:
- гипохолестеринемическое, и в том числе с повышением уровня липопротеинов высокой плотности (ЛПВП);
- гипотриглицеридемическое;
- антиатерогенное;
- гипотензивное;
- тромболитическое;
- противовоспалительное.
Кроме того, ПНЖК ω-3 оказывают влияние на процессы ишемии-реперфузии, продукцию аденозинтрифосфата и функционирование ионных каналов, т. е. затрагивают все основные патогенетические звенья развития сердечно-сосудистых заболеваний (ССЗ).
Возможным объяснением повышения уровня ЛПВП под влиянием ПНЖК ω-3 считают снижение под действием ПНЖК образования крупных липопротеинов очень низкой плотности (ЛПОНП) и увеличение менее атерогенных мелких липопротеинов, которые быстрее переходят в ЛПНП, а также повышение экскреции стеролов и желчных кислот с калом.
Предполагают также, что ПНЖК модифицируют ЛПВП, влияя на текучесть их липидов и на движение холестерина внутрь этих частиц, в результате чего облегчается удаление холестерина из клетки и реализуется антиатерогенный эффект.
Возможными механизмами гипотриглицеридемического действия могут быть снижение (более чем на 50%) синтеза хиломикронов в кишечнике, облегчение контакта ненасыщенных хиломикронов с липопротеинлипазой, снижение синтеза триглицеридов в печени [8–10]. Установлено также, что ПНЖК ω-3 связываются с факторами транскрипции генов PPAR (peroxisome proliferato-activated receptor), активирующего окисление ЖК, и SREBP (sterol regulatory element binding protein), регулирующего пути синтеза триглицеридов, активируя их, снижая синтез и усиливая катаболизм ЖК. В результате снижается синтез триглицеридов и выход ЛПОНП из печени в кровоток.
Все это обусловливает широко известную положительную роль ПНЖК в профилактике и лечении ССЗ, за счет их гипохолестеринемического, гипотриглицеридемического, антиатерогенного и тромболитического действия [11, 12]. Так, например, при исследовании 1000 жителей Индии с высоким риском ишемической болезни сердца, в ходе которого участники, выбранные случайным путем, получали средиземноморскую диету, богатую цельнозерновыми продуктами, фруктами, овощами, грецкими орехами, миндалем, либо традиционную диету, в группе со средиземноморской диетой дневное потребление α-линоленовой кислоты было в 2 раза больше, чем в группе контроля. За 2 последующих года у лиц, получавших средиземноморскую диету, было зарегистрировано меньше ССЗ (39 против 76, р < 0,001), случаев внезапной смерти от ССЗ (6 против 16, р = 0,015) и инфаркта миокарда (21 против 43, р < 0,001) [13].
В другом исследовании диету, обогащенную пищевыми источниками ПНЖК ω-3, соблюдали 4738 лиц 65 лет и старше, исходно не страдавших застойной сердечной недостаточностью (ЗСН). За 12 лет наблюдения были зарегистрированы 955 случаев ЗСН. При этом чем больше был прием в пищу жира морских рыб, тем меньше риск ЗСН (р = 0,009). Так, по сравнению с участниками исследования, потреблявшими рыбу реже 1 раза в месяц, те, кто ел вареную или запеченную рыбу 1–2 раза в неделю, имели на 20% ниже риск ЗСН. Потребление рыбы 3–4 раза в неделю снижало риск развития ЗСН на 31%[14].
Большинство подобных исследований проводилось с участием взрослых пациентов. Однако гипохолестеринемическое и гипотриглицеридемическое свойства ПНЖК используются также в лечении нефротического синдрома у детей. Так, обогащение рациона 7 детей в возрасте от 10 до 16 лет со стероидрезистентным нефротическим синдромом и гиперлипидемией рыбьим жиром (в дозе от 3 до 4,5 г/сут с содержанием ЭПК не менее 16% и ДГК не менее 11%) в течение месяца выявило значительное снижение уровня холестерина (p < 0,05), триглицеридов (p < 0,05) и холестерина ЛПНП (p < 0,05) в крови этих детей в сравнении с 9 детьми с таким же диагнозом, не получавшими рыбий жир (контрольная группа). Снижался также уровень общих липидов и холестерина ЛПОНП; повысился уровень холестерина ЛПВП, однако эти изменения не достигали статистической значимости. При этом в контрольной группе показатели практически не изменились [15]. В другой работе было показано, что включение в рацион детей с хронической почечной недостаточностью ПНЖК из расчета 3–7 г в день в течение 2 мес ведет к снижению уровня тромбоксана В2 (с 490 ± 70 нг/мл до 342 ± 147 нг/мл, p < 0,05) и триглицеридов в сыворотке крови (с 236 ± 60 до 170 ± 43, p < 0,01) и увеличению времени кровотечения (с 5,8 ± 0,4 мин до 7,7 ± 0,4, p < 0,01) [16].
В связи с тем, что ПНЖК ω-3 увеличивают текучесть клеточных мембран, повышая тем самым чувствительность тканей к инсулину, и являются субстратом для выработки простагландинов, способствующих увеличению числа инсулиновых рецепторов, их используют в профилактике и лечении сахарного диабета как 1, так и 2 типов [17–19]. Доказано, что потребление продуктов, богатых ПНЖК ω-3 (в частности, печени трески), на первом году жизни значительно снижает риск возникновения заболевания (относительный риск 0,74). Эти данные были получены на основании исследования 545 детей, страдающих сахарным диабетом 1 типа, 1668 здоровых детей составили группу контроля [17].
Противовоспалительный эффект ПНЖК ω-3, обусловленный снижением продукции провоспалительных эйкозаноидов (простагландина Е2, лейкотриена В4) из АК, увеличением продукции противовоспалительных эйкозаноидов (простагландина Е3, лейкотриена В5), уменьшением (за счет подавления синтеза лейкотриена В4) выработки фактора агрегации тромбоцитов, интерлейкина-1 и фактора некроза опухоли, позволяет применять ПНЖК ω-3 при лечении и профилактике различных воспалительных заболеваний с аутоиммунным и/или аллергическим компонентом патогенеза, таких, как ревматоидный артрит, системная красная волчанка, болезнь Крона и язвенный колит, бронхиальная астма и атопический дерматит. Например, при проведении сравнительного исследования эффективности малых доз ЭПК и ДКГ (27 мг/кг и 18 мг/кг соответственно) у 20 больных ревматоидным артритом и более высоких доз (54 мг/кг и 36 мг/кг) у 17 больных было отмечено выраженное снижение, по сравнению с 12 больными контрольной группы, которые получали капсулы оливкового масла, содержащие 6,8 г олеиновой кислоты, количества пациентов, отмечавших болезненность в суставах (на малой дозе — к 24-й неделе и на более высокой — к 18-й неделе (р = 0,04)); продукция лейкотриена В4 в нейтрофилах снизилась на 19% на малой дозе и на 20% на более высокой дозе (р = 0,03), тогда как выработка интерлейкина-1b макрофагами в контрольной группе уменьшилась на 38,5% (статистически недостоверно), при назначении ПНЖК ω-3 в малых дозах на 40,6% (р = 0,06) и при назначении более высоких доз ПНЖК ω-3 на 54,7% (р = 0,0005) [20]. В ходе повторного испытания была предпринята попытка отмены нестероидных противовоспалительных средств (НПВС) на фоне приема рыбьего жира и оливкового масла. В основной группе через 8 нед после отмены диклофенака у больных не отмечалось ухудшения течения болезни по сравнению с контрольной группой, получавшей НПВС [21].
В другой работе проводилось исследование диеты, обогащенной ПНЖК ω-3, у 23 детей с ювенильным ревматоидным артритом, которых случайным способом разделили на две группы. Основная группа (13 человек, средний возраст 11 лет) получала терапию НПВС и соблюдала диету с повышенным содержанием ПНЖК ω-3, контрольная группа (10 человек, средний возраст 9,1 лет) получала обычную терапию. Через 5 мес приема ПНЖК ω-3 в основной группе удалось снизить дозу НПВС на 17,3% (в среднем, с 28,4 мг ибупрофена кг/сут до 23,4 мг/кг/сут), тогда как в контрольной только на 6,5% (с 23,7 до 22,7мг/кг/сут) (р = 0,03) [22].
При проведении двойного слепого плацебо-контролируемого исследования у 14 больных системной красной волчанкой из 17, получавших ЭПК по 20 г в день в течение 8 мес, была диагностирована ремиссия, тогда как у 13 больных контрольной группы состояние оставалось без изменений [23].
Учитывая высокое содержание ДГК в органах центральной нервной системы, ее участие в процессах миелинизации и передачи нервного импульса, предпринимаются попытки использовать ПНЖК в лечении больных с биполярными расстройствами психики. Так у 64,3% пациентов, принявших участие в двойном слепом плацебо-контролируемом исследовании эффективности биологически активной добавки с ПНЖК ω-3, отмечалось выраженное улучшение в ответе на стандартную терапию, против 18,8% пациентов в контрольной группе (p = 0,02) [24]. При шизофрении обнаружилась достоверная связь между уровнем ПНЖК ω-3 в питании и выраженностью симптомов [25]. В ходе рандомизированного, двойного слепого исследования синдрома гипервозбудимости в сочетании со сниженным вниманием у детей было показано, что увеличение, под влиянием биологически активной добавки с ПНЖК ω-3, содержание этих кислот в сыворотке крови достоверно коррелирует с уменьшением симптомов гипервозбудимости [26].
Учитывая результаты этих и других исследований, департамент по питанию и пище при Национальной академии наук США рекомендует следующие нормы потребления ПНЖК ω-3 в профилактических целях (табл. 3).
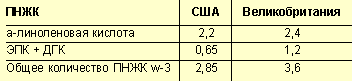
|
| Таблица 3. Рекомендуемые нормы потребления ПНЖК ω-3, г в день |
При этом с пищей не должно поступать жиров более 30% от общего количества калорий. Исходя из этого, рекомендуется, чтобы с ПНЖК поступало менее 8% калорий, с соотношением ω-6/ω-3 в пределах 5:1–3:1. Необходимо также помнить, что из-за участия ПНЖК в процессах перекисного окисления липидов их желательно принимать одновременно с антиоксидантами (токоферол и др.).
Учитывая, что пищевые источники ПНЖК ω-3 довольно ограничены и соотношение ПНЖК ω-6/ω-3 в рационе современного человека далеко от оптимального, в настоящее время разработаны и присутствуют на рынке в большом количестве биологически активные добавки к пище, обогащающие рацион ПНЖК. Перечислим некоторые из них, содержащие ПНЖК ω-3.
Полиен, содержит не менее 25% ПНЖК ω-3, выпускается в жидком виде и в виде капсул, производится из жира морских рыб. Выпускаются также капсулы с добавками витаминов Е и А, боярышником, льняным маслом и т. д. Эйконол, содержит преимущественно ЭПК и ДГК, не менее 25% ПНЖК ω-3, выпускается в виде капсул, производится из жира морских рыб.- Эйколен, является источником α-линоленовой кислоты, ЭПК и ДГК, 18% ПНЖК ω-3, выпускается в виде капсул, содержит рыбий жир и льняное масло.
- Льняное масло, выпускается в жидком виде, источник α-линоленовой кислоты, β- и γ-токоферолов.
- Эйфитол, капсулы, на основе рыбьего жира и порошка чеснока, источник ЭПК, ДГК и аллицина, 15% ПНЖК ω-3.
- Тыквейнол, капсулы, на основе рыбьего жира и масла из семечек тыквы, источник a-линолевой кислоты, ЭПК и ДКГ.
- Посейдонол, капсулы, на основе рыбьего жира, облепихового, кедрового, льняного масел, источник линолевой, α-линоленовой кислот, ЭПК и ДГК.
- Масло вечерней примулы, в виде капсул, источник γ-линоленовой кислоты.
Литература
- Koletzko B., Agostoni C., Carlsson S. et al. Long chain polyunsaturated fatty acid (LC-PUFA) and perinatal development//Acta. Paediatr. Scand. 2001; 90: 460–465.
- Биохимия/под ред. Е. С. Северина. М.: Гэотар-Мед, 2004. С. 417–426.
- Левачев М. М. Значение жира в питании здорового и больного человека: справочник по диетологии/под ред. В. А. Тутельяна, М. А. Самсонова. М.: Медицина, 2002. С. 25–32.
- Norum K. R. Dietary fat and blood lipids//Nutr. Rev. 1992; 50: 4: 2: 30–37.
- Сalder P. C. Fatty acids metabolism and eicosanoid synthesis//Clinical. Nutrition. 2001; 20: 4: 1–5.
- Woltil H. A. Early nutrition of low birthwheigt infants. LC PUFA metabolism, growth and development/ Van Denderen B.V., Groningen. 1997; 159.
- Goetzl E. J., Lewis R. A. Сellular generation, transport, and effects of eicosanoids. Biological role and Pharmacological intervention. Ed.//Ann. of NY Academy. of Sciences. V. 744. New York. 1994; 340.
- Погожева А. В. Сердечно-сосудистые заболевания, диета и ПНЖК ω-3. М., 2000. 320 с.
- Norum K. R. Dietary fat and blood lipids//Nutr. Rev. 1992; 50: 4: 2: 30-37. Review. No abstract available.
- Coniglio J. G. How does fish oil lower plasma triglycerides?//Nutr. Rev. 1992; 50: 7: 195–197.
- Kromhout D. Diet and cardiovascular diseases//J. Nutr. Health. Aging. 2001; 5(3): 144–149.
- Djousse L., Folsom A. R., Province M. A., Hunt S. C., Ellison R. C. National Heart, Lung, and Blood Institute Family Heart Study. Dietary linolenic acid and carotid atherosclerosis: the National Heart, Lung, and Blood Institute Family Heart Study//Am. J. Clin. Nutr. 2003; 77 (4): 819–825.
- Singh R. B., Dubnov G., Niaz M. A. et al. Effect of an Indo-Mediterranean diet on progression of coronary artery disease in high risk patients (Indo-Mediterranean Diet Heart Study): a randomised single-blind trial//Lancet. 2002; 360: 1455–1461.
- Mozaffarian D., Bryson C. L., Lemaitre R. N., Burke G. L. et al. Fish intake and risk of incident heart failure//J. Am. Coll. Cardiol. 2005; 45: 2015–2021.
- Вознесенская Т. C., Кутафина Е. К. и др. Влияние ω-3 полиненасыщенных жирных кислот на показатели липидного обмена у детей с нефротическим синдромом//Вопросы детской диетологии. 2003. Т. 1. № 2. С. 90–93.
- De Caterina R., Capriori R., Giannessi D. n-3 fatty acids reduce proteinuria in patients with chronic glomerular disease// Kidney. Int. 1993; 44(4): 843–850.
- Stene L. C. Joner G. Norwegian Childhood Diabetes Study Group. Use of cod liver oil during the first year of life is associated with lower risk of childhood-onset type 1 diabetes: a large, population-based, case-control study//Am. J. Clin. Nutr. 2003; 78 (6): 1128–1134.
- Rodriges Y., Christophe A. B. Long-chain ω-6 polyunsaturated fatty acids in erythrocyte phospholipids are associated with insulin resistance in non-obese type 2 diabetics//Clin. Chim. Acta. 2005; 3541–3542: 195–199. Epub 2005, Jan 11.
- Decsi T., Szabo E., Kozari A., Erhardt E., Marosvolgyi T., Solvesz G. Polyunsaturated fatty acids in plasma lipids of diabetic children during and after diabetic ketoacidosis//Acta Paediatr. 2005; 94 (7): 850–855.
- Kremer J. M., Lawrence D. A., Jubiz W., DiGiacomo R., Rynes R., Bartholomew L. E., Sherman M. Dietary fish oil and olive oil supplementation in patients with rheumatoid arthritis. Clinical and immunologic effects//Arthritis. Rheum. 1990; 33 (6): 810–820.
- Kremer J. M., Lawrence D. A., Petrillo G. F., Litts L. L., Mullaly P. M., Rynes R. I., Stocker R. P., Parhami N., Greenstein N. S., Fuchs B. R. et al. Effects of high-dose fish oil on rheumatoid arthritis after stopping nonsteroidal antiinflammatory drugs. Clinical and immune correlates//Arthritis. Rheum. 1995; 38(8): 1107–1114.
- Vargova V. et al. Will administration of ω-3 — unsaturated fatty acids reduce the use of nonsteroidal antirheumatic agents in children with chronic juvenile arthritis?//Cas. Lek. Cesk. 1998; 21: 651–653.
- MacLean C. H., Mojica W. A., Morton S. C., Pencharz J., Hasenfeld Garland R., Tu W., Newberry S. J., Jungvig L. K., Grossman J., Khanna P., Rhodes S., Shekelle P. Effects of ω-3 fatty acids on lipids and glycemic control in type II diabetes and the metabolic syndrome and on inflammatory bowel disease, rheumatoid arthritis, renal disease, systemic lupus erythematosus, and osteoporosis//Evid. Rep. Technol. Assess. (Summ). 2004; 89: 1–4.
- Stoll A. L., Locke C. A., Marangell L. B., Severus W. E. Omega-3 fatty acids and bipolar disorder: a review//Prostaglandins. Leukot. Essent. Fatty. Acids. 1999; 60: 329–337.
- Peet M., Laugharne J. D. E., Mellor J., Ramchand C. N. Essential fatty acid deficiency in erythrocyte membranes from chronic schizophrenic patients, and the clinical effects of dietary supplementation//Prostaglandins. Leukot. Essent. Fatty. Acids. 1996; 55: 71–75.
- Burgess J. R. Attention deficit hyperactivity disorder: observational and interventional studies. Paper presented at: NIH workshop on ω-3 essential fatty acids and psychiatric disorders; September 2–3, 1998; Bethesda, Md.
И. Я. Конь, доктор медицинских наук, профессор
Н. М. Шилина, кандидат биологических наук
С. Б. Вольфсон
НИИ питания, Москва
Врезки:
