Оптимизация комплексной терапии заболеваний внутренних органов с использованием кеторола
Большинство заболеваний внутренних органов как воспалительной, так и невоспалительной природы сопровождается болевым синдромом различной интенсивности, являющимся зачастую основной причиной обращения пациента к врачу и последующей госпитализации. При анализе всех случаев обращений к специалистам терапевтического профиля, проведенном зарубежными авторами, было выявлено, что 15% пациентов испытывали острую боль различной локализации [7].
Международная ассоциация по изучению боли определяет ее как неприятное сенсорное и эмоциональное состояние, обусловленное действительным или возможным повреждающим воздействием на ткани. Неприятные ощущения становятся причиной специфического поведения больного (это позволяет врачу заключить, что пациент испытывает боль) и появлению вегетативных реакций. Страдания больного, в зависимости от длительности болевого ощущения, имеют разную клиническую характеристику.
В настоящее время существует несколько классификаций боли. В зависимости от основного механизма выделяют патогенетическую классификацию, включающую три основных типа болевых синдромов: соматогенные (ноцицептивные), нейропатические, психогенные.
Соматогенная (ноцицептивная) боль появляется в результате стимуляции нервных окончаний, называемых ноцицепторами, в коже и глубоких тканях, которые чувствительны к повреждающим стимулам. Данный тип боли включает поверхностную и глубокую соматическую, а также висцеральную — в соответствии с источником болевых стимулов. В этом участвуют два основных механизма:
- повышение чувствительности периферических ноцицепторов в результате воздействия медиаторов, высвобождаемых вследствие повреждения тканей;
- изменения внутри самого спинного мозга, вызывающие повышение чувствительности ноцицептивных нейронов задних рогов.
Среди висцеральных ноцицепторов выделяют высокопороговые механорецепторы, активизирующиеся при чрезмерном сокращении и спазмировании полых органов и формирующие острую боль. Этот тип рецепторов распространен в сердце, пищеводе, бронхах, желчевыводящих путях, тонкой и толстой кишке, мочеточниках, мочевом пузыре и матке. Рецепторы второго типа, именуемые ноцицепторами интенсивности, реагируют на слабые механические стимулы, в том числе растяжение тканей полых органов. Такие рецепторы обнаружены в сердце, пищеводе, толстой кишке и мочевом пузыре. «Молчащие» ноцицепторы возбуждаются только в условиях повреждающего стимула, связанного с воспалением, ишемией, некрозом ткани внутренних органов, что обусловливает длительную диффузную боль [4].
К периферическим медиаторам боли относятся специфические вещества — алгогены, которые при повреждении ткани концентрируются в зоне болевых рецепторов и осуществляют инициацию проведения болевой реакции. Среди медиаторов различают тканевые алгогены, которые выделяются во внеклеточную среду при повреждении макрофагов, тромбоцитов, тучных и эндотелиальных клеток. Соответственно они представлены интерлейкинами, гистамином, эндотелинами, простагландинами, аденозинтрифосфорной кислотой (АТФ), молочной кислотой и др. Среди алгогенов, циркулирующих в крови, известны брадикинин и каллидин. На уровне нервной системы медиаторами боли выступают нейротрансмиттеры — серотонин, γ-аминомасляная кислота (ГАМК), оксид азота, вазоинтестинальный пептид.
Ноцицепторы передают возбуждение по двум типам ноцицептивных волокон. Толстые Аb-миелинизированные волокна, которые расположены в коже и мышцах, проводят импульс с высокой скоростью, обеспечивая острую, четко локализованную соматическую боль, стихающую сразу после прекращения действия стимула. Такая боль называется эпикритической. Тонкие С-немиелинизированные волокна проводят импульс с низкой скоростью, что сопровождается появлением отсроченной тупой, диффузной длительной боли, которая называется протопатической. С-волокна иннервируют мышцы, надкостницу, брыжейку, брюшину и внутренние органы. В большинстве случаев висцеральная боль проводится именно волокнами этого типа и потому воспринимается как продолжительная, тупая, жгучая, плохо локализованная. Периферические окончания С-афферентных волокон секретируют специфические алгогены — субстанцию Р, нейрокинин А и кальцитонин-ген-родственный пептид. В ответ на болевое раздражение в организме включаются эндогенные анальгетические системы, одной из которых является нисходящий антиноцицептивный путь, по которому из центральной нервной системы (ЦНС) к задним рогам спинного мозга передаются импульсы, снижающие интенсивность восприятия боли. Нейротрансмиттерами подавления боли служат серотонин, норадреналин, эндогенные опиоидные пептиды.
Висцеральная боль возникает при возбуждении ноцицепторов вегетативной нервной системы и передается по спинномозговым афферентным путям. Первый нейрон, реагирующий на болевые раздражения, находится в спинальных ганглиях. Аксоны этих клеток входят в спинной мозг в составе задних корешков и заканчиваются в сером веществе на нейронах задних рогов. Сюда поступает информация и от неноцицептивных нервных волокон, что обеспечивает двойную иннервацию внутренних органов и лежит в основе феномена иррадиации боли. Нейроны второго порядка далее в составе спиноретикулярного и спиноталамического тракта достигают ретикулярной формации и моста зрительного бугра головного мозга. Нейроны третьего порядка из ретикулярной формации передают возбуждение в лимбическую систему, в передние отделы коры головного мозга, где осуществляется анализ ощущения боли.
Возникновение боли при патологических процессах во внутренних органах сопровождается активацией висцеро-висцеральных, висцеро-соматических и висцеро-сенсорных рефлексов. При висцеро-висцеральном рефлексе возбуждение возникает и заканчивается во внутренних органах, причем эффектор способен отвечать усилением либо торможением функции, например изменениями интенсивности дыхания, уровня кровяного давления, частоты сердечных сокращений. При висцеро-соматическом рефлексе возбуждение в дополнение к висцеральному вызывает также соматические ответы в виде, например, защитного напряжения мышц брюшной стенки при некоторых патологических процессах в органах брюшной полости. При висцеро-сенсорном рефлексе в ответ на раздражение вегетативных афферентных волокон возникают реакции во внутренних органах, соматической мышечной системе, а также изменения соматической чувствительности. Висцеро-соматические и висцеро-сенсорные рефлексы имеют диагностическое значение при некоторых заболеваниях внутренних органов, при которых повышается тактильная и болевая чувствительность и появляются боли в определенных ограниченных участках кожи.
Таким образом, клинически висцеральную боль отличает диффузный характер, отсутствие четкой локализации, наличие вегетативных реакций.
Часто боль, которую ощущает пациент, не совпадает с местом повреждения. В таком случае можно говорить об отраженной боли. В основе этого феномена лежит конвергенция висцеральных афферентных волокон на уровне нейронов второго порядка спинного мозга с соматическими афферентными волокнами, иннервирующими определенные анатомические зоны на одном уровне спинального сегмента. Отраженные боли, возникающие от повреждающих висцеральных стимулов, превосходят их по интенсивности и доминируют в клинической картине заболевания.
Развитие нейропатической боли связано с повреждением структур периферической или ЦНС, участвующих в проведении ноцицептивных сигналов. В таблице отражена классификация боли с учетом патогенетических механизмов, локализации и клинических проявлений [2].
Психогенные боли возникают вне зависимости от соматических, висцеральных или нейрональных повреждений и в большей степени определяются психическими и социальными факторами.
В клинике внутренних болезней устранение боли является неотъемлемым компонентом комплексной терапии большинства заболеваний. Ведущая роль в облегчении боли отводится нестероидным противовоспалительным препаратам (НПВП). Обезболивающее и противовоспалительное действие НПВП связано с ингибированием циклооксигеназы (ЦОГ) и тормозящим действием на синтез простагландинов и эйкозаноидов, являющихся основными медиаторами, определяющими возникновение, динамику и исходы болевых и воспалительных синдромов.
Основными показаниями для назначения НПВП являются: артриты; боль в спине; легкая или умеренная боль при воспалении или повреждении тканей; метастатические боли в костях; печеночная или почечная колика; лихорадка при неопластических процессах; послеоперационная боль; головная боль; дисменорея.
Одним из современных НПВП является кеторол — производное арилуксусной кислоты, неселективный ингибитор ЦОГ. Его основная клиническая ценность связана с мощным анальгезирующим действием препарата, по степени которого он превосходит другие НПВП. Препарат быстро всасывается, обладает высокой биодоступностью (80–100%). Кеторол связывается с белками плазмы на 90–99%, подвергается печеночному метаболизму, выводится почками (90%) и кишечником (6%). Продолжительность действия препарата — 6–10 ч. Выпускается в двух формах: таблетки для приема внутрь по 10 мг и раствор для парентерального введения в ампулах — 30 мг/1мл.
На кафедре факультетской терапии им. акад. А. И. Нестерова РГМУ проводилось исследование эффективности и безопасности препарата кеторол у пациентов с болевым синдромом различного происхождения в клинике внутренних болезней.
Целью исследования явилась оценка эффективности парентеральной и пероральной форм кеторола при последовательном назначении больным с умеренным и выраженным болевым синдромом (не менее 40 мм по ВАШ). В исследование были включены 20 пациентов в возрасте от 28 до 69 лет (средний возраст — 52,3 года ), из них 8 мужчин и 12 женщин, страдающих болевым синдромом различного происхождения, а именно: внебольничная плевропневмония — у 3 пациентов, сухой плеврит — у 1, обострение хронического некалькулезного холецистита — у 2 , дивертикулез толстого кишечника, обострение хронического дивертикулита — у 2, мочекаменная болезнь, острая почечная колика — у 2, острый илеофеморальный флеботромбоз — у 3, обострение хронического сальпингоофорита — у 2, туннельный синдром на уровне карпального канала — у 2 (посттравматический теносиновит — у 1, на фоне декомпенсации первичного гипотиреоза — у 1), кокцигогодиния — у 1, герпетическая инфекция (Herpes zoster) на фоне медикаментозной иммуносупрессии у пациента с ревматоидным артритом — у 1, на фоне онкопатологии — у 1 пациента.
Критериями включения в исследование были болевой синдром умеренной или выраженной интенсивности на фоне медикаментозной терапии основного заболевания в возрасте от 18 до 70 лет.
Критериями исключения из исследования были наличие обострения язвенной болезни в последние 6 мес, геморрагический синдром, прием других НПВП или анальгетиков.
Назначение кеторола проводилось на фоне базовой терапии основного заболевания и назначался он в виде внутримышечных инъекций в суточной дозе 60 мг (30 мг/1мл 2 раза в день в течение 2 дней), с последующим переходом на таблетированную форму в суточной дозе 20 мг (10 мг 2 раза в день в течение 3 дней).
Основными критериями эффективности были уменьшение выраженности или исчезновение болевого синдрома. Оценка интенсивности боли проводилась после первой парентеральной дозы препарата и по завершению лечебного курса. Эффективность и переносимость препарата оценивались на основании мнения пациента и врача. Дополнительно учитывали долю пациентов, ответивших на терапию (responders rate), критерием ответа было снижение по ВАШ от исходных значений на 25%.
Безопасность терапии оценивали по наличию побочных эффектов (А — отсутствие побочных эффектов; В — побочный эффект, не требующий отмены препарата; С — побочный эффект, требующий отмены препарата).
Выраженность болевого синдрома по ВАШ до лечения составила в среднем 72 мм, после лечения средние показатели по ВАШ составили 18,25 мм (рис.).
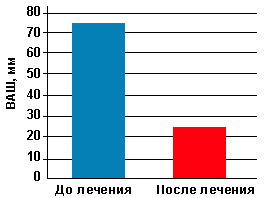
|
| Рисунок. Динамика показателей ВАШ в процессе лечения кеторолом |
Шести больным оказалось достаточным однократного введения кеторола (1 инъекция), двукратного введения — 5 пациентам (2 инъекции), у 9 пациентов с плевропневмонией, сухим плевритом, туннельным синдромом, герпетической инфекцией продолжительность использования кеторола составила 5 дней.
При оценке эффективности кеторола в лечении болевого синдрома различной локализации боль исчезла у 3 пациентов, значительно уменьшилась — у 12, уменьшилась — у 5.
Выраженный анальгетический и противовоспалительный эффект кеторола был продемонстрирован у пациентов с плевропневмониями, обострением хронического некалькулезного холецистита, мочекаменной болезнью. Отчетливая положительная динамика болевого синдрома и тенденция к быстрому разрешению симптомов заболевания были выявлены при использовании препарата кеторол в комплексной терапии плевропневмонии. Приведем конкретный пример.
Больная Н., 48 лет. Находилась на стационарном лечении в терапевтическом отделении с диагнозом: внебольничная левосторонняя плевропневмония, дыхательная недостаточность 2-й степени. Госпитализирована в клинику с жалобами на фебрильную лихорадку с ознобами, малопродуктивный кашель, выраженную слабость, боли умеренной интенсивности в левой половине грудной клетки, усиливающиеся при кашле, на высоте вдоха, при поворотах и наклонах тела в здоровую сторону. Медикаментозная терапия пневмонии включала назначение антибактериального препарата амоксиклав — 1000 мг 2 раза в сутки, муколитического средства амброксол — 30 мг 3 раза в сутки, с учетом выраженности болевого синдрома, обусловленного вовлечением в патологический процесс плевры, НПВП кеторол по следующей схеме: по 30 мг внутримышечно 2 раза в течение 2 дней, далее перорально по 10 мг 2 раза в течение 3 дней. На фоне проводимой терапии состояние больной улучшилось, температура тела снизилась до нормальных цифр, уменьшилась выраженность и интенсивность кашля, плевральная боль в грудной клетке регрессировала на 2-е сутки и полностью исчезла с 3-го дня лечения. Назначение НПВП признано оправданным как минимум с трех позиций: устранение висцеральной ноцицептивной боли, воздействие на развивающееся воспаление в плевре и жаропонижающее действие. Использование кеторола в комплексной терапии плевропневмонии позволило добиться регрессирования болевого синдрома в грудной клетке в короткие сроки, а более длительное его назначение имеет патогенетическое обоснование и направлено на уменьшение выраженности основных симптомов заболевания.
Отличная эффективность и переносимость препарата, согласно оценке пациента и врача, зарегистрирована у 6 больных и хорошая — у 13 больных. У одного больного с онкологической патологией был выявлен побочный эффект в виде тошноты на фоне внутримышечного введения кеторола, и пациент самостоятельно отменил препарат. У остальных 19 больных побочных эффектов не наблюдалось.
Итак, назначение кеторола у пациентов с различной патологией в клинике внутренних болезней позволило полностью купировать болевой синдром у 20% больных, значительно ослабить выраженность болевого синдрома — у 55%, уменьшить выраженность болевого синдрома — у 25%.
Полученные данные позволяют отнести препарат кеторол к числу эффективных и безопасных средств, применяемых в комплексной терапии заболеваний внутренних органов (таких, как плевропневмония, хронический некалькулезный холецистит, мочекаменная болезнь и др.), осложненных болевым синдромом.
По вопросам литературы обращайтесь в редакцию
Н. А. Шостак, доктор медицинских наук, профессор
А. В. Аксенова, Н. Г. Правдюк
РГМУ, Москва
Врезки:
