Применение пробиотического продукта для коррекции нарушений микрофлоры при острых кишечных инфекциях у детей
Острые кишечные инфекции (ОКИ) являются одной из наиболее распространенных причин формирования дисбиотических нарушений, особенно у детей. По данным разных авторов, нарушение нормальной микрофлоры кишечника регистрируется у 95–97% больных ОКИ [1, 2]. При этом сама количественно и качественно измененная микрофлора кишечника может становиться источником интоксикации и сенсибилизации, потенцирует патологические процессы в кишечнике, снижает темпы репаративных процессов. Она представляет собой одно из ключевых звеньев сложной цепи развития хронических инфекционно-воспалительных заболеваний желудочно-кишечного тракта, нарушения проницаемости кишечного барьера по отношению к инфекционным и неинфекционным агентам, способствует формированию пищевой аллергии [3]. Проведенные ранее исследования показали, что развивающийся при ОКИ дисбактериоз осложняет их течение, содействует хронизации процесса и формированию упорных диарей, а также снижает эффективность проводимой терапии [4].
В настоящее время выбор биологических препаратов для коррекции дисбиотических нарушений кишечника очень велик. В нашей стране наиболее популярны и хорошо изучены пробиотики, содержащие бифидобактерии (Bifidobacterium (B.) longum, B. breve, B. infantis, B. bifidum, B. adolescentis, B. animalis), лактобактерии (Lactobacillus (L.) rhamnosus, L. acidophilus, L. casei, L. bulgaricus, L. gasseri) и другие микроорганизмы (Lactococcus cremoris, Lactococcus lactis, Streptococcus thermophilus, Enterococcus faecium, Saccharomyces boulardi).
Одним из новых подходов к профилактике и коррекции дисбиотических нарушений является использование кисломолочных продуктов, обогащенных штаммами пробиотических бактерий, обладающих доказанным благотворным влиянием на организм человека. Однако к настоящему моменту имеются доказательства (по данным многоцентровых рандомизированных исследований) эффективности лишь некоторых пробиотических продуктов, в частности содержащих Lactobacillus casei Imunitass («Actimel», компания Данон), при ряде патологических состояний, сопровождающихся микробиологическими нарушениями различной выраженности, а именно: антибиотикоассоциированных диареях, ротавирусной инфекции, диареях путешественников, избыточном бактериальном обсеменении тонкой кишки. В ходе проведенных нами ранее исследований также были получены данные, свидетельствующие о благоприятном воздействии данного пробиотического продукта на здоровье детей и подтверждающие его клиническую эффективность в комплексной терапии ОКИ у детей [5, 6].
Достоинствами этой формы пробиотиков являются:
- возможность длительного применения, с учетом физиологического для человека количества пробиотических микроорганизмов;
- возможность восполнения физиологической потребности и в других биологически активных веществах.
Кроме того, в процессе ферментации продукта происходит снижение уровня лактозы, повышение концентрации лактата и свободных аминокислот, галактозы, жирных кислот, витаминов группы В.
В последние годы активно обсуждаются методологические аспекты определения состояния микрофлоры желудочно-кишечного тракта. Широкое распространение получают биохимические методы, например метод газожидкостной хроматографии (ГЖХ), позволяющий проводить детекцию микробных метаболитов, в частности короткоцепочечных жирных кислот (КЖК), именно резидентной пристеночной микрофлоры [7].
Для оценки эффективности пробиотического продукта, содержащего штамм Lactobacillus casei Imunitass, в коррекции микробиологических нарушений у детей с ОКИ, были обследованы 50 детей, больных ОКИ, в возрасте от 3 до 8 лет. В основную группу вошли 30 детей, которые на фоне традиционной терапии ОКИ, включавшей диету, пероральную регидратацию, энтеросорбенты, ферментные препараты, получали кисломолочный продукт «Actimel», содержащий пробиотический штамм Lactobacillus casei Imunitass в концентрации 1і108 КОЕ/г. Пациенты группы сравнения (20 детей) получали в комплексной терапии ОКИ кисломолочный продукт на основе йогуртовой закваски, не содержащий пробиотических микроорганизмов. Исследуемые продукты детям давали 1 раз в сутки, утром, во время завтрака, в объеме 100 мл, с первых дней заболевания и на протяжении 14 дней.
Пациенты были равномерно распределены по возрастным группам: в возрасте 3–5 лет — 22 (44%), 6–8 лет — 28 (56%) человек. Заболевание протекало в форме гастроэнтерита у 68% детей, энтерита — 30% и энтероколита — у 1 больного, имело гладкое течение с преобладанием легких форм (у 65%).
Для оценки влияния исследуемых продуктов питания на микробиоценоз кишечника были задействованы два способа — исследование микрофлоры толстой кишки по методике Р. В. Эпштейн–Литвак и Ф. Л. Вильшанской и изучение метаболической активности микрофлоры методом ГЖХ [8].
Клиническое наблюдение позволило выявить достоверные различия в отношении ряда симптомов заболевания, а именно более быстрое купирование симптомов интоксикации, анорексии и диареи среди детей, получавших продукт с Lactobacillus casei Imunitass (табл. 1).
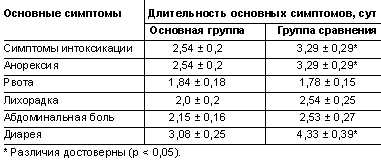
|
| Таблица 1. Продолжительность симптомов ОКИ |
Исследуя состояние микрофлоры кишечника (табл. 2), мы установили, что включение продукта «Actimel» в комплексную терапию ОКИ детей основной группы способствовало нормализации уровня лактобактерий у 30% больных и бифидобактерий — 13,3%, а также снижению уровней Staphylococcus spp. у 26,7%, грибов рода Candida у 13,3% больных. Также, у 30% больных основной группы отмечалась нормализация уровня Enterococcus spp. В группе сравнения к концу лечения уровень лактобактерий и бифидобактерий существенно не изменялся. Положительная динамика была выявлена лишь в отношении уровня энтерококков в кале.
При анализе структуры дисбиотических нарушений по степени их выраженности (в соответствии с отраслевым стандартом МЗ РФ) было установлено, что на фоне терапии ОКИ с использованием пробиотического продукта нормализация дисбиотических нарушений произошла у 40,1% детей основной группы. После 2 нед употребления данного продукта ни у одного ребенка не было выявлено дисбактериоза III степени, а число детей со II степенью заболевания уменьшилось в 4 раза. В то же время в группе сравнения нами не были выявлены значимые положительные изменения в структуре дисбактериозов: состояние эубиоза к концу лечения отмечалось только у 3 больных, дисбиотические нарушения II степени сохранялись у 1/3 пациентов, а I степени — у 9 (45%).
Методом ГЖХ-анализа было исследовано в динамике количественное и качественное содержание КЖК в кале 10 пациентов основной группы. Полученные результаты сравнивались с данными обследования 10 образцов от практически здоровых детей аналогичного возраста.
В остром периоде ОКИ у пациентов отмечаются значительные изменения профиля КЖК в кале (табл. 3). В общем пуле кислот с длиной атомов углерода С2–С4 было выявлено повышение абсолютного и относительного содержания пропионовой и масляной кислот при снижении абсолютного и относительного содержания уксусной кислоты, по сравнению с группой здоровых лиц, что свидетельствует о нарушении утилизации данных кислот колоноцитами вследствие выраженного диарейного синдрома, а также о повышении численности и активности анаэробного звена микрофлоры, представленного в основном популяциями микроорганизмов родов Bacteroides, Clostridium, Fusobacterium и др.
После курса лечения, проведенного с использованием пробиотического продукта «Actimel», отмечалась тенденция к нормализации абсолютного содержания уксусной, пропионовой и масляной кислот, а также достоверное повышение относительного содержания пропионовой и масляной кислот при снижении доли уксусной кислоты, что свидетельствует о восстановлении функциональной активности количественного соотношения и численности толстокишечной микрофлоры и утилизации КЖК на фоне купирования диарейного синдрома [9].
Представленные данные соотносятся с динамикой клинической симптоматики, характером консистенции стула.
При анализе значений анаэробных индексов (АИ) было установлено, что у пациентов основной группы исходно наблюдается смещение значений АИ в область более отрицательных значений по сравнению с нормой (–1,003 ± 0,011 ед при норме –0,599 ± 0,009 ед). В данной зоне перестают работать терминальные ферредоксинсодержащие ферменты облигатных анаэробов, что приводит к блокированию их жизнедеятельности, на фоне чего усиливается метаболическая активность условно-патогенных анаэробных микроорганизмов [9].
После проведенного лечения отмечалось смещение АИ в область нормальных значений (с –1,003 ед до –0,727 ед соответственно, D (дельта) АИ (лечение) составляет 0,276 ед), что создает условия для нормальной и эффективной жизнедеятельности облигатной микрофлоры.
Результаты изучения суммарного относительного содержания изокислот, отношения содержания отдельных изокислот к кислотам с неразветвленной цепью позволили сделать вывод о том, что на фоне проводимой терапии исходно повышенное суммарное относительное количество изокислот снижается. Данный факт объясняется снижением протеолитической активности некоторых видов факультативных анаэробов (Bacteroides fragilis, Bacteroides ruminicola, Bacteroides melaninogenicus), активно метаболизирующих при развитии острой диареи.
Анализ изменений соотношения продукции изокислоты/КЖК (SизоСn/SCn) свидетельствует об увеличении изучаемого показателя на фоне приема продукта «Actimel». Исходное снижение данного параметра у пациентов основной группы указывает на нарушение процесса протеолиза (ухудшение вязкостных характеристик слизи, увеличение ее количества в кишечном содержимом при острой диарее), а тенденция к возрастанию его на фоне лечения свидетельствует о восстановлении преэпителиального слоя защиты.
Не меньший интерес представляет изучение соотношения содержания изовалериановой кислоты к содержанию валериановой кислоты (изоС5/С5). Исходное увеличение данного параметра у пациентов основной группы может объясняться наличием кровопотери в кишечнике (диапедезное или другое кровотечение) и активизацией вследствие этого гемолизирующих микроорганизмов (гемолитические штаммы Escherichia coli, клостридии и др.). После лечения отмечается нормализация значений данного показателя, что соотносится с положительной клинической симптоматикой и отсутствием патологических примесей в кале.
Выводы
- Включение в комплексную терапию ОКИ у детей старше 3 лет с первых дней заболевания кисломолочного продукта «Actimel», содержащего пробиотический штамм Lactobacillus casei Imunitass, способствует улучшению состояния микробиоценоза толстого кишечника, выражающемуся в повышении и нормализации уровня лакто- и бифидобактерий, в снижении уровня и активности условно-патогенных анаэробов (в частности, протеолитических и гемолитических штаммов), нормализации баланса аэробно/анаэробных популяций микроорганизмов, что подтверждается изменением состава и спектра КЖК и результатами бактериологического исследования кала. Данные положительные изменения состава микрофлоры более выражены в сравнении с группой детей, получавших традиционный кисломолочный продукт, без пробиотической добавки.
- Динамика значений АИ у больных ОКИ позволяет сделать заключение, что «Actimel» представляет собой продукт, позитивно изменяющий внутриполостную среду толстой кишки, что обеспечивает условия для нормальной и эффективной жизнедеятельности облигатной микрофлоры.
- Включение продукта «Actimel» в комплексную терапию ОКИ способствует восстановлению преэпителиального слоя защиты, о чем свидетельствует изменение соотношения продукции изокислоты/КЖК.
По вопросам литературы обращайтесь в редакцию.
А. В. Горелов, доктор медицинских наук, профессор
Д. В. Усенко, кандидат медицинских наук
М. Д. Ардатская, доктор медицинских наук
ЦНИИ эпидемиологии Роспотребнадзора,
УНЦ МЦ УД Президента РФ, Москва
Врезки:
