Применение пребиотика при антибиотикотерапии больных с урогенитальным хламидиозом
Эпидемиологические исследования, проведенные в Российской Федерации и других экономически развитых странах, убедительно свидетельствуют о том, что хламидиоз продолжает оставаться в группе наиболее распространенных инфекций органов урогенитального тракта. Так, в Европе треть населения в течение жизни подвергается заражению.
В ФРГ ежегодно регистрируется около 1 млн, а в США — 4 млн инфицированных. В России хламидиоз — второе по распространенности заболевание после гриппа. Им страдает почти половина мужчин детородного возраста и треть женщин [1, 3].
Как и при других инфекционных заболеваниях, ведущим средством этиотропного лечения хламидиоза является антибиотикотерапия, причем довольно продолжительными курсами, с использованием препаратов, обладающих широким спектром действия [1, 3]. Это неизбежно приводит к развитию дисбаланса кишечной микрофлоры и формированию дисбиозов кишечника. Исследования, проведенные Ю. В. Лобзиным и соавторами в 2003 г. [3], подтвердили, что даже после первого в жизни лечения урогенитальных инфекций дисбактериоз кишечника формируется в 80,8±7,88 % случаев, а риск развития медикаментозной аллергии составляет 46,2±9,97%.
Представленные данные свидетельствуют о необходимости разработки адекватных способов минимизации потерь в качественном и количественном составе нормальной микрофлоры кишечника при длительной антимикробной терапии. Одним из направлений в решении этой задачи является использование так называемых немикробных стимуляторов роста нормальной кишечной микрофлоры или пребиотиков. Эти препараты могут применяться на любом этапе лечения, в том числе и в сочетании с антибиотиками. Они не имеют противопоказаний, за исключением индивидуальной непереносимости.
В данной работе остановимся на одной из составляющих этой обширной группы — олигосахаридах, в частности на лактулозе. Лактулоза (1,4-β-галактозид-фруктоза) была первым искусственно полученным соединением, внедренным в клиническую практику в качестве бифидогенного фактора. Это соединение относится к синтетическим дисахаридам, не всасывается в верхних отделах пищеварительного тракта (поскольку в тонком кишечнике отсутствуют ферменты, расщепляющие связь между молекулой фруктозы и галактозы), доходит в неизмененном состоянии до толстого кишечника, где под влиянием ферментов бифидобактерий, ацидофильных лактобактерий и в меньшей степени других анаэробных микроорганизмов ферментируется и служит источником энергии для этих бактерий. Бифидобактерии обладают набором из четырех ферментов, позволяющих им быстро и в полном объеме использовать лактулозу для своего роста и размножения. Условно-патогенные микроорганизмы, как и Escherichia (E.) coli, Clostridium spp., а также Salmonella spp., практически не могут метаболизировать лактулозу, и их рост конкурентно тормозится бифидобактериями [2, 3, 5].
Большой интерес представляют также неперевариваемые пищевые волокна, к которым относится лигнин. Механизм позитивного эффекта пищевых волокон на организм человека включает несколько моментов: сорбция токсических субстанций эндогенного и экзогенного происхождения, изменение скорости продвижения кишечного содержимого, создание дополнительной площади для фиксации «дружественных» для макроорганизма представителей микрофлоры [2, 5].
Целью настоящего исследования было продемонстрировать эффективность и целесообразность терапевтического применения лактофильтрума — комбинации пребиотического препарата лактулозы в комплексе с гидролизным лигнином и макролидных антибиотиков при лечении урогенитальной хламидийной инфекции.
В качестве средства этиотропной терапии использовался 14-членный полусинтетический антибиотик кларитромицин, который по спектру антимикробной активности по праву относится к наиболее результативным антибиотикам из группы макролидов. Кларитромицин наравне с азитромицином максимально активен против Chlamydia trachomatis, Chlamydia pneumoniae, Mycoplasma pneumoniae, Legionella pneumophila и атипичных микобактерий.
Для проведения работы методом случайной выборки были отобраны 20 человек в возрастном интервале от 21 года до 43 лет, независимо от пола, с впервые выявленной урогенитальной хламидийной инфекцией. Длительность указанных заболеваний у всех больных составляла от 6 мес до 1 года. Диагноз был верифицирован методами прямой иммунофлюоресценции нативных мазков и культуральным методом. В ряде случаев дополнительно использовалась полимеразная цепная реакция (ПЦР).
У каждого конкретного пациента с помощью культурального метода проводился подбор адекватной этиотропной терапии. Дополнительным критерием включения больного в проводимые исследования являлась доказанная в условиях in vitro чувствительность возбудителя к кларитромицину.
Пациенты со смешанными инфекциями органов урогенитального тракта из эксперимента исключались. Также критериями исключения были сопутствующие соматические заболевания, при которых требовалось назначение антибактериальной терапии, отягощенный гастроэнтерологический анамнез, сахарный диабет, беременность, непереносимость антибиотиков макролидного ряда, детский и пожилой возраст.
У всех 20 пациентов, включенных в данные клинические исследования, до начала и после окончания курса антибиотикотерапии проводилось обследование кишечного содержимого на дисбактериоз.
После отбора на основании клинических и лабораторных исследований пациенты были распределены в две группы по 10 человек в каждой. В качестве этиотропного средства для лечения хламидийной инфекции больные каждой из этих групп получали дженерик кларитромицина фромилид в таблетках, покрытых оболочкой, по 250 мг 2 раза в день в течение 14 дней.
Первая (экспериментальная) группа пациентов получала кларитромицин по 250 мг 2 раза в день и одновременно с ним, а также дополнительно еще в 1 прием препарат лактофильтрум — 65% гидролизного лигнина, 20% лактулозы (СТИ-Мед-Сорб).
Вторая (контрольная) группа пациентов получала только терапию кларитромицином по 250 мг дважды в день.
У большинства больных первой группы отмечалась хорошая переносимость предлагаемой терапевтической комбинации. Ни у одного из этих пациентов не было каких-либо жалоб со стороны органов желудочно-кишечного тракта в процессе лечения.
Что касается больных контрольной группы, то появление невыраженных диспепсических расстройств отмечалось, как правило, со второй недели лечения и выражалось развитием метеоризма (в трех случаях), появлением зуда в области анального отверстия и развитием диареи (в одном случае). Последнее наблюдение можно связать с активизацией грибов рода Candida, выделенных у этого больного. Подтверждением данного предположения является изменение титра этого микроорганизма с 3 х 103 до 2 х 105 КОЕ/г. Ни в одном из указанных случаев описанная симптоматика не потребовала прекращения лечения.
|
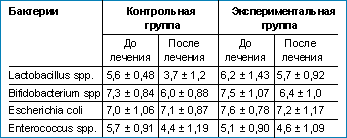
| Таблица. Содержание различных представителей микробиоценоза кишечника у больных с урогенитальным хламидиозом в контрольной и экспериментальной группах до и после терапии кларитромицином |
Наиболее интересные данные были получены в результате исследования микробиоценоза кишечника у больных экспериментальной и контрольной групп до и после лечения. В таблице представлены средние арифметические значения и стандартное отклонение lg КОЕ/г величин, характеризующих содержание лактобактерий, бифидобактерий, энтерококков и эшерихий, выделенных из фекалий экспериментальной и контрольной групп. Как видно из таблицы, снижение количества лактобактерий и бифидобактерий было статистически значимым только в контрольной группе (р < 0,001 и p < 0,05 соответственно). В экспериментальной группе существенных изменений в количественном содержании всех анализируемых представителей микробиоценоза кишечника не выявлялось.
Инфекции, вызываемые Chlamydia trachomatis, представляют собой наиболее распространенные заболевания, передаваемые половым путем. Их терапия требует длительного приема антибактериальных препаратов, что неизбежно приводит к дисбактериозу кишечника, который в дальнейшем играет значительную патогенетическую роль в развитии основного заболевания. Так, в условиях нарушения микроэкологии создаются предпосылки для рецидивов хламидийной инфекции, возбудители которой длительно персистируют в слизистой оболочке толстой кишки [3]. В этом случае особое значение приобретает разработка адекватных методов поддержания кишечной микрофлоры и минимизация ее потерь в процессе антибиотикотерапии.
Проведенные исследования показывают, что использование даже щадящего для микроэкологии кишечника антибиотика приводит к статистически значимому снижению количества основных представителей облигатной микрофлоры — Bifidobacterium spp., Lactobacillus spp., Enterococcus spp., причем и у контингента больных с благоприятным гастроэнтерологическим анамнезом.
Включение в терапию комплексного пребиотического препарата лактофильтрум позволяет минимизировать эти изменения. В экспериментальной группе больных существенных различий в количественном содержании представителей облигатной микрофлоры кишечника не наблюдалось, что может быть связанно с лакто- и бифидогенным эффектами использованного пребиотика.
Следует отметить, что при рассмотрении переносимости проводимой терапии лишь у больных контрольной группы отмечались диспепсические явления, связанные с антибиотикотерапией.
Из вышесказанного можно сделать следующие выводы.
- Проведенное клиническое исследование подтвердило эффективность совместного использования комбинированного пребиотика лактофильтрум в комплексе с макролидным антибиотиком кларитромицином для профилактики дисбиозов в процессе терапии хламидийной инфекции.
- Применение препарата лактофильтрум в процессе антибиотикотерапии хламидиоза способствует сохранению нормального микробиоценоза кишечника и снижает вероятность колонизации кишечника грибами рода Сandida.
- Применение лактофильтрума снижает вероятность появления диспепсических и аллергических реакций в процессе антибиотикотерапии.
Литература
- Адаскевич В. П. Инфекции, передаваемые половым путем. Н. Новгород: НГМА; М.: Медицинская книга, 1999. 416 c.
- Доронин А. Ф., Шендеров Б. А. Функциональное питание. М.: ГрантЪ, 2002. 296 с.
- Лобзин Ю. В., Макарова В. Г., Корвякова Е. Р., Захарьенко С. М. Дисбактериоз кишечника (клиника, диагностика, лечение): руководство для врачей. СПб.: ФОЛИАНТ, 2003. 256 с.
- Мавров И. И. Половые болезни. Харьков: Факт, 2003. 790 с.
- Шендеров Б. А. Медицинская микробная экология и функциональное питание. М.: ГрантЪ, 2001. Т. III. 288 с.
Д. К. Ермоленко, кандидат медицинских наук
Е. И. Ермоленко
В. А. Исаков
НИИ эпидемиологии и микробиологии им. Пастера, Санкт-Петербург
