Применение двухфазного инсулина аспарта в лечении больных сахарным диабетом 2 типа
Сахарный диабет (СД) 2 типа является одним из наиболее распространенных хронических заболеваний и носит характер неинфекционной эпидемии. В настоящее время около 200 млн человек в мире страдают этим недугом. Количество болеющих СД ежегодно увеличивается на 5–7% и каждые 15 лет удваивается. СД характеризуется ранней инвалидизацией и высокой смертностью больных вследствие поздних сосудистых осложнений. Это обстоятельство ставит данное заболевание в ряд социально значимых. Среди пациентов с этой патологией больные СД 2 типа составляют более 90%.
В основе патофизиологических нарушений при СД 2 типа лежат два основных дефекта — инсулинорезистентность и дисфункция β-клеток поджелудочной железы (нарушение секреции инсулина и относительный дефицит инсулина). Эти два нарушения очень тесно взаимосвязаны и сначала приводят к повышению уровня глюкозы в крови после еды (постпрандиальная гликемия — ППГ), а в дальнейшем и к гипергликемии натощак. Кроме того, уменьшается чувствительность периферических тканей к инсулину.
Международная диабетическая федерация (IDF) разработала рекомендации, регламентирующие терапевтические цели при СД 2 типа (табл.), исходя из которых можно ставить индивидуальные задачи по улучшению компенсации заболевания.
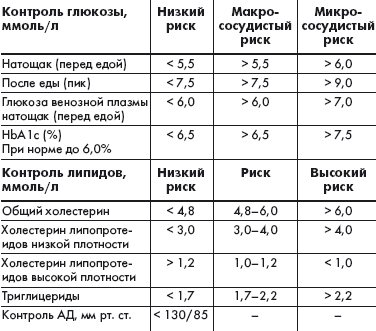
|
| Таблица. Терапевтические цели при сахарном диабете 2 типа |
Строгий контроль гликемии имеет первостепенное значение для снижения риска возникновения микро- и макрососудистых осложнений при СД 2 типа. Тем не менее, как показывают результаты Британского проспективного исследования сахарного диабета (UKPDS), по мере прогрессирования СД 2 типа становится все труднее поддерживать оптимальный уровень глюкозы крови натощак (ГКН) и гликированного гемоглобина (HbA1c) с помощью только гипокалорийной диеты, физических нагрузок. В этом случае назначаются пероральные сахароснижающие препараты (ПССП). Главная цель в лечении СД 2 типа — поддержание максимально приближенного к норме уровня сахара крови (гликемии).
В настоящее время в лечении СД 2 типа используются следующие группы ПССП.
Препараты, усиливающие секрецию инсулина поджелудочной железой. К этой группе ПССП относятся производные сульфонилмочевины (ПСМ) — глибенкламид (Манинил), гликлазид (Диабетон МВ), глимепирид (Амарил, Глемаз), гликвидон (Глюренорм) и прандиальные регуляторы гликемии (глиниды) — репаглинид (НовоНорм®). У каждого из перечисленных препаратов есть свои особенности, касающиеся в основном продолжительности действия. За счет усиления стимуляции инсулина поджелудочной железой эти препараты снижают уровень глюкозы в крови.
Препараты, улучшающие чувствительность к инсулину. Эта группа препаратов включает бигуаниды и инсулиновые сенситайзеры (тиазолидиндионы). Основным представителем группы бигуанидов является метформин (Глюкофаж, Сиофор, Багомет, Метфогамма). Метформин снижает продукцию глюкозы печенью за счет торможения глюконеогенеза, усиливает усвоение глюкозы периферическими тканями без стимуляции секреции инсулина поджелудочной железой. Метформин является препаратом выбора в лечении пациентов с СД 2 типа и избыточной массой тела. Препарат успешно применяется в комбинации с другими ПССП и инсулином.
Подгруппа инсулиновых сенситайзеров (тиазолидиндионов) представлена пиоглитазоном (Актос) и росиглитазоном (Авандия).
Препараты, уменьшающие всасывание углеводов в кишечнике. К этой группе относится акарбоза (Глюкобай), являющаяся ингибитором α-глюкозидаз. Акарбоза препятствует подъему уровня глюкозы в крови после еды за счет торможения всасывания углеводов, поступающих с пищей, в тонком кишечнике.
Комбинированные препараты. Они состоят из нескольких компонентов, к ним относятся, например, Глибомет (глибенкламид + метформин), Авандамет (росиглитазон + метформин).
Однако эффективное действие многих ПССП проявляется только при сохранении остаточной секреции β-клеток. Прогрессирующее снижение функции β-клеток и инсулинорезистентность, характерные для СД 2 типа, препятствуют достижению желаемого эффекта даже при комбинированной терапии несколькими ПССП. В этом случае наилучшим из имеющихся в арсенале вариантов лечения является инсулинотерапия. Один из выводов исследования UKPDS гласит: «Мы не начинаем инсулинотерапию так рано и так агрессивно, как это необходимо» [2].
Поддержание уровня гликированного гемоглобина в пределах рекомендованных целевых значений (< 7,0% — по рекомендациям Американской диабетической ассоциации; Ј 6,5% — по рекомендациям Международной федерации диабета, Американской ассоциации клинической эндокринологии, Минздравсоцразвития Российской Федерации) снижает риск развития микро- и макрососудистых осложнений СД [5–8]. Однако в последние годы появляется все больше доказательств роли ППГ как независимого фактора риска сердечно-сосудистой заболеваемости и смертности [9]. Эти данные очень важны в клинической практике, так как пациенты с уровнем ГКН, близким к целевым значениям, могут при этом иметь высокий уровень ППГ [10, 11]. Действительно, было показано, что при уровне HbA1c < 7,3% более 70% общего уровня гипергликемии приходится на ППГ [12]. Следовательно, пациентам необходимо назначать более интенсивные режимы терапии, направленные на контроль как ГКН, так и ППГ, объясняя им важность целенаправленного контроля ППГ и уровня HbA1c [13]. Базис-болюсные режимы терапии с прандиальным введением инсулинов короткой продолжительности действия и одной или двумя инъекциями базального инсулина являются одним из возможных вариантов интенсификации инсулинотерапии для достижения рекомендованных целей гликемического контроля. Однако такой вариант начала инсулинотерапии сложен ввиду выполнения многократных инъекций. Кроме того, базис-болюсная терапия не всегда показана пациентам на ранних стадиях СД 2 типа с сохранной остаточной функцией β-клеток [14]. Режим однократного введения базального инсулина или базального инсулинового аналога также может быть эффективным и практичным вариантом старта инсулинотерапии, когда терапия только ПССП уже не позволяет поддерживать удовлетворительный контроль гликемии [15, 16]. Хотя около 58% пациентов на таком режиме терапии достигают целевого уровня HbA1c < 7%, постпрандиальные значения гликемии могут оставаться высокими [17, 18].
Для улучшения контроля ППГ с одновременным поддержанием ГКН в пределах рекомендуемых значений оптимальным для пациентов с СД 2 типа является инсулинотерапия с использованием двухфазных аналогов инсулина.
Двухфазный инсулин аспарт (НовоМикс® 30 — Ново Нордиск, Дания) представляет собой смешанную лекарственную форму, содержащую 30% растворимого и 70% протамин-кристаллического инсулина аспарта (рис. 1). Первый компонент с ультракоротким действием снижает уровень глюкозы крови после приема пищи, а второй — обеспечивает базальную (длительную) потребность в инсулине. Комбинация быстро- и медленнодействующего компонентов позволяет воспроизвести профиль физиологической секреции инсулина. Терапия препаратом НовоМикс® 30 показана больным СД 2 типа с неудовлетворительным контролем гликемии на фоне приема ПССП в суб- и максимальных дозах; при неудовлетворительном контроле ППГ на фоне проводимой терапии; в случае частых, повторных гипогликемий; пациентам, которым по объективным причинам сложно перейти на интенсивную инсулинотерапию.
Потенциальные преимущества использования препарата НовоМикс®30 у больных СД 2 типа оценивались в нескольких международных исследованиях.
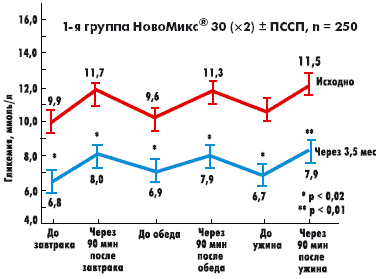
|
| Рисунок 1. Суточные профили гликемии в 1-й и 2-й группах пациентов исходно и через 3,5 мес на фоне терапии препаратом НовоМикс 30 |
В исследовании ACTION (Achieving Control Through Insulin plus Oral agents) сравнивалась интенсификация терапии ПССП с инсулинотерапией в режиме двух инъекций [32]. Исследование продолжалось 24 нед. В него были включены пациенты с СД 2 типа, которым не удалось достичь целевых значений HbA1c на фоне терапии ПССП.
К завершению исследования 76% пациентов смогли достичь показателя HbA1c < 7% в группе применения сочетания НовоМикс® 30 + ПССП по сравнению с 24% пациентов, получавших терапию только ПССП. Больше пациентов СД 2 типа и неудовлетворительным контролем на фоне терапии двумя ПССП смогли достичь рекомендуемых целевых уровней HbA1c на фоне терапии препаратом НовоМикс® 30 в сочетании с метформином и пиоглитазоном.
В исследовании Kabadi & Kabadi [27] изучались возможности улучшения гликемического контроля у пациентов СД 2 типа при назначении им инсулина НовоМикс® 30 в режиме одной инъекции в комбинации с метформином, ПСМ или обоими ПССП. В него было включено 46 мужчин с СД 2 типа в возрасте 45–70 лет с уровнем HbA1c > 7,5%. Длительность исследования составляла 6 мес. Исходно пациенты получали либо только метформин (2500 мг/сут), или только глимепирид (8 мг/сут), или комбинацию указанных препаратов (2500 мг/сут + 8 мг/сут).
В ходе исследования пациенты продолжали получать прежнюю терапию ПССП с добавлением препарата НовоМикс® 30 (n = 38). 8 пациентов были переведены на терапию плацебо + НовоМикс® 30 с отменой ПССП. Исходно масса тела и уровень HbA1c достоверно не отличались между группами.
Через 6 мес у пациентов всех групп отмечалось значительное снижение HbA1c, включая пациентов, получавших НовоМикс® 30 + плацебо. Цели контроля (HbA1c < 7%) были достигнуты пациентами всех групп. Эпизодов тяжелых гипогликемий ни в одной группе зафиксировано не было.
Таким образом, терапия инсулином НовоМикс® 30 в режиме одной инъекции обеспечила всем группам возможность достижения целевого значения для HbA1c < 7,0% и глюкозы в плазме натощак (ГПН) 5–7,2 ммоль/л. Меньшая доза инсулина отмечалась на фоне комбинированной терапии препаратом НовоМикс® 30 с метформином и ПСМ.
В исследовании PREFER [33] сравнивалась эффективность двух перспективных режимов терапии аналогами инсулина: НовоМикс® 30 в режиме двух инъекций и базис-болюсной терапии (Левемир® + НовоРапид®). Длительность исследования составила 26 нед. В него было включено 715 пациентов СД 2 типа с уровнем 7% < HbA1c < 12%, ранее получавших только терапию ПССП (72%) или в комбинации с инсулином гларгином (Лантус) или НПХ-инсулин.
Терапия инсулином НовоМикс® 30 (n = 178) начиналась с двух инъекций в сутки (0,2 ЕД/кг перед завтраком и 0,1 ЕД/кг перед ужином). Базис-болюсная терапия (n = 537) начиналась с одной инъекции инсулина Левемир® (10 ЕД или 14 ЕД, если ИМТ > 32 кг/м2) плюс инсулин НовоРапид® прандиально. Дозы подбирались индивидуально в соотношении 3 : 2 : 1 (в завтрак, обед и ужин соответственно). ПССП отменялись в обеих группах терапии.
Оба режима терапии инсулиновыми аналогами обеспечили возможность безопасного достижения целевого уровня HbA1c 7,0%: 50% в группе терапии инсулином НовоМикс® 30 и 60% в группе терапии инсулинами Левемир® и НовоРапид® у пациентов СД 2 типа. Пациенты, ранее не получавшие инсулинотерапии, достигли равного гликемического контроля на фоне терапии двухфазным аналогом и базис-болюсной терапии.
Среднее значение ГКН также оказалось одинаковым: 8,05 ммоль/л на фоне терапии инсулином НовоМикс® 30 и 8,27 ммоль/л на фоне базис-болюсной терапии инсулинами Левемир® и НовоРапид® (р = 0,345). Частота гипогликемий была низкой и сравнимой для обоих режимов терапии инсулиновыми аналогами.
Целью рандомизированного, открытого, с параллельными группами исследования EuroMix [24] являлось сравнение эффективности безопасности двух режимов терапии инсулиновыми аналогами у 255 пациентов с СД 2 типа: инсулин НовоМикс® 30 в режиме двух инъекций в комбинации с метформином (n = 128) и инсулин Лантус в режиме одной инъекции в комбинации с глимепиридом 1 раз в сутки (n = 127). Первичным параметром исследования была разница в динамике снижения HbA1c между группами через 26 нед терапии.
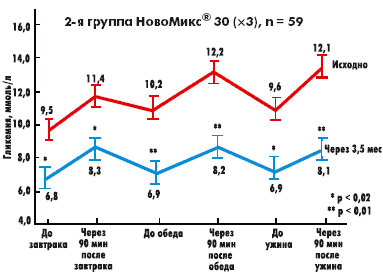
|
| Рисунок 2. Динамика прандиального прироста гликемии исходно и через 3,5 мес на фоне терапии препаратом НовоМикс 30 |
Исследование показало, что старт инсулинотерапии с использования двухфазного аналога НовоМикс® 30 в двухкратном режиме в комбинации с метформином обеспечивает более выраженное снижение уровня HbA1c и среднего прандиального прироста гликемии у больных СД 2 типа в сравнении с терапией аналогом инсулина Лантус® в режиме одной инъекции в сочетании с глимепиридом.
Нами было проведено исследование в 10 административных округах Москвы с целью изучения эффективности препарата НовоМикс® 30 в условиях повседневной клинической практики в течение 3,5 мес у 3 000 больных СД 2 типа с неудовлетворительным уровнем гликемии на фоне предшествующей терапии.
Для окончательного анализа методом случайной выборки было отобрано 309 анкет (каждая 10-я анкета). Длительность СД 2 типа составляла 11,5 ± 1,5 лет. До перевода на НовоМикс® 30 пациенты получали монотерапию ПССП или комбинированную терапию ПССП с инсулином. Уровень HbA1c в общей группе пациентов исходно составил 9,3 ± 1,5%. В ходе исследования пациенты были разделены на две группы: в 1-й группе больные получали НовоМикс® 30 в двух инъекциях в комбинации с ПССП, во 2-й — НовоМикс® 30 в трех инъекциях без ПССП.
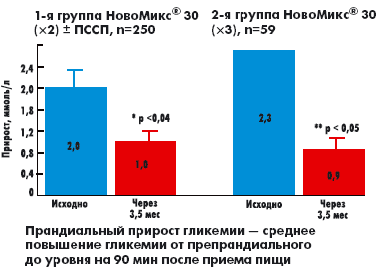
|
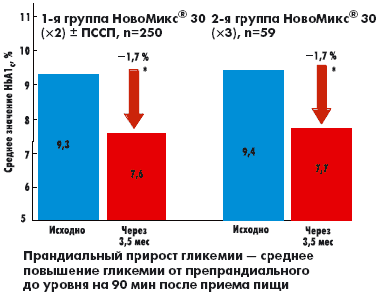
| Рисунок 3. Динамика прандиального прироста гликемии исходно и через 3,5 мес на фоне терапии препаратом НовоМикс® 30 |
1-я группа насчитывала 250 пациентов (195 женщин/55 мужчин), средняя длительность заболевания — 11,5 ± 6,2 года, исходный уровень HbA1c 9,3 ± 1,8%, ГКН 9,9 ± 2,3 ммоль/л, ППГ 11,7 ± 2,7 ммоль/л. Эта группа получала НовоМикс® 30 в двух инъекциях перед завтраком и перед ужином в комбинации с ПССП, представленными препаратами сульфонилмочевины и метформина в максимальных дозах.
Во 2-ю группу были включены 59 пациентов (44 женщины/15 мужчин), со средней длительностью заболевания 11,7 ± 7,8 года, исходными уровнями HbA1c 9,4 ± 1,8%, ГКН 9,5 ± 2,5 ммоль/л, ППГ 11,3 ± 2,6 ммоль/л. Эта группа пациентов получала НовоМикс® 30 в режиме трех инъекций перед основными приемами пищи.
Данные анализа показали, что в ходе наблюдения в обеих группах достоверно улучшились показатели суточного гликемического профиля (8 точек), определявшиеся в процессе самоконтроля (р < 0,02) (рис. 1, 2), и HbA1c.
Было выявлено достоверное снижение среднего прандиального прироста гликемии (среднее повышение гликемии от препрандиального на 90 мин после приема пищи; р < 0,04) в сравнении с исходными значениями (p < 0,01) в обеих группах пациентов (рис. 3).
|
| Рисунок 4. Динамика HbA1c исходно и через 3,5 мес на фоне терапии препаратом НовоМикс® 30 |
К концу исследования в обеих группах пациентов уровень HbA1c снизился до 7,5 ± 0,8% (рис. 4).
Таким образом, данные по применению двухфазного аналога инсулина НовоМикс® 30 в практике лечения больных СД 2 типа позволяют сделать следующие выводы.
- Начало терапии с одной инъекции НовоМикс® 30 в дополнение к ПССП дает возможность эффективного достижения целевого контроля заболевания.
- Интенсификация терапии НовоМикс® 30 до двух или трех инъекций позволяет достигнуть целевого уровня у большинства пациентов без повышения риска гипогликемий.
- Контроль ППГ и улучшение липидного профиля на фоне терапии двухфазным аналогом НовоМикс® 30 потенциально может снижать риск сердечно-сосудистых осложнений.
- Контроль ППГ является важным компонентом управления СД.
- Инсулинотерапию необходимо не только своевременно начинать, но и своевременно интенсифицировать.
Литература
- Riddle M. C. Tactics for Type 2 diabetes. Endocrinol Metab Clin North Am. 1997; 26: 659–677.
- Turner R. C., Cull C. A., Frighi V. et al. For the UK Prospective Diabetes Study (UKPDS) Group. JAMA. 1999; 281: 2005–2012.
- Chan J. L., Abrahamson M. J. Pharmacological management of Type 2 diabetes mellitus// Mayo Clin Proc. 2003; 78: 459–467.
- Weyer C., Bogardus C. et al.// J. Clin Invest. 1999; 104: 787–794.
- Stratton I. M., Adler A. J., Neil H. A. et al. UKPDS 35: Prospective observational study// Br Med J. 2000; 321: 405-412.
- European Diabetes Policy Group 1999. A desktop guide to type 2 diabetes mellitus. Diabet Med. 1999; 16: 716-730.
- American Diabetes Association. Standards of medical care in diabetes. Diabetes Care. 2005; 28 (Suppl1): 4-36.
- American College of Clinical Endocrinologists. Medical guidelines for the management of diabetes mellitus. 2002 update. Endocr Pract. 2002; 8 (Suppl 1): 40-83.
- Gerich J. E. Arch Intern Med. 2003; 163: 1306-1316.
- Ceriello A. Diabetologia. 2003; 46 (Suppl 1): 9–16.
- Monnier L., Lapinski H., Collette C. Diabetes Care. 2003; 26: 881–885.
- Landgraf R. Diabet Vetab Res Rev. 2004; 20 (Suppl 2): 9–12.
- Abrahamson M. J. Arch Intern Med. 2004; 164: 486–491.
- Lebovitz H. E. Diabetes Rev. 1999; 7: 139-153.
- Riddle M. C. Am J Med. 2004; 116 (Suppl 3A): 10–16.
- Rosenstock J. Am J Med. 2004; 116 (Suppl 3A): 10–16.
- Riddle M. C., Rosenstock J., Gerish J. Diabetes Care. 2003; 26: 3080–3086.
- Fritsche A., Schweitzer M. A., Haring H. U. Ann Intern Med. 2003; 138: 952–959.
- Bell D. S., Clements R. S. et al. Arch Intern Med. 1991; 151: 2265-2269.
- Owens D. R., Zinman B., Bolli G. B. Lancet. 2001; 358: 739-746.
- Heller S. Int J Obes. 2002; 26 (Suppl 3): 31-36.
- Bolli G. B., Di Marchi R. D., Park G. D. et al. Diabetologia. 1999; 42: 1151-1167.
- Weyer C., Heise T., Heinemann L. Diabetes Care. 1997; 20: 1612-1614.
- Lund et al. Diabetologia 2006; 49(Suppl 1): 600.
- Garber et al. Diabetes Obes Metab. 2006; 8: 58-66.
- Kilo et al. J Diabetes Complications. 2003; 17: 307-13.
- Kabadi & Kabadi. Diabetes Res Clin Prac. 2006; 72(3): 265-270.
- Naiker et al. Diabetologia. 2006; 49(Suppl 1): 599.
- Gasher B. Hirsch I. Arch Intern Med. 1998; 158: 134-140.
- Ohkubo Y. Kishikawa H. et al. Diabetes Res Clin Pract. 1995; 28: 103-117.
- Hermansen K., Vaaler S., Madsbad S. Metabolism. 2002; 51 (7): 896-900.
- Raskin et al. Diabetes. 2006; 55 (Suppl 1): 131.
- Liebl et al. Diabetes. 2006; 55 (Suppl 1): 123.
М. Б. Анциферов, доктор медицинских наук, профессор
Л. Г. Дорофеева
Эндокринологический диспансер Департамента здравоохранения г. Москвы
