Влияние эффективного лечения бактериального риносинусита на течение сопутствующей бронхиальной астмы

Проблема воспалительных заболеваний околоносовых пазух на сегодняшний день крайне актуальна. Заболеваемость риносинуситом за последние 10 лет увеличилась в 2 раза, а удельный вес госпитализированных по этому поводу возрастает ежегодно на 1,5–2%. Наибольшее число больных приходится на возраст от 18 до 55 лет.
В структуре синусита 56–73% приходится на долю поражения верхнечелюстной пазухи в связи с ее наибольшими размерами, высоким расположением естественного соустья и близким контактом с корнями зубов. В последнее время отмечается ежегодный прирост заболеваемости на 1,5–2%.
Тесные «топографические взаимоотношения» носа и околоносовых пазух с полостью черепа и глазницы обусловливают сравнительно частый переход воспалительного процесса в полость черепа и глазницы, вызывая тяжелые осложнения, порой приводящие к инвалидизации и угрожающие жизни больного.
Известно, что верхние и нижние отделы дыхательных путей имеют тесные анатомо-физиологические связи. Следует отметить участие рецепторного аппарата слизистой оболочки полости носа в регуляции работы легких посредством ринобронхиального рефлекса.
Таким образом, проблема воспалительных заболеваний околоносовых пазух выходит далеко за рамки оториноларингологии и тесно связана с бронхолегочной патологией, аллергизацией организма и изменениями в местном и гуморальном иммунитете.
Риносинусит — воспаление слизистой оболочки носа и околоносовых пазух, практически всегда вызывающийся застоем секрета, нарушением аэрации пазух и, как следствие, инфицированием. Острые риносинуситы обычно имеют вирусную (более чем в 80% случаев возбудителем являются риновирусы) или бактериальную этиологию, хронические — бактериальную, реже грибковую.
Важным моментом в развитии синусита и особенно его хронизации являются аномалии строения внутриносовых структур и решетчатого лабиринта. Полипы, отечная слизистая оболочка, искривленная перегородка носа и другие патологические изменения нарушают проходимость естественных отверстий околоносовых пазух, приводят к стагнации секрета и снижению парциального давления кислорода в околоносовых пазухах. Дополнительное соустье верхнечелюстной пазухи также предрасполагает к развитию синусита, наличие двух и более отверстий создает условия для заброса инфицированной слизи из полости носа обратно в верхнечелюстную пазуху.
Следует подчеркнуть, что вирусное инфицирование является лишь первой фазой заболевания; в этот период продлевается время контакта патогенных бактерий с клетками и становится возможным вторичное бактериальное инфицирование.
Возбудителями инфекционного синусита могут быть как патогенные, так и условно-патогенные микроорганизмы.
Среди возбудителей синусита наиболее значимыми в настоящее время являются Streptococcus (Str.) pneumoniae, Haemophilus (H.) influenzae, реже встречается Moraxella catarrhalis.
Известно, что серьезные внутричерепные и орбитальные осложнения при остром синусите обычно являются результатом инфицирования Str. pneumoniae и H. Influenzae.
В процентном соотношении при остром синусите в 44,9% выделяется Str. pneumoniae, в 17,3% — H. influenzae, в 10,2% — анаэробы, в 7,1% — ассоциации аэробов (Str. pneumoniae и H. influenzae). Считается, что Staphylococcus (S.) aureus обусловливает наиболее тяжелые случаи госпитального (нозокомиального) синусита.
При хронических синуситах микробная флора отличается большим разнообразием: различные стрептококки — 21%, гемофильная палочка — 16%, синегнойная палочка — 15%, золотистый стафилококк и моракселла — по 10%; Prevotella — 31%, анаэробные стрептококки — 22%, Fusobacterium — 15% и др.
Антибиотики для местного воздействия. В настоящее время существует только один антибиотик для местного воздействия на слизистую оболочку — фузафунгин (Биопарокс), выпускаемый в форме дозированного аэрозоля. Благодаря очень малому размеру аэрозольных частиц фузафунгин способен проникать в околоносовые пазухи. Спектр его антимикробной активности распространяется на микроорганизмы, которые чаще всего являются возбудителями инфекций верхних дыхательных путей. Кроме того, за время его применения не отмечено появления новых резистентных к нему штаммов бактерий. Помимо антибактериальных свойств, фузафунгин обладает собственным противовоспалительным действием. Он усиливает фагоцитоз макрофагов и ингибирует образование медиаторов воспаления.
Препараты для местного воздействия особенно эффективны в лечении синусита в случаях хорошей проходимости естественных соустьев пазух. Кроме того, целесообразно использование местных препаратов после операций в полости носа и на околоносовых пазухах.
Системная антибиотикотерапия. Эмпирическая антибактериальная терапия — наиболее рациональная стратегия этиотропной терапии в период возникновения острых гнойных или обострения хронических гайморитов на начальном этапе их лечения.
При выборе препарата следует учесть данные о снижении эффективности цефалоспоринов I и II поколений в отношении «главного» возбудителя острого синусита — Str. рneumoniae.
Отмечаются рост устойчивости к макролидам, а также крайне высокая резистентность к ко-тримоксазолу и тетрациклинам (более 50%), очень низкая активность в отношении ранних фторхинолонов. Приведенные данные позволяют избежать ошибок при выборе конкретного препарата, например назначения сульфаниламидов, линкомицина, доксициклина, ципрофлоксацина и других антибактериальных средств, которые часто рекомендуются врачами поликлиник.
В отношении H. influenzae практически не отмечено резистентности к ингибиторозащищенным пенициллинам, цефалоспоринам II–IV поколений, фторхинолонам.
Спектр значимых возбудителей и характер резистентности в отношении антибактериальных препаратов в настоящее время таковы, что для терапии гнойных синуситов на современном этапе используют β-лактамы, фторхинолоны и макролиды.
Достаточно высокой эффективностью при лечении синуситов обладают цефалоспорины. Пероральный цефалоспорин 3-й генерации Супракс (цефиксим) хорошо зарекомендовал себя как препарат с удобным режимом дозирования (1 раз в сутки), высоким уровнем антибактериальной активности, оптимальной фармакокинетикой в ЛОР-органах, позволяющей сохранять высокие концентрации действующего вещества в слизистой околоносовых пазух. Карбоцистеин — единственный препарат среди отхаркивающих средств, обладающий одновременно мукорегулирующим и муколитическим эффектами. Препарат нормализует количественное соотношение кислых и нейтральных сиаломуцинов бронхиального секрета, что восстанавливает вязкость и эластичность слизи (эффект достигается за счет сиаловой трансферразы, вырабатываемой бокаловидными железами слизистой оболочки).
На фоне применения препарата восстанавливается секреция иммуноглобулина A, улучшается мукоцилиарный транспорт, происходит регенерация структур слизистой оболочки. Действие препарата распространяется на слизистую оболочку всех отделов дыхательного тракта.
Одновременное назначение карбоцистеина и антибиотиков потенцирует лечебную эффективность последних при воспалительных процессах в области как верхнего, так и нижнего отделов дыхательного тракта. Кроме того, карбоцистеин повышает эффективность глюкокортикостероидной терапии, усиливает бронхолитический эффект теофиллина. Активность карбоцистеина ослабляют противокашлевые и атропиноподобные средства.
Для подтверждения тезиса о возможности консервативной терапии синуситов нами проведено обследование и лечение 65 больных гайморитом (диагноз устанавливался на основании жалоб, анамнестических данных, результатов оториноларингологического осмотра, лабораторного и инструментального обследования).
Следует отметить, что данная группа была сформирована из больных, отказавшихся от пункционного метода лечения.
Распределение больных по полу было приблизительно одинаковым: 39 женщин (60%) и 26 мужчин (40%) в возрасте от 18 до 63 лет (39 ± 10,82 года), 67% больных находились в трудоспособном возрасте (20–50 лет).
У 45 (69,2%) больных данной группы диагностирован острый гайморит: у 22 — двусторонний, у 23 — односторонний процесс. У 20 (30,8%) больных отмечалось обострение хронического гайморита: у 16 — двусторонний, у 4 — односторонний процесс.
На неэффективность предшествующей амбулаторной антибиотикотерапии указывали 26 (40%) больных: 6 больных принимали азитромицин по схеме 500, 250, 250 мг в течение 3 сут, 7 больных — ко-тримоксазол (Бисептол 480) по 2 таблетки 2 раза в сутки в течение 7–9 дней, 2 пациента — ампиокс по 500 мг 4 раза в сутки в течение 5–7 дней, 3 пациента — амоксициллин/клавуланат по 375 мг 3 раза в сутки в течение 7–10 дней, 3 пациента — ципрофлоксацин по 250 мг 2 раза в сутки в течение 5 дней, 2 пациента — пефлоксацин по 400 мг 2 раза в сутки в течение 5 дней, 3 пациента — цефазолин внутримышечно по 500 мг 2 раза в сутки в течение 7–9 дней.
На неэффективность предшествующего пункционного лечения указывали 18 (28,1%) больных. У 60 (92,3%) больных после проведенного микробиологического исследования была выявлена патогенная микрофлора.
Микробные ассоциации отмечены у 20 (30,7%) больных. Максимальное число возбудителей, выделенных у одного больного, равнялось трем (табл. 1).
|
Таблица 1 Число штаммов микроорганизмов, выделенных до начала лечения у больных |
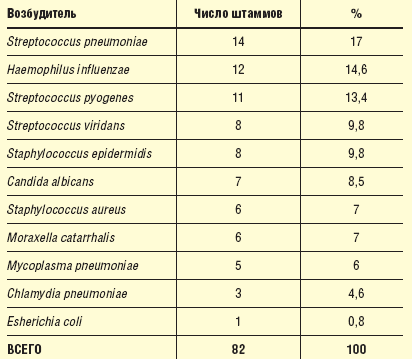
|
Рентгенологическое исследование околоносовых пазух в носолобной и носоподбородочной проекциях было проведено 24 больным, компьютерная томография — 21 больному.
При проведении сахаринового теста для оценки транспортной функции мерцательного эпителия, у подавляющего числа больных (56–86%) выявлено увеличение времени появления сладкого привкуса во рту (> 13 мин), что косвенно свидетельствует о снижении мукоциллиарного клиренса.
Пульмонологическое (до лечения) и аллергологическое (после лечения) обследования проведены 22 больным с сопутствующим аллергическим риносинуситом (в 8 случаях сочетанным с бронхиальной астмой, в 4 — с аллергией к пыльцевым аллергенам, а в 2 — с непереносимостью Аспирина и Новокаина), 9 больным с сопутствующим полипозным риносинуситом (в 4 случаях сочетанным с бронхиальной астмой и аллергией к бытовым аллергенам), а также 3 больным только с бронхиальной астмой и 5 больным с подозрением на бронхиальную астму.
Все больные получили консультацию пульмонолога. Скрытая бронхоконстрикция выявлена у 10 больных, у 5 человек были обнаружены хронический катаральный бронхит и эмфизема легких, у 4 — диффузный пневмосклероз. У 9 пациентов была диагностирована инфекционно-зависимая бронхиальная астма с атопическими реакциями, немного реже встречалась инфекционно-зависимая бронхиальная астма без атопических реакций (7 человек). Диагноз атопической бронхиальной астмы был поставлен только 4 больным. По степени тяжести бронхиальной астмы все больные были распределены следующим образом: средняя степень тяжести диагностирована у 8, легкая степень — у 9, тяжелая степень — у 3 больных. Минимальная продолжительность бронхиальной астмы составила 4 года, максимальная — 25 лет. Длительность аллергического и полипозного риносинусита колебалась от 4 до 25 лет. Десяти больным ранее по поводу бронхиальной астмы проводилось системное лечение глюкокортикостероидами. У 5 больных бронхиальная астма была выявлена впервые.
Схема эмпирической антибактериальной терапии представлена на рис. 1.
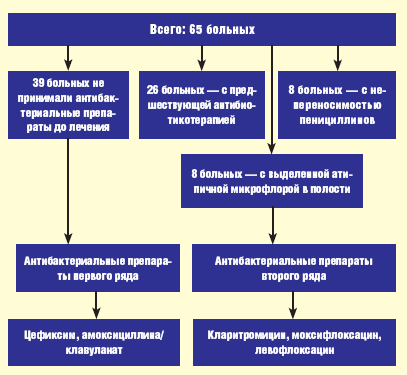
|
| Рис. 1. Схема эмпирической антибактериальной терапии больных |
У 7 из 65 больных на 3-и сутки после начала лечения отсутствовала положительная динамика субъективных и объективных симптомов гайморита. Этим больным дополнительно назначен курс пункционного лечения до получения результатов микробиологического исследования ввиду опасности развития внутричерепных осложнений. Четырем из них после получения данных бактериологического исследования была произведена коррекция схемы лечения в соответствии с антибиотикограммой. У 2 больных был выделен золотистый стафилококк, резистентный к большинству антибиотиков, назначен ципрофлоксацин по 500 мг 2 раза в сутки в течение 5 дней. У 2 больных выявлен также резистентный к большинству антибиотиков эпидермальный стафилококк, антибиотиком второго ряда стал левофлоксацин, назначавшийся по 500 мг 1 раз в сутки в течение 5 дней. У 3 оставшихся больных возбудители не были идентифицированы — им назначен антибактериальный препарат второго ряда моксифлоксацин: 500 мг/сут в течение 5 дней. В результате проведенного лечения у всех больных отмечена нормализация картины периферической крови (р < 0,01). Динамика субъективных и объективных симптомов гайморита представлена на рис. 2, 3.
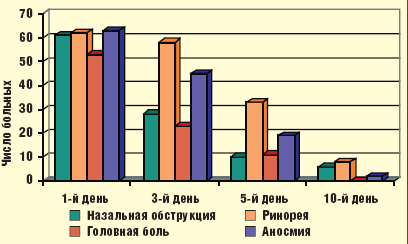
|
| Рис. 2. Динамика субъективных симптомов гайморита |
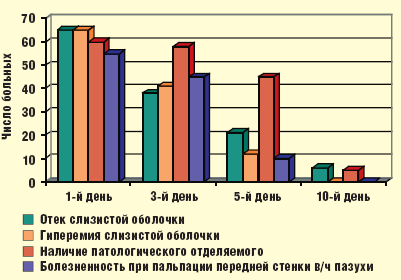
|
| Рис. 3. Динамика объективных симптомов гайморита |
Повторное бактериологическое исследование проводилось на 10-е сутки от начала лечения, а повторная диагностика методом полимеразной цепной реакции — на 30-е сутки после лечения.
Получены следующие результаты микробиологического исследования после лечения:
- эрадикация - у 28 больных;
- предположительная эрадикация (отсутствие патологического отделяемого) - у 37;
- персистирование - не отмечено ни в одном из случаев.
При сравнении показателей риноманометрии, проведенной всем больным до начала лечения и после его окончания, у большинства — 45 (69,2%) человек — отмечено их улучшение (р < 0,01).
Таким образом, на фоне проводимого лечения с 3-го дня установлена устойчивая тенденция (р = 0,055) к снижению, а к 5-м суткам — значительное уменьшение субъективной и объективной симптоматики гайморита, к 10-м суткам определялись бактериологическая санация носового секрета (в отношении атипичных возбудителей — к 30-м суткам) и статистически достоверное улучшение функции мерцательного эпителия (р < 0,01). Положительная динамика патологических изменений в пазухах, по данным ультразвукового исследования, начиналась с 3-х суток. К 30-м суткам у большинства больных результаты рентгенологического и ультразвукового исследований соответствовали норме (рис. 4). Данные изменения были статистически достоверны (р < 0,05).
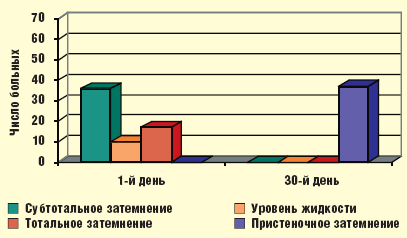
|
| Рис. 4. Динамика изменений в околоносовых пазухах по данным рентгенографии и компьютерной томографии через 30 дней от начала лечения |
Повторное пульмонологическое обследование проведено всем 20 больным, страдающим бронхиальной астмой, и 10 больным с выявленной бронхоконстрикцией. Отмечены улучшение показателей функции внешнего дыхания по сравнению с исходными данными у 21 больного и отсутствие изменений у 9 (табл. 2).
Клинический пример. Больная К., 44 года (история болезни № 28385/04) поступила в клинику с жалобами на выделения гнойного характера из обеих половин носа, умеренную заложенность носа с обеих сторон, периодическую головную боль, нарастающую к вечеру, гипосмию.
Длительность заболевания составляла 7 дней, в течение которых больная закапывала сосудосуживающие капли в нос. Обратилась в клинику в связи с отсутствием улучшения состояния.
Слизистая оболочка полости носа гиперемирована, средние и нижние носовые раковины сильно увеличены в объеме за счет отека, средний носовой ход значительно сужен, в общем носовом ходе — большое количество слизисто-гнойного отделяемого.
При обследовании в общем анализе крови отклонений от нормы не выявлено. При эндоскопии полости носа видимых патологических изменений в области остиомеатального комплекса не установлено. При бактериологическом исследовании выявлен рост Str. pneumoniae 107.
Больная консультирована пульмонологом. Показатели функции внешнего дыхания до начала лечения: ОФС1 — 76,2; МОС50 — 46,8. Заключение оториноларинголога: острый двусторонний гнойный гайморит. Аллергический риносинусит. Заключение пульмонолога: скрытая бронхоконстрикция.
Больная принимала цефиксим (Супракс) по 400 мг 1 раз в день в течение 10 дней, Кларготил по 10 мг в день и мометазон в дозе 200 мкг в каждую половину носа 2 раза в день течение 30 дней.
Через 2 дня после начала лечения головная боль прекратилась, периоды затрудненного носового дыхания сократились, появились обильные выделения из носа слизисто-гнойного характера. Через 5 дней выделения приобрели слизистый характер, значительно уменьшились отек и гиперемия слизистой оболочки, восстановилось обоняние.
Слизистая оболочка полости носа розовая, влажная, носовые раковины не увеличены, носовые ходы свободны.
При повторном бактериологическом исследовании роста микрофлоры выявлено не было. Сахариновое время для правой и левой половин носа уменьшилось соответственно до 17 и 15 мин. Показатели функции внешнего дыхания после проведенного лечения улучшились: ОФВ1 — до 86,5; МОС50 — до 58,4.
Спустя 30 дней больная жалоб не предъявляла, а риноскопическая картина полностью нормализовалась.
Многие практикующие врачи крайне скептически относятся к попыткам беспункционного лечения гайморита, называя в качестве главного аргумента неизбежную хронизацию процесса при использовании только системной антибактериальной терапии. Ошибочная постановка знака равенства между пункцией и антибактериальной терапией нередко приводит к нежелательным последствиям. В случае консервативного, неинвазивного лечения пункции — как дренирующему мероприятию — должен быть найден альтернативный метод эвакуации патологического секрета из пазухи, начиная с медикаментозных средств и заканчивая щадящими инструментальными пособиями. А индивидуальный подход к каждому конкретному больному с учетом частой сопутствующей патологии со стороны нижних дыхательных путей позволит в значительной мере оптимизировать результаты лечения и избежать частых обострений и рецидивов как со стороны верхнего, так и нижнего отделов дыхательной системы.
А. Ю. Овчинников, доктор медицинских наук
С. И. Овчаренко, доктор медицинских наук, профессор
И. Г. Колбанова, кандидат медицинских наук
ММА им. И. М. Сеченова, Москва
Врезки:
