Диагностика и лечение острого бронхита
Острый бронхит (ОБ) является одним из наиболее часто документируемых заболеваний, встречающихся в клинической практике. ОБ — остро или подостро возникающее заболевание, ведущим клиническим признаком которого является кашель (продуктивный или непродуктивный), продолжающийся не более 2–3 нед и, как правило, сопровождающийся общими симптомами инфекции верхних дыхательных путей (ИВДП) [1]. Ежегодная заболеваемость ОБ колеблется от 20 до 40% и более. Об истинной распространенности ОБ говорит тот факт, что в 1997 г. в США из 30 млн пациентов, обратившихся к врачу по поводу кашля, практически у половины был диагностирован ОБ. Еще одной проблемой является назначение антибактериальной (АБ) терапии больному ОБ. Основная доля заболевания по этиологии является вирусной. В связи с этим именно у пациентов с ОБ велика доля различных ятрогенных эффектов от необоснованного назначения антибиотиков [2–4]. Этиологический спектр возбудителей, приводящих к развитию ОБ, представлен вирусами гриппа А и В, парагриппа, а также респираторным синцитиальным вирусом и человеческим метапневмовирусом [2, 5], реже — коронавирусами, аденовирусами, риновирусами. Согласно результатам исследований, в ходе которых проводилось выявление актуальных возбудителей ОБ (использовались культуральные, серологические, молекулярно-генетические и другие методы, в исследование включались пациенты без сопутствующей легочной патологии [6, 7]) — верификация возбудителя удалась лишь у небольшого количества больных (29% из 42 обследованных в одном исследовании [7] и, соответственно, 16% при обследовании 113 пациентов в другом [8]). Установлено, что вирусы были самой частой идентифицируемой причиной возникновения ОБ. Существовавшая долгое время гипотеза об остром бактериальном бронхите, вызываемом, например, Streptococcus (Str.) pneumoniae, Haemophilus (H.) influenzae, Staphylococcus (S.) aureus, Moraxella (Mor.) catarrhalis или даже грамотрицательными бактериями, не нашла подтверждения; исключение составляют больные, перенесшие хирургические манипуляции, например трахеотомию, либо подвергшиеся эндотрахеальной интубации. В тех случаях, когда у больных ОБ вне сезонных эпидемических вспышек вирусных респираторных инфекций осуществляется микробиологическое и серологическое исследование, с разной частотой, но не более чем в 5–10%, удается получить свидетельство участия в развитии заболевания Bordatella (B.) pertussis и B. parapertussis, Mycoplasma (M.) pneumoniae и Chlamydophila (C.) pneumoniae.
M. pneumoniae — относительно часто встречающаяся инфекция у молодых пациентов (16–40 лет), которая характеризуется фарингитом, конституциональными расстройствами в виде недомогания, слабости, потливости и сопровождается длительным постоянным кашлем (от 4 до 6 нед) [9]. В случае остро развившегося кашля продолжительностью более 5 дней M. рneumoniae как верифицированный возбудитель возникшей инфекции дыхательных путей был документирован менее чем в 1% случаев [10]. По данным серологической диагностики (доказанная M. рneumoniae-инфекция) количество пациентов, заболевших ОБ, значительно превышает количество пациентов с внебольничной пневмонией [11].
C. pneumoniae выявляется у 5% молодых пациентов с диагнозом ОБ [12]. В его клиническую картину входят фарингит, ларингит и бронхит; пациенты наиболее часто отмечают хрипоту, осиплость голоса, субфебрильную лихорадку, першение в горле, постоянный малопродуктивный кашель, в дальнейшем — с отхождением слизистой мокроты [10, 13].
Возбудитель коклюша и паракоклюша B. bordetella и B. parapertussis манифестирует с основной жалобы пациентов на лающий кашель. Так, среди отобранных 153 взрослых пациентов из Сан-Франциско с жалобами на кашель продолжительностью не менее 2 нед было доказано, что у 12% больных оказался коклюш — и, что самое важное, в ходе оценки клинической картины дифференциальный диагноз с коклюшем не проводился ввиду отсутствия типичной клинической симптоматики. [14].
С позиции клинициста ОБ характеризуется воспалением бронхов и клиническими проявлениями в виде надсадного кашля, обычно с признаками ИВДП. Дифференциальная диагностика должна проводиться прежде всего в отношении внебольничной пневмонии.
Врачи, проводя дифференциальную диагностику, считают, что остро возникший кашель, сопровождающийся субфебрилитетом, симптомами ИВДП (боль в горле, насморк), при отсутствии тахикардии, тахипноэ и локальной физикальной симптоматики соответствует клинической картине, присущей ОБ вирусной этиологии. При наличии у пациента фебрильной лихорадки и/или ознобов, гнойного характера мокроты, боли в груди, усиливающейся на вдохе/кашле, тахипноэ, а также при наличии локальной физикальной симптоматики (укорочение перкуторного звука, бронхиальное дыхание, феномен крепитации, влажные хрипы и др.) следует склониться в пользу диагноза внебольничной пневмонии. Тем не менее абсолютное большинство пациентов демонстрирует некую усредненную клиническую картину, и им практически всегда назначается АБ-терапия. Однако, по результатам последних многоцентровых исследований, известно, что гнойный бронхиальный секрет является плохим предиктором бактериальной инфекции [4].
Диагностика острого бронхита
Большинство больных с остро возникшем кашлем требуют не более чем врачебного осмотра и назначения симптоматического лечения. Показаниями для проведения рентгенологического исследования при жалобах на остро возникший кашель с целью исключения диагноза пневмонии является выявление в ходе осмотра пациента тахикардии (> 100 уд./мин), одышки (> 24 в мин), или температуры тела > 38 °C, либо выслушивание при аускультации влажных мелко- и крупнопузырчатых хрипов на вдохе и выдохе, а также крепитирующих хрипов на вдохе на стороне поражения (шум трения плевры) [16, 17]. Недавно к списку пациентов, нуждающихся в проведении рентгенологического обследования, были добавлены больные с клиническими признаками развития инфекции, проживающие в эпидемиологически неблагоприятных регионах в отношении тяжелого острого респираторного синдрома. Рентгенологическое исследование может оказаться необходимым и больным гриппом, а также пациентам пожилого и старческого возраста.
Обычно у пациентов с простудными заболеваниями в 3/4 случаев кашель исчезает за 14 дней [18]. Длительный кашель у пациентов с диагностированным ОБ может быть вызван развитием вирусной инфекции, а также M. pneumoniae-, C. pneumoniae- или B. pertussis-инфекцией. Но при жалобах на пароксизмы кашля с рвотой или без нее диагностический алгоритм обследования в первую очередь должен быть направлен на исключение коклюша даже несмотря на наличие в анамнезе проведенной иммунизации.
Диагностические процедуры, направленные на выявление M. pneumoniae, предполагают определение микоплазмы культуральным методом из фарингеальных смывов эпителиальных клеток носоглотки, а также увеличение титра иммуноглобулина M, обычно отмечаемое через 7 дней заболевания [19]; возможно выявление антигена с помощью полимеразной цепной реакции (ПЦР-диагностики) [20] и, наконец, определение титра антител в реакции холодовой агглютинации ≥ 1:64 (неспецифический титр). Стоит отметить, что до настоящего времени ни один из приводимых выше тестов не был признан в качестве стандарта для диагностики микоплазменной инфекции в ходе проводившегося совещания экспертов Американского центра по контролю за заболеваемостью (CDC) [21].
CDC определил следующие диагностические критерии C. рneumoniae-инфекции: ≥ 4-кратное повышение титра в реакции микроиммунофлюоресценции (MIF) (в исследовании используются образцы, полученные от пациента при обращении и спустя ≥ 3 нед), или положительный результат ПЦР-диагностики, причем важным является использование реактивов во время проведения одного из четырех исследований — полностью приготовленных на месте проведения исследования — без закупаемых реагентов [22, 23].
Диагностика коклюша базируется на культуральной методике с использованием образца откашливаемой мокроты, назофарингеальных аспиратов [24] с последующим посевом либо на результатах ПЦР-диагностики [25]. Однако культуральная диагностика является относительно низкочувствительной методикой, а проведение ПЦР-исследования доступно не всегда.
К настоящему моменту существуют тесты экспресс-диагностики вируса гриппа. Чувствительность этих тестов примерно сопоставима с клинической диагностикой, основанной на выявлении при осмотре у больного лихорадки, «типичной симптоматики», знании эпидемиологической ситуации в регионе. Предлагаемые три тест-системы (средняя стоимость одного исследования — 10–15 у. е.) позволяют получить результат в интервале от 10 до 20 мин, при чувствительности методики 70% [26].
В связи с вышесказанным на сегодняшний день довольно часто врачи сталкиваются с трудностями в диагностике коклюша, микоплазмы, хламидии — как этиологических агентов ОБ. Сходная ситуация наблюдается и в отношении вируса гриппа. Культуральные исследования мокроты у пациентов в отсутствие рентгенологических признаков пневмонической инфильтрации не выполняются, так как бактериальная флора не является патогенетически значимым агентом ОБ.
Диагностические исследования с целью исключения постназального затека, астмы, эзофагогастрального рефлюкса следует проводить в тех случаях, когда по результатам проведенного врачебного осмотра выявляются особенности клинической картины заболевания либо при наличии у пациента кашля продолжительностью более 15 дней.
Лечение острого бронхита
Противовирусная терапия. Вирусы гриппа А и В являются одними из наиболее актуальных возбудителей ОБ, в связи с чем требуется назначение противовирусной терапии. Необходимо отметить, что противовирусные препараты целесообразно назначать в случаях, если с момента появления симптомов заболевания прошло не более 48 ч.
В настоящее время используются две группы противовирусных препаратов — блокаторы М2-каналов (амантадин, римантадин) и ингибиторы нейроаминидазы (занамивир, осельтамивир); кроме того, при определенных ситуациях возможно применение рибавирина, активного в отношении респираторно-синцитиального вируса (табл. 1).
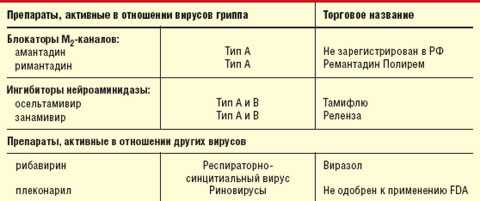
|
|
Таблица 1 Противовирусные препараты, применяющиеся для лечения респираторных вирусных инфекций |
К блокаторам М2-каналов (адамантаны) относят амантадин и римантадин. Оба препарата активны в отношении вируса гриппа типа А и неактивны в отношении гриппа типа B. Амантадин в России не применяется, но широко используется римантадин, созданный на его основе: он обладает большей активностью и менее токсичен. Противовирусный эффект реализуется за счет блокирования ионных каналов (М2) вируса, сопровождающегося нарушением его способности проникать в клетки и высвобождать рибонуклеопротеид. Тем самым ингибируется стадия репликации вирусов. При профилактическом использовании эффективность римантадина составляет 70–90%. Однако необходимо отметить существенное повышение резистентности вируса гриппа к этим препаратам за последние 3 года (с 1,9% в 2004 г. до 91% в 2006 г. на территории США), что послужило причиной ограничения их применения в качестве средств профилактики и терапии инфекции. К недостаткам римантадина также необходимо отнести опасность возникновения тяжелых нежелательных явлений со стороны центральной нервной системы (раздражительность, нарушение концентрации внимания, бессонница), встречающихся у 3–6% пациентов. Кроме того, отмечены нежелательные реакции со стороны желудочно-кишечного тракта (тошнота, снижение аппетита). Препарат следует с осторожностью применять у пожилых, при тяжелых нарушениях функции печени, а также у лиц с повышенной судорожной готовностью (эпилепсия).
С лечебной целью препарат назначается не позднее 2 сут от появления первых симптомов заболевания. Длительность курса при этом не должна превышать 5 дней во избежание появления резистентных форм вируса.
Ингибиторы нейроаминидазы. Нейроаминидаза (сиалидаза) — один из ключевых ферментов, участвующих в репликации вирусов гриппа типов А и В. При ингибировании нейроаминидазы нарушается способность вирусов проникать в здоровые клетки, снижается их устойчивость к защитному действию секрета дыхательных путей и таким образом тормозится дальнейшее распространение вируса в организме. Кроме того, ингибиторы нейроаминидазы способны уменьшать продукцию цитокинов (интерлейкин-1 и фактора некроза опухоли), препятствуя развитию местной воспалительной реакции и ослабляя такие системные проявления вирусной инфекции, как лихорадка, боли в мышцах и суставах, потеря аппетита.
Осельтамивир (капсулы по 75 мг) применяется для лечения и профилактики гриппа у взрослых пациентов (старше 18 лет). Согласно результатам контролируемых клинических исследований препарат достоверно уменьшает продолжительность симптомов заболевания, тяжесть его течения, частоту осложнений. При профилактическом назначении эффективность осельтамивира составляет 75%. Наиболее часто (10–12% случаев) при приеме препарата отмечаются тошнота и рвота, реже (1–2,5% случаев) наблюдаются головные боли, головокружение, слабость, бессонница, боли в животе, диарея, заложенность носа, боли в горле, кашель. В большинстве случаев нежелательные реакции не требуют отмены препарата. Осельтамивир назначается по 75–150 мг 2 раза в день в течение 5 дней. У пациентов с клиренсом креатинина менее 30 мл/мин доза снижается в 2 раза.
Занамивир является структурным аналогом сиаловой кислоты — естественного субстрата нейроаминидазы вирусов гриппа — и, следовательно, обладает способностью конкурировать с ней за связывание с активными центрами фермента. Из-за низкой биодоступности при приеме внутрь занамивир используется ингаляционно, в этом случае его биодоступность составляет около 20%. Занамивир рекомендуется для лечения неосложненного гриппа у лиц старше 12 лет при сроке появления клинических симптомов не более 36 ч. Препарат достоверно сокращает продолжительность заболевания, улучшает состояние больных, предупреждает развитие осложнений у пациентов с гриппом, вызванным как вирусом типа А, так и вирусом типа В. Эффективность профилактического использования занамивира составляет 70–80%. В большинстве случаев занамивир хорошо переносится пациентами. Нежелательные реакции отмечаются только в 1,5% случаев. Наиболее характерными из них являются головная боль, головокружение, тошнота, диарея, явления синусита, першение в горле, бронхоспазм.
Определенные перспективы были связаны с появлением препарата плеконарил [26]. Однако в 2002 г. комитет по антивирусным препаратам Управления по контролю за пищевыми продуктами и лекарственными препаратами США (FDA) по ряду причин отклонил санкцию на применение плеконарила [27].
Антибактериальная терапия. Учитывая тот факт, что в структуре всех инфекций нижних дыхательных путей пневмония занимает примерно 5% (ОБ — около 70%), назначение АТ больным острой респираторной инфекцией неоправдано как с клинической, так и с экономической точек зрения. Необходимо помнить и о возрастающем уровне устойчивости микроорганизмов к антибиотикам.
В настоящее время единственной клинической ситуацией, при которой оправдано назначение антибиотиков пациенту с острым кашлем, является подозрение на коклюш. Рекомендуется назначать эритромицин по 0,25–0,5 г 4 раза в сутки на протяжении 14 дней или новые макролиды — азитромицин и кларитромицин [35].
Другие направления терапии. В настоящее время опубликованы результаты исследований, продемонстрировавших эффективность сальбутамола и фенотерола в лечении пациентов с ОБ. Было доказано, что применение данных препаратов сопровождается уменьшением продолжительности кашля.
В случаях интенсивного, влияющего на качество жизни кашля показано симптоматическое лечение. Выбор противокашлевого препарата должен проводиться индивидуально с учетом механизма действия, противокашлевой активности препарата, риска возникновения побочных эффектов, наличия сопутствующей патологии и возможных противопоказаний. Необходимо отметить, что при остром и непродолжительном кашле в рамках острой вирусной респираторной инфекции противокашлевый эффект декстрометорфана и препаратов, содержащих кодеин, минимален. И, напротив:эффект данных препаратов очевиден при длительном кашле или ОБ, развившемся на фоне хронических бронхолегочных заболеваний.
Классификация противокашлевых препаратов
- Средства центрального действия:
- морфиноподобные соединения (кодеин);
- ненаркотические противокашлевые препараты (преноксдиазин, окселадин, бутамират, глауцин).
- Средства периферического действия (препараты, обладающие местноанестезирующей активностью, обволакивающие средства, некоторые эфирные масла).
- Комбинированные препараты.
При кашле с отхождением вязкой мокроты используют муколитические средства: амброксол, ацетилцистеин (табл. 2). Механизм действия этих средств основан на удалении бронхиального секрета из дыхательных путей за счет снижения его вязкости, но при увеличении объема мокроты. Отхаркивающие препараты усиливают секрецию слизи за счет рефлекторного раздражения желез слизистой бронхов. В частности, амброксол оказывает наряду с бронхосекретолитическим также секретомоторное действие. Йодиды и ряд растительных препаратов (тимьян, росянка, термопсис и др.) оказывают прямое действие на секреторные бронхиальные клетки и выделяются в просвет бронхиального дерева, усиливая при этом секрецию слизи и увеличивая ее объем. Кроме того, они активируют моторную функцию бронхиол и реснитчатого эпителия слизистой бронхов.
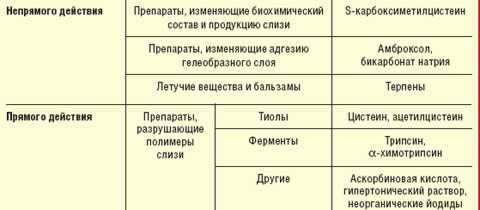
|
|
Таблица 2 Классификация муколитических препаратов |
Обычно прием муколитиков при ОБ составляет не более 3–4 дней [36].
Применяются также препараты растительного происхождения, оказывающие как секретолитическое, так и бронхолитическое действие (Бронхипрет). Самым применяемым при кашле лекарственным растением является солодка. Помимо противокашлевого, она обладает отхаркивающим и спазмолитическим эффектами, усиливает секрецию защитной слизи. Солодка входит в состав грудных сборов № 2–4, таблеток Прополис с солодкой, грудного эликсира и др. Возможно использование и немедикаментозных вмешательств, например паровых ингаляций.
Литература
- Синопальников А. И. Острый бронхит у взрослых // Атмосфера. Пульмонология и аллергология. 2005. №3. С. 15-20.
- Gonzales R., Sande M. What will it take to stop physicians from prescribing antibiotics in acute bronchitis? // Lancet. 1995; 345: 665.
- Gonzales R., Steiner J. F., Sande M. A. Antibiotic prescribing for adults with colds, upper respiratory tract infections, and bronchitis by ambulatory care physicians [see comments] // JAMA. 1997; 278: 901.
- Gonzales R., Steiner J. F., Lum A., Barrett P. H. Jr. Decreasing antibiotic use in ambulatory practice: impact of a multidimensional intervention on the treatment of uncomplicated acute bronchitis in adults // JAMA. 1999; 281: 1512.
- Falsey A. R., Erdman D., Anderson L. J., Walsh E. E. Human metapneumovirus infections in young and elderly adults // J. Infect. Dis. 2003; 187: 785.
- Boldy D. A., Skidmore S. J., Ayres J. G. Acute bronchitis in the community: Clinical features, infective factors, changes in pulmonary function and bronchial reactivity to histamine // Respir. Med. 1990; 84: 377.
- Jonsson J. S., Sigurdsson J. A., Kristinsson K. G. et al. Acute bronchitis in adults. How close do we come to its aetiology in general practice? // Scand J. Prim Health Care. 1997; 15: 156.
- MacKay D. N. Treatment of acute bronchitis in adults without underlying lung disease // J. Gen. Intern. Med. 1996; 11: 557.
- Denny F. W., Clyde W. A. Jr, Glezen W. P. Mycoplasma pneumoniae disease: clinical spectrum, pathophysiology, epidemiology, and control // J. Infect. Dis. 1971; 123: 74.
- Wadowsky R. M., Castilla E. A., Laus S. et al. Evaluation of Chlamydia pneumoniae and Mycoplasma pneumoniae as etiologic agents of persistent cough in adolescents and adults // J. Clin. Microbiol. 2002; 40: 637.
- Foy H. M., Kenny G. E., Cooney M. K., Allan I. D. Long-term epidemiology of infections with Mycoplasma pneumoniae // J. Infect. Dis. 1979; 139: 681.
- Grayston J. T., Kuo C. C., Wang S. P., Altman J. A new Chlamydia psittaci strain, TWAR, isolated in acute respiratory tract infections // N. Engl. J. Med. 1986; 315: 161.
- Grayston J. T., Diwan V. K., Cooney M. et al. Community- and hospital-acquired pneumonia associated with Chlamydia TWAR infection demonstrated serologically // Arch. Intern. Med. 1989; 149: 169.
- Nennig M. E., Shinefield H. R., Edwards K. M. et al. Prevalence and incidence of adult pertussis in an urban population // JAMA. 1996; 275: 1672.
- Gonzales R., Sande M. A. // Ann. Intern. Med. 2000; 133: 981.
- Snow V., Mottur-Pilson C., Gonzales R. Principles of appropriate antibiotic use for treatment of acute bronchitis in adults // Ann. Intern Med 2001; 134: 518.
- Gonzales R., Bartlett J. G., Besser R. E. et al. Principles of appropriate antibiotic use for treatment of uncomplicated acute bronchitis: background // Ann. Intern. Med. 2001; 134: 521.
- Dingle J. H., Badger G. F., Jordan W. S. Jr. Illness in the home: A study of 25,000 illnesses in a group of Cleveland families. The Press of Western Reserve University. Cleveland. 1964; P. 68.
- Uldum S. A., Jensen J. S., Sondergard-Anderson J. et al. Enzyme immunoassay for detection of immunoglobulin M (IgM) and IgG antibodies to Mycoplasma pneumoniae // J. Clin. Microbiol. 1992; 30: 1198.
- Dular R., Kajioka R., Kasatiya S. Comparison of Gen-Probe commercial kit and culture technique for the diagnosis of Mycoplasma pneumoniae infection // J. Clin. Microbiol. 1988; 26: 1068.
- Bartlett J. G., Dowell S. F., Mandell L. A. et al. Practice guidelines for the management of community-acquired pneumonia in adults. Infectious Diseases Society of America // Clin. Infect. Dis. 2000; 31: 347.
- Dowell S. F., Peeling R. W., Boman J. et al. Standardizing Chlamydia pneumoniae assays: recommendations from the Centers for Disease Control and Prevention (USA) and the Laboratory Centre for Disease Control (Canada) // Clin. Infect. Dis. 2001; 33: 492.
- Gaydos C. A., Quinn T. C., Eiden J. J. Identification of Chlamydia pneumoniae by DNA amplification of the 16S rRNA gene // J. Clin. Microbiol. 1992; 30: 796.
- Hoppe J. E. Methods for isolation of Bordetella pertussis from patients with whooping cough // Eur. J. Clin. Microbiol. Infect .Dis. 1988; 7: 616.
- Meade B. D., Bollen A. Recommendations for use of the polymerase chain reaction in the diagnosis of Bordetella pertussis infections // J. Med. Microbiol. 1994; 41: 51.
- Новый препарат плеконарил может стать одним из основных средств для лечения и профилактики ОРВИ. Доступно на: http://www.antibiotic.ru/index.php?article=334
- FDA признало непригодным плеконарил для лечения простудных заболеваний. Доступно на: http://www.antibiotic.ru/index.php?article=398
- Ершов Ф. И., Касьянова Н. В., Полонский В. О. Возможна ли рациональная фармакотерапия гриппа и других ОРВИ? // Инфекция и антимикробная терапия. 2003. №6. Т. 5. С. 56-59.
- Страчунский Л. С., Козлов С. Н. Противовирусные препараты, применяемые при респираторных инфекциях // РМЖ. 2001. Т. 3. №1-2. 6. РМЖ. Т. 9. №16-17.
- Belshe R. B., Burk B., Newman F. et al. Resistance of influenza A virus to amantadine and rimantadine: results of one decade of surveillance // J. Infect. Dis. 1989; 159: 430-435.
- Calfee D. P., Hayden F. G. New approches to influennza chemotherapy. Neuraminidase inhibitors. Drugs. 1998; 56: 537-553.
- Romero JR. Pleconaril: a novel antipicornaviral drug. Expert Opin Investig Drugs. 2001 Feb;10(2): 369-79.
- Lee P. Y., Matchar D. B., Clemens D. A., Huber J., Hamilton J. D. et al. Economic analysis of influenza vaccination and antiviral treatment for healthy working adults // Annals of Internal Medicine. 2002; 137: 225-231.
- Pevear D. C., Tull T. M., Siepel M. E., Groarke J. M. Activity of pleconaril against enteroviruses // Antimicrob. Agents Chemother. 1999; 43: 2109-2115
- Snow V., Mottur-Pilson C., Gonzales R. Principles of appropriate antibiotic use for treatment of acute bronchitis in adults // Ann. Intern. Med. 2001; 134: 518-20.
- Синопальников А. И., Клячкина И. Л. Муколитики и отхаркивающие средства // Рациональная фармакотерапия заболеваний органов дыхания. М.: Литерра, 2004.
М. Б. Миронов, кандидат медицинских наук
А. А. Зайцев, кандидат медицинских наук
А. И. Синопальников, доктор медицинских наук, профессор
ГИУВ МО РФ, Москва
