Влияние различных видов терапии на качество жизни детей с бронхиальной астмой
Cегодня одной из глобальных проблем мирового здравоохранения становится бронхиальная астма (БА). Согласно данным Международного конгресса по астме (США, 2004), в мире зарегистрировано более 300 млн пациентов с этой болезнью. БА является наиболее распространенным хроническим заболеванием детского возраста, частота которого в развитых странах составляет 4—12%. В России распространенность БА среди детей достигает 5—10% [1].
В настоящее время БА рассматривается как хроническое воспалительное заболевание дыхательных путей [2], которое проявляется:
- обратимой обструкцией дыхательных путей, возникающей вследствие спазма гладкой мускулатуры бронхов, отека слизистой оболочки, инфильтрации подслизистой оболочки воспалительными клетками, гиперсекреции слизи, утолщения базальной мембраны;
- эпизодами кашля, свистящих хрипов, экспираторной одышки, которые, как правило, бывают связаны с воздействием специфических триггерных факторов и возникают преимущественно в ночное время или ранним утром;
- повышенной гиперреактивностью дыхательных путей.
Для БА характерны прогрессирующее развитие хронического воспалительного процесса в дыхательных путях, а также склонность к рецидивирующему течению. Поэтому основными целями терапии БА у детей являются [3, 4]:
- достижение и поддержание контроля над симптомами болезни;
- предотвращение обострения БА;
- поддержание функции легких, по возможности близкой к нормальным величинам;
- поддержание качества жизни больного с обеспечением непрерывности обучения в школе, нормального физического развития;
- исключение побочных эффектов противоастматических средств;
- предотвращение связанной с БА смертности.
Хронический характер течения БА, необходимость длительной фармакотерапии, невозможность выполнения определенных видов физических нагрузок, ограничения в выборе профессии и социальной активности оказывают существенное негативное влияние на качество жизни детей с БА [5, 6, 7, 8, 9].
Оценка качества жизни в медицине зачастую является конечным критерием оценки эффективности лечения, выбора препарата, успешности реабилитационных мероприятий. Это, несомненно, согласуется с провозглашенной ВОЗ концепцией непрерывного совершенствования качества медицинской помощи.
Главной целью терапии астмы сегодня является достижение и поддержание контроля над заболеванием — достижение следующих показателей:
- минимальная выраженность (в идеале - отсутствие) хронических симптомов, включая ночные;
- минимальные (нечастые) обострения;
- отсутствие необходимости в скорой и неотложной помощи;
- минимальная потребность (в идеале - отсутствие) в применении β2-агониста (по мере необходимости);
- отсутствие ограничений активности, в том числе физической;
- суточные колебания пиковой скорости выдоха (ПСВ) менее 20 %;
- нормальные (близкие к нормальным) показатели ПСВ;
- минимальная выраженность (или отсутствие) нежелательных эффектов от лекарственных препаратов.
Неадекватное лечение БА у детей приводит к сохранению воспалительных изменений в бронхах с персистенцией бронхиальной обструкции, утяжелением течения заболевания.
Согласно данным исследования AIRE (Asthma Insights and Reality in Europe), проведенного в семи западноевропейских странах для оценки качества лечения астмы у 2800 взрослых и детей с БА различной степенью тяжести, только у 5% пациентов достигнут контроль над заболеванием.
По данным исследования GOAL [12], пациенты, страдающие БА, имеют заниженные представления об уровне возможного контроля над заболеванием и готовы примириться с низким качеством жизни и недостаточно эффективным лечением. Также в данном исследовании было установлено, что основное влияние на качество жизни пациентов с БА оказывает отсутствие контроля над астмой, независимо от степени тяжести заболевания.
В рамках многоцентрового популяционного исследования ИКАР (Исследование качества жизни в России, 2004) выявлена зависимость большинства параметров качества жизни детей, страдающих БА, от демографических показателей (пол и возраст ребенка, профессиональная занятость, образование, семейный статус родителей), от выраженности симптомов заболевания и степени контроля над ним. При этом впервые были определены среднепопуляционные значения показателей качества жизни здоровых детей РФ [13].
Поскольку в настоящее время не существует методов и лекарственных средств, способных полностью излечить БА, изучение влияния терапии на качество жизни детей, страдающих БА, является очень актуальным.
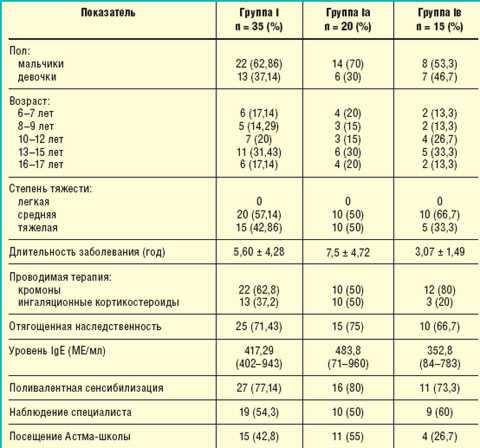
С этой целью в отделении стационарозамещающих технологий ГУ НЦЗД РАМН было обследовано 35 детей (группа I) в возрасте от 6 до 18 лет с установленным диагнозом БА. Клиническая характеристика пациентов представлена в табл. 1.
|
|
Таблица 1. Клиническая характеристика пациентов группы I |
При поступлении все пациенты не имели контроля над заболеванием, т. е. в течение последних 4 нед до начала обследования отмечались обострения БА, среднее значение которых составило 5,71 ± 2,39, при этом 19 пациентов (54,3%) имели более 4 обострений в месяц. У 26 пациентов (74,3%) отмечались ночные симптомы заболевания, среднее значение составило 2 ± 1,98. Средняя потребность в применении β2-агонистов короткого действия в сутки за последнюю неделю составила 2,11 ± 0,85 ингаляции. Среднее значение показателя объема форсированного выдоха за 1 с (ОФВ1) равнялось 78,7 ± 2,88%, а суточной лабильности бронхов — 22,6 ± 3,83%.
В отделении было проведено комплексное обследование, включавшее общеклиническое обследование (клинический анализ крови, общий анализ мочи, исследование функции внешнего дыхания, рентгенологическое исследование органов грудной клетки, УЗИ органов брюшной полости, ЭКГ), аллергологическое (сбор данных аллергологического анамнеза, постановка кожных скарификационных проб с аллергенами, определение общего уровня иммуноглобулина (Ig) E), уровней IgG, IgA, IgM.
Для оценки качества жизни детей использовался «Вопросник оценки статуса здоровья детей» (а также русифицированный аналог вопросника Child Health Questionnaire). Проводилось одновременное, но раздельное анкетирование детей и взрослых. Все детские формы вопросника заполнялись в ходе интервью, родители заполняли вопросник самостоятельно. В качестве специализированного вопросника для оценки качества жизни детей с БА была использована официальная русскоязычная версия PAQLQ.
Всем пациентам данной группы была назначена базисная противовоспалительная терапия в дозировках, адекватных степени тяжести заболевания. В зависимости от вида противовоспалительной терапии дети были разделены на две подгруппы: Iа — 20 пациентов, которые получали комбинированный препарат Серетид (содержащий ингаляционный кортикостероид флутиказона пропионат и длительно действующий β2-агонист салметерола ксинафоат), и Iв — 15 пациентов, получавших только ингаляционный кортикостероид беклометазона дипропионат в виде монотерапии (см. табл. 1).
На фоне назначенной противоастматической терапии были отмечены следующие изменения в клиническом течении болезни. У 55% пациентов подгруппы Iа через 1 мес лечения комбинированным препаратом Серетидом был достигнут контроль над заболеванием, у остальных 45% больных отмечались достоверное (по сравнению с исходными значениями) уменьшение количества обострений, ночных симптомов и снижение потребности в приеме β2-агонистов быстрого действия (p < 0,05). Через 3 мес проводимой терапии 95% подгруппы Iа, получавшие Серетид, достигли контроля над заболеванием. При этом в течение указанного периода у них отмечалось минимальное количество обострений БА (в среднем 0,35 ± 0,18), у 75% пациентов они отсутствовали, минимальной была потребность в β2-агонистах короткого действия (в среднем 0,03 ± 0,01), у всех пациентов отсутствовали ночные симптомы, показатель ОФВ1 превышал 80% от должных значений (в среднем 90,65 ± 3,94%), а суточная лабильность бронхов не превышала 10% (в среднем 3,7 ± 1,97%).
В то же время только 33,3% пациентов подгруппы Iв, получавшие монотерапию ингаляционным кортикостероидом беклометазона дипропионатом, достигли контроля над заболеванием через 1 мес и 80% — через 3 мес. За последние 4 нед до повторного обследования у пациентов отмечались обострения БА (в среднем 1,4 ± 0,9), также наблюдались ночные симптомы (среднее значение составило 0,66 ± 0,32). Средняя потребность в применении β2-агонистов короткого действия за последнюю неделю составила 0,36 ± 0,24 ингаляции в сутки. При этом у всех пациентов показатель ОФВ1 достигал 80% и более от должных значений (в среднем 83,86 ± 1,92%), а среднее значение суточной лабильности — 13,2 ± 5,27%. Следует отметить, что все указанные показатели через 3 мес лечения имели значимую положительную динамику по сравнению с исходными значениями.
При оценке качества жизни пациентов подгруппы Iа через 3 мес по «Вопроснику оценки статуса здоровья детей» было выявлено достоверное повышение всех показателей, характеризующих физический и психосоциальный статусы, по сравнению с исходными значениями (p < 0,05). Данные показатели достигали среднепопуляционных значений. При оценке качества жизни пациентов подгруппы Iв также было выявлено повышение показателей, характеризующих физический статус (p < 0,05), однако не наблюдалось достижения среднепопуляционных значений. При анализе показателей, характеризующих психосоциальный статус, отмечалось их достоверное повышение и достижение среднепопуляционных значений (p < 0,05).
Несмотря на то, что показатели качества жизни пациентов обеих подгрупп через 3 мес от начала терапии были достоверно выше исходных, при их сравнении нами было отмечено, что пациенты, получавшие Серетид, имеют статистически более значимое повышение показателей физического статуса по сравнению с пациентами подгруппы Iв (p < 0,05). Из показателей, отражающих психосоциальный статус, достоверное различие было получено в отношении показателя «самооценка», когда у пациентов подгруппы Iа отмечалось статистически более значимое повышение удовлетворенности своими способностями, внешним видом и взаимоотношениями по сравнению с пациентами подгруппы Iв.
При повторном анкетировании родителей пациентов обеих подгрупп отмечалось статистически достоверное повышение показателей, характеризующих физический и психосоциальный статусы детей. При этом у пациентов подгруппы Iа показатели, характеризующие физический статус, были достоверно выше, чем в подгруппе Iв. В то же время показатели психосоциального статуса у пациентов обеих подгрупп не имели статистических различий. На фоне проводимой детям терапии у родителей в обеих подгруппах отмечалось улучшение эмоционального состояния, увеличение свободного времени, в подгруппе Iа данные показатели были достоверно выше, чем в подгруппе Iв (p < 0,05).
При оценке специфического качества жизни у пациентов подгруппы Iа (PAQLQ) через 3 мес от начала терапии комбинированным препаратом Серетидом отмечено статистически достоверное улучшение двигательной активности, эмоциональной сферы, уменьшение симптомов БА и возрастание интегративного показателя «общее качество жизни». Данные изменения свидетельствовали об уменьшении влияния БА на качество жизни пациентов. У пациентов подгруппы Iв, получавших в течение 3 мес беклометазона дипропионат, также отмечалось достоверное повышение показателя, характеризующего физическую активность, уменьшение выраженности симптомов БА, однако статистически значимого уменьшения влияния БА на эмоциональную сферу пациентов и повышения интегративного показателя «общее качество жизни» выявлено не было (p > 0,05).
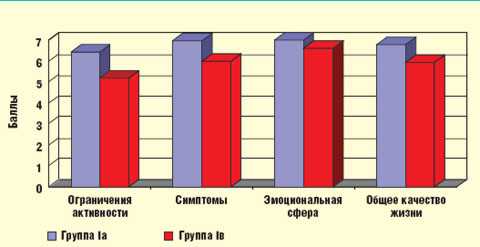
Необходимо отметить, что при сравнении показателей специфического качества жизни пациентов обеих подгрупп (рис.) было выявлено достоверное повышение показателей, отражающих объем повседневной активности, выраженность основных симптомов БА, а также интегративного показателя качества жизни у пациентов, получавших комбинированную терапию Серетидом (p < 0,05).
|
| Рисунок. Показатели специфического качества жизни пациентов группы I |
Таким образом, можно сделать вывод, что качество жизни пациентов, страдающих БА, зависит от вида проводимой противовоспалительной терапии. Назначение современных комбинированных препаратов (Серетид) способствует более быстрому достижению контроля над заболеванием и улучшению качества жизни пациентов и их родителей по сравнению с монотерапией ингаляционными кортикостероидами (беклометазона дипропионат).
Дети, страдающие аллергическими заболеваниями, особенно БА, нуждаются в защите от острых респираторных инфекций (ОРИ), поскольку многочисленными исследованиями установлено, что респираторные, особенно вирусные, инфекции могут приводить к обострениям и неконтролируемому течению БА [3, 17, 18]. По данным ВОЗ, в 6% случаев грипп является причиной летальных исходов, около 60% случаев смерти связано с вирусассоциированными болезнями, такими как пневмонии, бронхиты, синуситы, отиты, энцефалопатия, БА.
Грипп особенно опасен для детей и взрослых с хроническими болезнями, особенно для детей, длительно получающих кортикостероиды, существенно ухудшая состояние бронхов, затрудняя наступление ремиссии [19, 20].
Несмотря на то что по рекомендации ВОЗ все пациенты с БА должны ежегодно быть вакцинированы против гриппа независимо от формы и тяжести течения заболевания и проводимой лекарственной терапии, на практике это пока не осуществляется. Единственным противопоказанием для прививок против гриппа является наличие в анамнезе тяжелых аллергических реакций на белок куриного яйца [22].
В настоящее время БА является прямым показанием для иммунизации против гриппа, особенно детей, так как эти пациенты являются группой особого риска по развитию осложнений после гриппа [23].
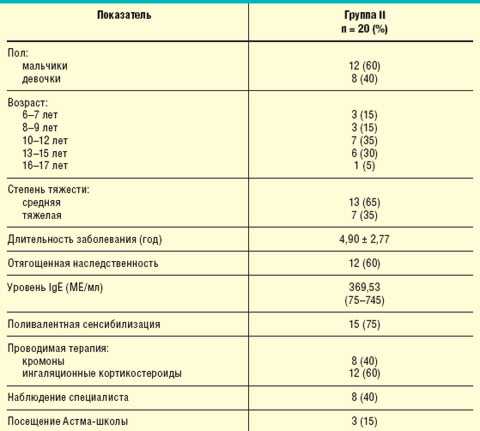
Для оценки влияния современных схем иммунопрофилактики ОРИ и гриппа на качество жизни детей, страдающих БА, нами было обследовано 20 детей с установленным диагнозом БА, у которых в анамнезе отмечались частые ОРИ, провоцировавшие обострения астмы. Данные пациенты составили группу II, их клиническая характеристика представлена в табл. 2.
|
|
Таблица 2. Клиническая характеристика пациентов группы II |
При анализе частоты ОРИ и обострений астмы за прошедший год было отмечено, что каждая ОРИ вызывала обострение БА (8,05 ± 0,82 за год, ежемесячно в осенне-зимне-весенний период).
Все пациенты данной группы за последние 4 нед до начала обследования не имели контроля над заболеванием, т. е. за указанный период у них отмечались обострения БА, среднее значение которых составило 3,9 ± 0,55. Средняя потребность в применении β2-агонистов короткого действия в сутки за последнюю неделю составила 0,65 ± 0,24 ингаляции; среднее значение показателя ОФВ1 — 79,65 ± 6,12%, а суточной лабильности бронхов — 12,75 ± 4,69%.
Пациентам была назначена базисная противовоспалительная терапия комбинированным препаратом Серетидом в дозировках, адекватных степени тяжести заболевания. Вакцинация от гриппа современной вакциной Инфлювак была проведена через 3 мес от начала противоастматической терапии, при достижении всеми пациентами контроля над БА. Местных и общих реакций на введение вакцины Инфлювак у пациентов не было. В течение 2 нед после вакцинации пациенты данной группы находились под нашим наблюдением, обострений основного заболевания не отмечалось. Суточная лабильность бронхов (по данным пикфлоуметрии, регистрируемых в индивидуальных дневниках самоконтроля) не превышала 20%. Помимо противогриппозной вакцинации всем пациентам проводилась терапия бактериальными вакцинами (Рибомунил, ИРС 19) в виде основного и поддерживающих курсов. Лечение Рибомунилом детям проводилось по стандартной схеме: 3 таблетки в день, принимаемые утром, натощак. В первый месяц лечения препарат принимается 4 дня в неделю в течение 3 нед (основной курс). В последующие 5 мес — 4 дня в месяц (поддерживающий курс). Иммунотерапия проводилась в осенне-зимний период (с сентября—октября по март—апрель).
Бактериальная вакцина ИРС 19 с профилактической целью вводилась по 1 инстилляции в каждый носовой ход 2 раза в день в течение 1 мес, при присоединении ОРИ — по 1 инстилляции 3—4 раза в день до исчезновения симптомов, после чего переходили на профилактическую дозу (2 раза в день).
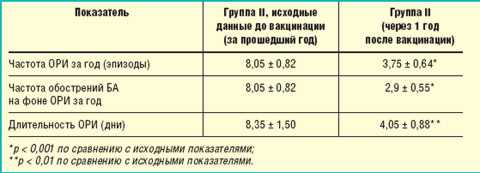
Для оценки влияния противогриппозной вакцинации (Инфлювак) в сочетании с бактериальными вакцинами (Рибомунил, ИРС 19) на течение БА нами учитывались следующие показатели: частота и продолжительность ОРИ, необходимость применения для их лечения антибактериальных препаратов, а также количество обострений астмы на фоне ОРИ за прошедший год (табл. 3).
|
|
Таблица 3. Эффективность проводимой терапии |
За прошедший после вакцинации год у пациентов данной группы отмечалось достоверное снижение частоты и длительности ОРИ, а также частоты обострений БА на фоне ОРИ (p < 0,001).
Необходимо подчеркнуть, что в течение года наблюдения у 6 (30%) пациентов была пересмотрена степень тяжести заболевания, при этом у 4 (20%) детей была диагностирована легкая степень персистирующей астмы, средняя степень тяжести — у 11 пациентов (55%) и тяжелая — у 5 (25%). Вследствие пересмотра степени тяжести заболевания пациенты с легкой персистирующей астмой были переведены на кромоны (кромогликат, недокромил) (20%), у 6 пациентов (30%) была снижена дозировка ингаляционных кортикостероидов, из них у 3 (50%) — в 2 раза.
При исходном анкетировании пациентов группы II по «Вопроснику оценки статуса здоровья детей» выявлено характерное для пациентов, не имеющих контроля над БА, выраженное и статистически значимое снижение показателей, характеризующих физический и психосоциальный статусы пациентов, по сравнению со среднепопуляционными значениями (p < 0,05). Показатели, характеризующие функционирование семьи, от среднепопуляционных значений не отличались. При анкетировании пациентов через 3 мес при достижении ими контроля над заболеванием отмечено достоверное повышение показателей, характеризующих как физический, так и психосоциальный статусы пациентов. При анкетировании пациентов через 1 год при наличии длительного контроля над заболеванием достоверных различий в показателях качества жизни по сравнению с таковыми при анкетировании через 3 мес отмечено не было.
При исходном анкетировании родителей показатели, характеризующие физический и психосоциальный статусы детей, также были достоверно ниже среднепопуляционных значений (p < 0,05). Однако БА в сочетании с частыми ОРИ оказывала выраженное негативное влияние на функционирование семьи, что подтверждалось низкими показателями, характеризующими повседневную семейную активность, сплоченность семьи, эмоциональное состояние родителей и ограничение их свободного времени.
При анкетировании родителей пациентов через 3 мес отмечалось статистически достоверное повышение показателей, характеризующих физический и психосоциальный статусы детей (p < 0,05). При анкетировании родителей через 1 год наблюдалось статистически достоверное повышение показателей, характеризующих функционирование семьи, а также уменьшение эмоционального воздействия на родителей и отсутствие ограничения свободного времени по сравнению с результатами, полученными через 3 мес.
При оценке специфического качества жизни детей по «Вопроснику оценки качества жизни у детей с БА» исходно выявлено выраженное влияние БА на двигательную активность, в несколько меньшей степени на эмоциональную сферу, и в совокупности с имеющимися симптомами отмечалось снижение интегративного показателя «общее качество жизни».
При оценке специфического качества жизни пациентов через 3 мес лечения установлено достоверное повышение всех показателей по сравнению с исходными значениями. При исследовании специфического качества жизни через 1 год выраженных различий в показателях выявлено не было.
Подытоживая полученные результаты, можно сделать вывод, что вакцинация от гриппа в сочетании с терапией бактериальными вакцинами приводит к уменьшению частоты и длительности ОРИ, частоты обострений БА на фоне ОРИ, что, в свою очередь, способствует повышению качества жизни пациентов, страдающих БА. При достижении контроля над заболеванием улучшается качество жизни пациентов, которое сохраняется впоследствии при поддержании контроля и не зависит от длительности ремиссии. Однако длительность контроля над БА у детей положительно влияет на качество жизни родителей.
Таким образом, оценка качества жизни составляет одно из приоритетных направлений современной медицины, являясь неотъемлемой частью комплексного анализа новых методов диагностики, лечения и профилактики [9, 24, 25].
Литература
- Балаболкин И. И. Аллергические болезни у детей. М., 1998. 352 с.
- National Asthma Education and Prevention Program. Expert Panel Report-II: Guidelines for the Diagnosis and Management of Asthma. US Department of Health and Human Services, National Institutes of Health, Bethesda/ MD, 1997.
- Бронхиальная астма у детей: диагностика, лечение и профилактика. Научно-практическая программа. М., 2004. 46 с.
- Глобальная стратегия лечения и профилактика бронхиальной астмы (GINA), 2002. С. 89.
- Бронхиальная астма. Глобальная стратегия // Пульмонология. 1996. № 3: Приложение.
- Сенкевич Н. Ю., Белевский А. С., Чучалин А. Г. Оценка влияния образовательных программ в пульмонологии (астма-школа) на качество жизни больных БА (первый опыт применения в России опросника SF-36 в пульмонологии) // Пульмонология. 1997. № 3. С. 18-22.
- Чучалин А. Г., Белевский А. С., Смоленов И. В., Смирнов Н. А. Исследование качества жизни больных бронхиальной астмой в России // Атмосфера. 2003. Специальный выпуск, ноябрь.
- Чучалин А. Г., Сенкевич Н. Ю. Качество жизни больных: влияние бронхиальной астмы и аллергического ринита // Тер. архив. 1998. Т. 70. № 9. С. 53-57.
- Thwaites R. M. A., Price M. S. Уменьшение бремени БА: улучшение качества жизни пациентов // Пульмонология. 1998. № 3. С. 19-23.
- Theunissen N. C., Vogels T. G., Koopman H. M. The proxy problem: child report versus parent report in health-related quality of life research // Qual. Life Res. 1998; vol. 7. № 5: 387-397.
- The WHOQOL Group. The World Health Organization Quality of Life Assessment (WHOQOL): position paper from the World Health Organization // Social science and medicine. 1995; 41: 1403-1409.
- Gaining Optimal Asthma ControL (GOAL), 2002.
- Чучалин А. Г., Белевский А. С., Смоленов И. В., Сенкевич Н. Ю. Качество жизни у больных бронхиальной астмой и хронической обструктивной болезнью легких. М., 2004.
- Refabert L., Mahut B., de Blic J., Scheinmann P. Acute viral respiratory infections and asthma // Rev. Prat. 1996; Nov 1; № 46(17): 2077-2082.
- Micillo E., Bianco A., D'Auria D., Mazzarella G., Abbate G. F. Respiratory infections and asthma // Allergy. 2000; № 55. Suppl. 61: 42-45.
- Johnston S. L. Research update British lung foundation news. 2000; issue 5 (Sep); № 4.
- Бронхиальная астма у детей. Стратегия лечения и профилактика. Национальная программа, 1997. 93 с.
- Tuffaha A., Gern J., Lemanske R. The role of respiratory viruses in acute and chronic asthma // Clin. Chest. Med. 2000; № 21: 289-300.
- Таточенко В. К. О вакцинации против гриппа // Лечащий Врач. 2001. № 8. C. 20-25.
- Kathleen Maletic Neuzil. Influenza immunization worthwhile in asthmatic children // J. Pediatr. 2000; 137: 856-864.
- Таточенко В. К. Вакцинация детей против гриппа // Вопросы современной педиатрии. 2002. Т. 1. № 4. С. 44-48.
- Костинов М. П. Основы вакцинопрофилактики у детей с хронической патологией. М., 2002. С. 115.
- Shakur B. H., Branley H. M. Inactivated influenza vaccine is safe for children and adults with stable asthma // Evid. Based. Nurs. 2002; № 5: 77.
- Heady B., Wearing A. // J. Pers. Soc. Psychol. 1989; 57: 731.
- Holgate S. T., Patridge M. R. // Eur. Respir. Rev. 1995; 5: 104.
- Повышение качества жизни населения - важнейшая проблема Российской Федерации // Сборник научных статей ко II Международному форуму "Качество жизни: содружество науки, власти, бизнеса и общества", 2004. С. 3.
К. Е. Эфендиева, кандидат медицинских наук
Л. С. Намазова, доктор медицинских наук, профессор
Ю. Г. Левина, кандидат медицинских наук
И. В. Винярская, кандидат медицинских наук
НЦЗД РАМН, Москва
