Современный взгляд на диагностику и лечение эритродермических вариантов злокачественных лимфом кожи
Под лимфомами кожи (ЛК) следует понимать первично возникающую в коже злокачественную пролиферацию лимфоидных клеток или их производных — плазматических клеток. ЛК — клинически и морфологически неоднородная группа, что объясняется закономерностями опухолевой прогрессии, определяющей разнообразие проявлений ЛК, длительность и тяжесть заболеваний [9].
Диагностика ЛК, особенно эритродермических вариантов, представляет значительные трудности для клинициста и морфолога. Это объясняется, с одной стороны, внешним сходством с проявлениями некоторых доброкачественных дерматозов воспалительной природы, с другой — трудностью ранней диагностики при гистологическом исследовании кожи из-за отсутствия отчетливых признаков атипизма у пролиферирующих лимфоидных клеток. В клинической практике эритродермические формы ЛК нередко приходится дифференцировать с так называемыми вторичными эритродермиями, которые иногда осложняют течение доброкачественных воспалительных дерматозов — атопического дерматита, экземы, псориаза, красного волосяного лишая Девержи и др. Особенно затруднена клиническая диагностика эритродермий, если они возникают впервые в жизни, спонтанно, а в анамнезе у больных отсутствуют указания на перенесенный ранее дерматоз.
К наиболее часто встречающимся ЛК, протекающим по типу эритродермий, относят эритематозно-эритродермическую стадию классической формы грибовидного микоза Alibert–Bazin, эритродермическую форму грибовидного микоза Halopeau и его лейкемический вариант — синдром Сезари.
Классическая форма грибовидного микоза начинается, как правило, с зуда, жжения и покалывания кожи, легких ознобов. Зуд может быть первым проявлением заболевания и задолго предшествовать высыпаниям на коже. Степень его интенсивности различна. Чаще всего зуд бывает весьма значительным, постоянным, приводит к расстройствам сна и не купируется банальными противозудными препаратами. Общее состояние больных остается относительно удовлетворительным.
Первичные морфологические высыпания в начальной стадии заболевания обычно полиморфны, но превалируют очаги эритематозно-сквамозного характера. Процесс может локализоваться на коже всего тела, но чаще поражаются лицо и туловище. Пятна бывают разных размеров и, как правило, имеют округлые или неправильные очертания с относительно четкими границами. При генерализованной эритродермии поражение носит подостровоспалительный характер. Цвет кожи — интенсивно-розовый, часто с синюшным оттенком. У большинства больных отмечается некоторая отечность кожи. Инфильтрация кожи при развитии эритродермий в этот период заболевания либо отсутствует, либо носит очаговый характер (чаще в области разгибательных поверхностей конечностей). Эксфолиативные явления также мало выражены. Рассеянные очаги поражения эритематозного характера, как и эритродермические состояния, могут самопроизвольно разрешаться, затем вновь возникать, в течение многих лет имитируя клиническую картину доброкачественных воспалительных дерматозов: псориаза, токсикодермии, красного волосяного лишая Девержи и некоторых других. Периферические лимфатические узлы у больных в этом периоде заболевания увеличены незначительно, чаще пальпируются в паховых и подмышечных областях, что более заметно у больных с распространенным процессом.
Клинические проявления эритродермической формы (ЭФ) грибовидного микоза Hallopeau–Besnier значительно отличаются от эритродермий, которые возникают у больных классической формой грибовидного микоза в эритематозно-эритродермической стадии. Для них характерны более тяжелое течение кожного процесса, нарушение общего состояния, плохой прогноз. ЭФ грибовидного микоза начинается обычно с зуда кожи, лишающего больных покоя и сна, жжения, покалывания кожи, сильных ознобов и появления на коже туловища и конечностей эритематозно-сквамозных пятен и бляшек. Заболевание всегда сопровождается резким ухудшением общего состояния больных: ознобами, подъемами температуры до 38–39 °С, ночным потом, слабостью, потерей аппетита, похудением. При развернутой клинической картине заболевания кожа гиперемирована, иногда отечна. Цвет пораженной кожи обычно насыщенно-красный с фиолетовым (застойным) оттенком. Важным клиническим симптомом ЭФ грибовидного микоза, отличающим ее от эритродермий первой стадии классической формы, являются значительное уплотнение кожи вследствие инфильтрации, шелушение кожного покрова. При типичном течении шелушение бывает мелкопластинчатым или отрубевидным. В других случаях на фоне выраженной воспалительной реакции кожи возникает шелушение крупнопластинчатого характера, кожа покрыта многослойными чешуйко-корками и как бы пропитана экссудатом. Периферические лимфоузлы у больных ЭФ значительно увеличены, пальпируются изолированно или в виде пакетов из сгруппированных узлов, могут достигать 5–6 см в диаметре и определяться визуально. Они имеют плотноэластическую консистенцию, подвижны, не спаяны с окружающими тканями, никогда не вскрываются.
Синдром Сезари относят к редким клиническим вариантам Т-клеточных злокачественных лимфом кожи. Для этого патологического процесса характерно наличие трех главных симптомов: эритродермии, лимфоаденопатии и обнаружения в периферической крови патологических клеток, морфологической особенностью которых является складчатость ядер.
Эритродермия является основным клиническим симптомом заболевания. Цвет пораженной кожи обычно ярко-красный или застойно-синюшный. Инфильтрация, как правило, носит выраженный характер, вследствие чего кожа выглядит грубой, утолщенной и с трудом собирается в складку. По сравнению с клиническими симптомами больных ЭФ грибовидного микоза у больных с синдромом Сезари чаще и в большей степени бывают дисхромии кожи в виде гиперпигментаций и депигментаций, пойкилодермия, гиперкератозы ладоней и подошв, алопеции, ониходистрофии, эктропион. Выраженная лимфаденопатия отмечается у всех больных. Определение клеток Сезари в периферической крови в количестве более 10% — важный патогномоничный лабораторный признак, подтверждающий диагноз синдрома Сезари и являющийся важным дифференциальным критерием в сложных случаях диагностики эритродермических состояний [3].
Основными методами диагностики злокачественных лимфом кожи остаются гистологический и иммуногистохимический. Но зачастую применение этих методов является недостаточным.
В последние годы в дерматологической клинике активно используется иммунофенотипирование клеточного состава периферической крови и биоптата кожи [7].
Перспективным направлением в диагностике ранних форм злокачественных ЛК является применение молекулярно-биологических методов (полимеразная цепная реакция — ПЦР), позволяющих определить клональность процесса, и цитогенетических, способных выявить специфичные для определенных лимфом хромосомные аномалии [6].
Имеются данные об успешном использовании компьютерной морфоденситометрии для исследования изменений клеточных структур на основе морфометрических, стереометрических, денситометрических и спектрофотометрических параметров [5].
Однако многие из перечисленных методов достаточно сложны, требуют затрат времени, дорогостоящих реактивов и оборудования, поэтому внедрение их в практической деятельности врача-дерматолога невелико.
Последние годы отмечены значительными достижениями в развитии теоретических и практических основ количественной морфологии, гарантирующей наряду с быстротой и точностью высокую степень объективности в оценке состояния изучаемых биоструктур. Предложены и продолжают активно разрабатываться новые эффективные технологии, автоматические системы анализа изображений, программные продукты, ориентированные на решение проблем измерения, распознавания и классификации цитообъектов. Анализ опубликованных работ указывает на значительные успехи в становлении нового направления прикладной оптики — компьютерной микроскопии, способствующей превращению традиционной морфологии из описательной в динамическую математическую науку [1].
Современные методы количественной морфологии призваны объективизировать получаемые результаты, повысить точность измерений и гарантировать комплексный подход к решению поставленных дифференциально-диагностических задач на основе единовременного количественного анализа особенностей морфофункциональной перестройки клеток и тканей.
Одной из новых технологий является компьютерная лазерная фазово-интерференционная морфометрия (КФМ), разработанная на основе отечественного компьютерного фазово-интерференционного комплекса «Цитоскан», позволяющего анализировать морфологическую структуру и параметры как отдельных клеток, так и всей популяции в целом.
Важно отметить: современные лазерные интерферометры имеют высокую чувствительность и занимают по пространственному разрешению промежуточное положение между оптическими и растровыми электронными микроскопами. При этом они позволяют, не разрушая исследуемый цитообъект, производить измерения с точностью до десятых долей нанометра. Указанные возможности дают основание специалистам считать данные оптические системы мощным универсальным инструментом количественной цитологии и относить их к разряду новейших технологий XXI века.
Интерпретация витальных фазово-интерференционных клеточных образов достаточно сложна и крайне интересна. Полученный фазовый «портрет объекта» содержит информацию не только о его пространственных характеристиках, но и о распределении показателя оптической плотности. Характерные локальные трансформации фазового рельефа клетки могут быть вызваны внутриклеточными органеллами и включениями, обладающими различной степенью анизотропии. Кроме того, определенную роль играют концентрация, химический состав и агрегатное состояние вещества клетки. Таким образом, можно считать, что фазовые характеристики живых цитообъектов не только свидетельствуют об особенностях их морфологии, но и в значительной мере отражают состояние клеточного гомеостаза, определяющего уровень взаимоотношений энергетики, трофики и функциональной активности клетки, т. е. ее структурно-метаболическую организацию.
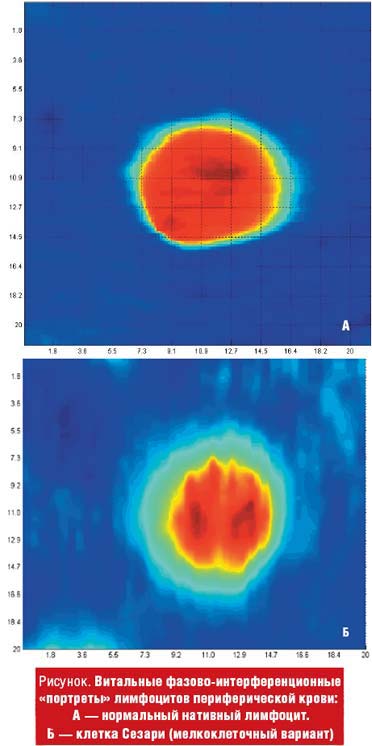
Уникальные возможности КФМ в плане изучения морфологии живых нормальных и атипичных лимфоцитов отражены на рисунке. Витальная фазометрия лимфоцитов периферической крови позволила получить новую информацию о пространственно-временном статусе (микрогеометрии поверхности, толщине слоев, показателе преломления и др.) отдельных клеток. В полученном фазовом портрете клетки можно выделить плотное ядро, где концентрация белка максимальна, и узкий ободок цитоплазмы с низким содержанием высокомолекулярных соединений, характерных для нормального нативного лимфоцита.
В клетке Сезари отчетливо определяется цереброформное ядро с неправильным контуром, характеризующееся складчатостью, глыбчатостью и неравномерным распределением хроматина. В центральной части ядра определяется расщелина (инцизия), что придает ядру бобовидную форму.
К преимуществам практического использования данного метода следует отнести возможность экспресс-анализа живых клеток, отсутствие сложной подготовки и дорогостоящих реактивов, использование универсальных критериев для оценки морфологических и функциональных показателей лимфоцитов, оперативное получение объективных данных на основе компьютерной технологии и, что не менее важно, необходимость малого объема крови.
Комплексный алгоритм КФМ обеспечивает автоматическое определение заданных параметров отдельных лимфоцитов (диаметр, периметр, высота, площадь, объем), статистическую обработку данных на популяционном уровне и документирование результатов в виде лимфоцитограмм. При этом универсальные морфометрические критерии позволяют одновременно оценить и особенности морфологии, и функциональное состояние клеток (активационный, пролиферативный и цитотоксический потенциал циркулирующих лимфоцитов), что подтверждено результатами корреляционного анализа между показателями компьютерной морфометрии и традиционной иммунограммы.
Резюмируя вышеизложенное, можно констатировать, что использование морфометрических критериев диагностики ЛК, воспроизводимых в условиях отечественной системы специализированной помощи, может способствовать изучению иммунологических аспектов данного заболевания, а также повышению эффективности диагностического процесса.
Немаловажной проблемой дерматоонкологии остается и разработка эффективных лечебных мероприятий. Следует признать, что в настоящее время клиницисты не располагают средствами терапии ЛК, с помощью которых удалось бы радикально лечить эти заболевания.
Общепринятых стандартов в терапии больных ЛК не существует. Выбор тактики лечения должен быть оптимальным и индивидуальным для каждого больного с учетом следующих факторов: возраста, клинической формы заболевания, распространенности кожного процесса, стадии его развития, морфологического и иммунофенотипического профиля опухолевых клеток.
Арсенал современных лечебных методов, применяемых в терапии больных ЛК, достаточно широк: дезинтоксикационные, противовоспалительные и десенсибилизирующие средства, а также кортикостероидные препараты.
Лечение противовоспалительными средствами показано при различных клинических вариантах ЛК, но особенно — при распространенных процессах эритродермического характера [4].
С целью дезинтоксикации могут применяться внутривенные капельные вливания Гемодеза, раствора Рингера, в который можно добавить 5% раствор хлорида кальция, препараты калия (Панангин), средства, нормализующие деятельность сердечно-сосудистой системы. В лечении больных эритродермическими формами ЛК используют препараты-ингибиторы протеаз (Гордокс и Контрикал). Теоретической предпосылкой к применению указанных средств в терапии таких больных является их способность оказывать противовоспалительное, иммуномодулирующее и антипролиферативное действие на опухолевый процесс.
Противовоспалительный эффект этих препаратов основан на нейтрализации протеазной активности, обусловленной тотальным воспалением пораженной кожи. Учитывая, что протеазы, которые накапливаются в крови и тканях при воспалительной реакции, являются крупномолекулярными белковыми соединениями и не попадают в венозную систему, лечение ингибиторами рекомендуется проводить через лимфатическую систему — интранодулярно. При таком способе введения препаратов усиливаются барьерные, метаболические, дренажные свойства тканей, что увеличивает дезинтоксикационный и противовоспалительный эффект этих средств. Гордокс вводится в дозе 100 000 ЕД, Контрикал — 20 000 ЕД в паховый лимфатический узел через 4–5 мин после предварительной инъекции в него 5000 ЕД Гепарина. При отсутствии возможности введения препаратов (Гордокса или Контрикала) интранодулярно они могут вводиться внутривенно капельно на изотоническом растворе хлорида натрия в тех же дозировках.
У большинства больных после применения первых нескольких инъекций ингибиторов протеолиза наступает положительный клинический эффект, проявляющийся уменьшением зуда и гиперемии кожи, улучшением общего состояния, уменьшением неприятных ощущений от ознобов, а также нормализацией ряда лабораторных показателей (кислотно-основного состояния, эритроцитов). При тяжелом течении процесса и отсутствии противопоказаний с целью дезинтоксикации может быть проведено 4–5 сеансов плазмафереза, после чего больные отмечают уменьшение зуда, воспалительной реакции кожи и улучшение самочувствия. Параллельно целесообразно назначать элиминационные средства: мочегонные, энтеросорбенты (Полифепан, Энтеросгель и др.), а также препараты, улучшающие деятельность желудочно-кишечного тракта. Показано назначение антигистаминных препаратов курсами не более 7–10 дней с последующими перерывами (во избежание осложнений, возникающих от длительного приема этих средств).
Лечение кортикостероидными препаратами (преднизолон, триамсинолон, дексаметазон, Метипред) показано почти при всех клинических формах и на различных стадиях развития ЛК. Кортикостероидные гормоны оказывают противовоспалительное и десенсибилизирующее действие, а также тормозят пролиферацию клеточных элементов и влияют на процессы их созревания. На первом этапе лечения кортикостероидные препараты применяются в виде наружных форм (желательно использовать негалогенизированные препараты: Адвантан, Локоид, Элоком и др.). В связи с тем, что у больных ЛК очаги поражения способствуют развитию явлений атрофии, пойкилодермии, лечение наружными кортикостероидными препаратами не должно быть непрерывным. Его следует проводить короткими курсами — не более 2–3 нед. При отсутствии эффекта от наружного применения кортикостероидных мазей необходимо назначать гормональные препараты перорально или в виде инъекций. Этот вид терапии можно проводить в сочетании с дезинтоксикационными и противовоспалительными средствами.
При отсутствии показаний начальная максимальная суточная доза преднизолона может составлять от 25 до 60 мг, в зависимости от тяжести патологического процесса. Обычно в течение 2–3 нед приема препарата можно добиться стойкого клинического эффекта: уменьшения зуда, стихания воспалительных явлений, уменьшения инфильтрации кожи в очагах поражения, сокращения размеров регионарных лимфатических узлов. Затем дозу преднизолона снижают в течение 5–7 дней (с учетом тяжести течения процесса и динамики клинических проявлений) на 5–10 мг — до 15–20 мг/сут. При наступлении стойкой ремиссии суточная доза может быть уменьшена до 5–10 мг. Полностью отменить прием кортикостероидных гормонов удается в единичных случаях.
Для профилактики осложнений при длительном приеме кортикостероидов необходимо назначать препараты калия (Панангин, калия оротат и др.), антиоксиданты (селенметионин, Витамин С, Альфа-липоевую кислоту и др.), анаболические стероиды (Неробол, Метандростенолон, Ретаболил), антитромботические средства (Гепарин, Аспирин). С помощью кортикостероидной терапии у больных грибовидным микозом на начальной эритематозно-эритродермической стадии можно добиться полной клинической ремиссии. Больным также рекомендуется соблюдать диету, ограничивающую углеводную и жирную пищу.
Таким образом, вопросы совершенствования диагностики и лечения эритродермических вариантов ЛК по-прежнему остаются важными и актуальными. Необходимым условием проведения эффективной дифференциальной диагностики ЛК с клинически сходными дерматозами является анализ результатов клинических, морфологических и лабораторных исследований. Четко выстроенная система комплексного подхода при наблюдении данного контингента больных — реальный путь повышения уровня медицинского обслуживания и улучшения качества жизни пациентов.
По вопросам литературы обращайтесь в редакцию.
З. З. Кардашова
Е. М. Лезвинская, доктор медицинских наук
И. А. Василенко, доктор медицинских наук
РНИИ геронтологии, МОНИКИ им. М. Ф. Владимирского,
Институт ревматологии РАМН, Москва
