Актуальные проблемы диагностики и лечения бактериальных менингитов
Бактериальные гнойные менингиты (БГМ) занимают одно из ведущих мест в структуре нейроинфекций; заболеваемость ими находится в пределах 5–10 на 100 тыс. населения. Среди причин смертности от инфекционных болезней они занимают десятое место и второе после СПИДа в структуре летальности в инфекционных стационарах. Несмотря на наличие большого выбора антибактериальных препаратов, средств патогенетической терапии, летальность на протяжении последних 40–50 лет не снижается и остается в следующих пределах: 15–50% при пневмококковом менингите, 5–15% — при менингококковой инфекции, 3–20% — при гемофильном менингите. Клинически БГМ характеризуются такими синдромами, как лихорадочно-интоксикационный (гипертермия, миастения, миалгия, анорексия, токсическое поражение сердечно-сосудистой системы (ССС), центральной нервной системы (ЦНС) и вегетативной нервной системы и т. д.) и менингеальный (диффузная головная боль, сопровождающаяся тошнотой и рвотой, гиперестезия кожи, наличие ригидности мышц затылка, положительные симптомы Кернига, Брудзинского), а также характерными изменениями в спинно-мозговой жидкости — СМЖ (резкое повышение ликворного давления, изменение прозрачности, повышение уровня белка и лактата, высокий нейтрофильный плеоцитоз, снижение уровня глюкозы). При распространении воспалительного процесса на вещество мозга и развитии отека-набухания головного мозга присоединяется общемозговой синдром (нарушения сознания и психики, генерализованные судороги) и очаговая неврологическая симптоматика (парезы черепных нервов, конечностей, тазовые нарушения, мозжечковая симптоматика, патологические рефлексы и др.).
За 5 лет в ИКБ № 2 г. Москвы наблюдались 2148 больных БГМ, из них 776 в ОРИТ (37,2%). Лабораторно (бактериологически, реакция латексной агглютинации — РЛА) расшифрована этиология менингита у 38% больных. У 60% больных менингококковой инфекцией диагноз установлен клинически. Среди лабораторно подтвержденных случаев болезни менингококковый менингит (ММ) составил 64%, пневмококковый менингит (ПМ) — 21,3%, менингит, вызванный гемофильной палочкой типа В (HiВ-менингит) — 9,3%, однако в этиологической структуре детей HiВ-менингит находится на втором месте после менингококкового. 5,3% составили менингиты стафилококковой, стрептококковой, листериозной, клебсиеллезной, эшерихиозной этиологии. За последние 3 года, по нашим наблюдениям, имеется тенденция к более тяжелому течению болезни. Так, в 2004 г. в ОРИТ госпитализированы 37,8% больных, в 2005 г. — 39,1%, в 2006 г. — 49,9%, т. е. половина всех больных БГМ.
Причинами тяжелого состояния и летальности пациентов, поступивших в ОРИТ, в 86,1% являлись отек головного мозга (ОНГМ), ОНГМ в сочетании с инфекционным токсическим шоком (ИТШ), менингоэнцефалит. Летальность существенно колебалась в разные годы. Так, в 2005 г. она составляла 5,2%, а в 2006 г. выросла до 13,5%. Она существенно увеличилась при менингококковом, гемофильном менингитах и при менингитах неустановленной этиологии, составив соответственно в 2005 г. 3,8%, 0%, 5,9%, а в 2006 г. — 9,7%, 15,7%, 13,6% (табл. 1).
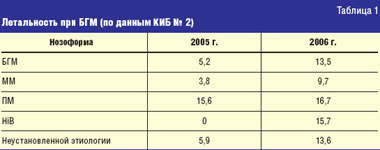
Рост летальности при гемофильном менингите за последний год обусловлен развитием у трех больных ИТШ. На 162 больных гемофильным менингитом, наблюдавшихся в течение последних 20 лет, летальность составила 3,7%.
Проведенный анализ диагностики, результатов лечения БГМ показывает, что наиболее актуальными практическими проблемами на современном этапе являются:
- ранняя клиническая диагностика на догоспитальном этапе и транспортировка больных в специализированные отделения;
- правильная оценка тяжести состояния больного с последующей адекватной терапией на догоспитальном уровне;
- ранняя диагностика и лабораторное подтверждение диагноза в стационаре;
- адекватная этиотропная терапия на всех этапах;
- ранняя оценка эффективности этиотропной терапии;
- квалифицированная интенсивная терапия и реанимация тяжелых больных в ОРИТ специализированных стационаров.
В Москве, несмотря на проведение постдипломной подготовки, чтение лекций и другие образовательные мероприятия, значительная часть больных госпитализируется в поздние сроки, часто после 2–3-кратного обращения больные направляются в непрофильные стационары. Так, при HiВ-менингите средний срок госпитализации составляет 3,2 сут; больные госпитализировались в пять различных стационаров, и только 54% — в ИКБ № 2. Однако летальность в ИКБ № 2 составляет 3,7%, а в непрофильных стационарах — 23,5%, т. е. выше более чем в 6 раз.
Установлено, что в ОРИТ поступают больные БГМ в поздние сроки, в среднем на 3,5 ± 0,2 дня болезни, в то время как в боксированное отделение (БО) практически в первые 2 дня (на 1,6 ± 0,3 дня болезни) (р < 0,001). В 38,3% случаев позднее поступление было обусловлено ошибочными диагнозами при первичном обращении больных за помощью. Причем в 2005 г. частота ошибок составила 27,3%, в 2006 г. — 45,8%, т. е. возросла в 2 раза.
По данным сопроводительных документов за 2005–2006 гг. установлено, что наиболее частыми ошибочными диагнозами при типичной клинической картине гнойного менингита были острое нарушение мозгового кровообращения (ОНМК), острая респираторная вирусная инфекция (ОРВИ), пиелонефрит, пневмония, алкогольный делирий, пищевая токсикоинфекция, холецистит, острая передозировка психотропных препаратов, отит, острый аппендицит, острая задержка мочи. Ошибочная диагностика приводила к тому, что больные госпитализировались в непрофильные стационары (23,4%), где в среднем до расшифровки диагноза проводили 1,8 сут и соответственно не получали необходимую квалифицированную помощь. Отмечались также случаи гипердиагностики, когда в ОРИТ (9,8%) и БО (16,6%) госпитализировались больные с подозрением на менингит, у которых диагностировались ОНМК, опухоль мозга, отравление психотропными препаратами, вторичный отогенный менингит, эпилепсия, ОРВИ, остеохондроз. Гипердиагностика также является отрицательным фактором для больных БГМ, так как в связи с тяжестью состояния возникала проблема перевода в профильный стационар и оказания специализированной помощи.
В стационаре исход болезни в значительной степени зависит от быстроты диагностики БГМ и его этиологической расшифровки, поскольку при отсутствии дополнительных симптомов БГМ различной этиологии клинически неразличимы.
На основании клинико-лабораторных данных этиологический диагноз установлен у 74% больных (в том числе только у 48% с использованием бактериологического метода и РЛА). При этом хотелось бы подчеркнуть роль посева крови. Гемокультуры получены у 58% больных HiВ-менингитом, 27% — ПМ и у 16% — генерализованной формой менингококковой инфекции (МИ). Результаты бактериологического исследования могут быть улучшены путем совершенствования техники исследования (забор материала, транспортировка, качество сред). Однако кардинальное повышение частоты расшифровки диагноза возможно только путем внедрения метода полимеразной цепной реакции (ПЦР). Так, еще в 1998–2000 гг. использование ПЦР позволило установить этиологию БГМ более чем у 80% больных.
При использовании рутинных методов диагностики наибольшие диагностические трудности представляют больные с 2–3-значным нейтрофильным или смешанным плеоцитозом СМЖ. В этой группе могут быть больные вторичными БГМ при сепсисе, абсцессах мозга, первичными БГМ в ранние сроки болезни или леченные антибиотиками, больные туберкулезным менингитом, вирусными нейроинфекциями в ранние сроки, субарахноидальными кровоизлияниями. Суммированные дифференциальные критерии представлены в таблица 2.
Мы придаем существенное диагностическое значение концентрации лактата в СМЖ и крови и их соотношению, что основано на результатах обследования в динамике более 200 больных.
Основные принципы и стандарты антимикробной терапии известны. Нами используются следующие препараты для эмпирической терапии БГМ: в зависимости от возраста применяется цефтриаксон, цефотаксим, ампициллин. В зависимости от выделенного возбудителя назначается этиотропная терапия: при менингококковом менингите — пенициллин, цефтриаксон, цефотаксим, цефепим; при пневмококковом — пенициллин, цефтриаксон, ванкомицин, меропенем, ципрофлоксацин; при HiВ-менингите — цефтриаксон, цефотаксим, пефлоксацин; при менингитах, вызванных энтеробактериями, — цефтриаксон, цефотаксим, пефлоксацин, цефепим; при стафилококковом — ванкомицин, рифампицин, оксациллин, меропенем, линезолид; при синегнойном — цефтазидим, ципрофлоксацин, цефоперазон, цефепим; при листериозном — ванкомицин, цефтриаксон, ампициллин; при лептоспирозном — пенициллин, ампициллин, цефотаксим; при менингите, вызванном бактероидами — метронидазол, Ко-тримоксазол, меропенем; при менингите, вызванном энтерококками, — ампициллин, амикацин, ванкомицин, меропенем. При тяжелом течении БГМ применяется эндолюмбальное введение ванкомицина, амикацина. Все более актуальной становится проблема резистентности возбудителей. За последние годы более отчетливо выявляется тенденция к появлению резистентных штаммов возбудителей к препаратам, используемым в практике лечения менингитов. Так, 4% штаммов менингококка и 3% пневмококков были устойчивы к пенициллину. Регистрируются отдельные полирезистентные штаммы менингококка и пневмококка.
Пока существует выбор препаратов 4–5 разных групп, а частота выделения резистентных к отдельным препаратам составляет не более 5–6%, эта проблема решается путем замены, однако в ближайшие годы проблема «старения» антимикробных препаратов в отношении лечения БГМ может стать очень острой, особенно если учесть стремление практикующих врачей широко применять, часто без достаточных обоснований, антибиотики, особенно новые. В результате появляются штаммы возбудителей менингитов, резистентные не только к пенициллину, левомицетину, но и к фторхинолонам, меропенему.
Другая проблема — отсутствие эффекта при лечении препаратами, к которым данный штамм возбудителя чувствителен. Этот феномен мы наблюдали в разных группах больных с частотой от 15 до 30%, что можно продемонстрировать на примере HiВ-менингита (рис.).
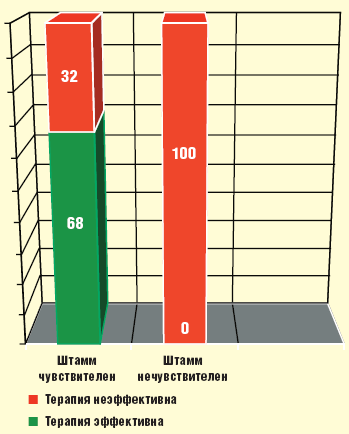
|
| Рисунок. Чувствительность HiB к антибиотикам, % |
Причины многообразны, в том числе:
- недостаточный пассаж препарата через гематоэнцефалический барьер (ГЭБ);
- наличие зон бионедоступности возбудителя;
- недостаточная доза или низкое качество препарата;
- несоответствие данных о чувствительности возбудителя in vitro и in vivo.
Нужно отметить, что у разных больных при одинаковых дозах препарата его концентрация в СМЖ различается в десятки раз. Недостаточный пассаж антибиотика может быть обусловлен особенностями патологического процесса и недостаточной ликворопродукцией. Так, при поступлении почти у 20% больных БГМ наблюдается ликворная гипотензия. По мере стихания воспалительного процесса уменьшается проницаемость ГЭБ, процесс резорбции СМЖ преобладает над ликворопродукцией, что отчетливо отражается на фармакокинетике препарата.
Существенное влияние на этот процесс оказывают диуретики, кортикостероиды. О наличии зон бионедоступности свидетельствуют частые высевы культуры возбудителя, особенно пневмококка, из трупного материала у умерших после длительного применения антибиотиков. Эти зоны создаются в сгустках экссудата, энцефалитических очагах, очагах размягчения мозговой ткани, гематомах, ячейках субарахноидального пространства, в желудочках мозга при вентрикулите. В этих случаях целесообразно (при чувствительности возбудителя) использование супермассивных доз пенициллина, применение интракаротидного и эндолюмбального методов введения антибиотиков. Применение препаратов низкого качества, в частности цефтриаксона индийского производства, нередко сопровождается обострением процесса, а иногда вообще неэффективно.
К сожалению, в последние годы особенности фармакокинетики антимикробных препаратов в условиях ОРИТ при проведении интенсивной терапии не изучались и, соответственно, отсутствуют рекомендации о коррекции с этих позиций антимикробной и патогенетической терапии.
Изучение чувствительности возбудителя является важным критерием, определяющим выбор препарата, но только в случае методически правильного исследования. Кроме того, имеются данные о том, что бактерии резко меняют свою активность при изменении условий существования. Не исключено, что эти изменения могут влиять на результаты определения чувствительности возбудителя, однако вопрос нуждается в изучении. Таким образом, проблема повышения эффективности этиотропной терапии БГМ требует фундаментальных исследований.
Сложной является оценка эффективности антибактериальной терапии в ранние сроки, особенно у больных с тяжелым течением БГМ, что часто приводит к необоснованной замене антибиотика. Так, например, при HiВ-менингите замена произведена у 68% наблюдавшихся нами больных, а обоснованная — только у 28%.
При принятии решения о замене препарата следует иметь в виду, что:
- у тяжелых больных оценка эффективности лечения возможна при ММ не ранее 2 сут, при HiВ-менингите — не ранее 3 сут, при ПМ — не ранее 3–5 сут;
- клинические показатели недостаточно информативны, так как улучшение состояния может быть связано с временным эффектом дегидратационной и дезинтоксикационной терапии, а ухудшение состояния, включая нарастание общемозговой, менингеальной и очаговой симптоматики, возможно и при эффективной антибактериальной терапии вследствие церебральных и экстрацеребральных осложнений (нарастание ОНГМ, внутричерепные гематомы, эпидурит, герпетическая инфекция, пневмония и др.);
- через 1–2 дня от начала лечения, даже при адекватной антимикробной терапии, возможен высев возбудителя из СМЖ, плеоцитоз может нарастать. В то же время при неэффективной терапии возможно снижение плеоцитоза;
- по нашим данным, наиболее ранними и информативными критериями эффективности этиотропной терапии являются: клеточный состав СМЖ, концентрация белка и глюкозы, лактата, pH, парциальное давление кислорода pO2 ликвора (табл. 3).
Совокупность этих данных в большинстве случаев позволяет в течение 2–3 сут реально оценить эффективность лечения и принять обоснованное решение о продолжительности лечения тем же препаратом или о его замене. Однако необходимо отметить, что при ПМ положительная динамика этих показателей может выявляться на 1–3 дня позже.
Следующим аспектом является своевременное решение об отмене антибиотика. По нашим данным, продолжительность антибиотикотерапии больных БГМ увеличивается в среднем на 1 сут за 8–10 лет. Так, в 1960–1970 гг. продолжительность пенициллинотерапии составляла в среднем 7 сут, после 2000 г. — 10 сут. В части случаев, особенно при необходимости замены препаратов в процессе лечения, пролонгирование лечения целесообразно, но существуют типичные ситуации, когда показаний для продолжения антибиотикотерапии нет.
- Длительная лихорадка при полном регрессе неврологической симптоматики и санации СМЖ, при отсутствии каких-либо гнойно-септических осложнений (пневмония, пиелит, эндокардит, постинъекционный абсцесс, инфицированный интравазальный катетер).
- Длительная лихорадка чаще всего наблюдается у больных HiВ-менингитом и менингококцемией. У таких больных причиной лихорадки чаще всего являются инфекционно-аллергические артриты, миокардит. У маленьких детей температура может нормализоваться после отмены антибиотиков. Эффективны нестероидные противовоспалительные препараты.
- Длительное сохранение лимфоцитарного плеоцитоза СМЖ в пределах от 100 до 200–300 кл/мкл при отсутствии неврологической симптоматики, нормальном уровне глюкозы и лактата СМЖ. По нашим данным, в этих случаях основную долю (более 90%) составляют Т-лимфоциты, главным образом Т-хелперы (СД4), а иммунорегуляторный индекс резко возрастает, достигая 4,8–5,5. Одновременно в несколько раз повышается содержание иммуноглобулинов различных классов. Таким образом, воспаление носит асептический характер и обусловлено местной реакцией иммунной системы.
Реже допускается преждевременная отмена антибиотиков — обычно у больных ПМ и HiВ-менингитом при удовлетворительном общем состоянии, регрессе неврологических показателей, невысоком плеоцитозе в пределах 40–100 в 1 мкл, при сохранении в СМЖ нейтрофилов 20–30%, снижении уровня глюкозы и повышении лактата, что свидетельствует о сохранении активности возбудителя. Нужно также учитывать такие показатели, как неврологически отягощенный преморбидный фон, волнообразность течения менингита, медленная санация СМЖ.
Преждевременная отмена антибиотиков в этих случаях приводит через несколько суток к обострению болезни.
Важнейшим направлением в снижении летальности является совершенствование методов интенсивной терапии и реанимации. Результат лечения в значительной степени обусловлен квалификацией врачей и среднего медицинского персонала, соблюдением в отделении санитарно-гигиенического режима. В ОРИТ должны работать врачи, имеющие два сертификата — реаниматолога и инфекциониста. Существенное снижение летальности может быть достигнуто благодаря превентивной интубации и раннему переводу больных с синдромом ОНГМ на искусственную вентиляцию легких (ИВЛ), до развития тяжелых степеней гипоксемии, отработке оптимальных режимов ИВЛ, отработке показаний для применения петлевых и осмотических диуретиков, кортикостероидов.
Таким образом, повышение эффективности качества оказания медицинской помощи больным БГМ является реальной перспективой. Оно может быть достигнуто за счет повышения уровня подготовки врачей поликлиник, скорой помощи и непрофильных стационаров по нейроинфекциям, улучшения диагностики в стационарах путем внедрения ПЦР, РЛА, совершенствования бактериологической диагностики, определения чувствительности к антибактериальным препаратам стандартизированными методами, включения в число рутинных методов обследования определения уровня лактата в СМЖ и крови, использования современных схем применения антибактериальных препаратов, объективных методов оценки их эффективности и определения на этой основе показаний для их замены, оптимизации продолжительности курса лечения, внедрения в практику ОРИТ превентивной интубации больных с тяжелым течением БГМ и раннего их перевода на ИВЛ, совершенствования методов патогенетической терапии.
Ю. Я. Венгеров, доктор медицинских наук, профессор
М. В. Нагибина, кандидат медицинских наук, доцент
Т. Э. Мигманов, кандидат медицинских наук, доцент
Р. Н. Быкова
В. Б. Ченцов, кандидат медицинских наук
Г. В. Крючкова
Т. Ю. Смирнова
Т. И. Свистунова, кандидат медицинских наук
В. А. Мясников
МГМСУ, КБ № 2, Москва
Врезки:
