Место фторхинолонов в лечении бактериальных инфекций
Фторхинолоны — большая группа антимикробных средств класса хинолонов, ингибиторов ДНК-гиразы. Это высокоактивные синтетические химиотерапевтические средства широкого спектра действия, характеризующиеся хорошими фармакокинетическими свойствами, высокой степенью проникновения в ткани и клетки, включая клетки макроорганизма и бактериальные клетки.
Нефторированные препараты класса хинолонов (налидиксовая кислота, пипемидиевая кислота, оксолиниевая кислота) применяются в клинике с начала 60-х годов. Эти препараты имеют ограниченный спектр действия (преимущественно в отношении Enterobacteriaceae) и невысокую биодоступность, применяются в основном при лечении неосложненных инфекций мочевыводящих путей и некоторых кишечных инфекций.
Принципиально новые соединения удалось получить путем введения атома фтора в 6-е положение молекулы хинолина. Наличие атома фтора (одного или нескольких) и различных групп в разных позициях определяет особенности антибактериальной активности и фармакокинетических свойств препаратов. Препараты группы фторхинолонов внедрены в клиническую практику в начале 80-х годов, и сегодня они занимают одно из ведущих мест в химиотерапии различных бактериальных инфекций. Некоторые свойства фторхинолонов позволяют им прочно занимать ведущие позиции в арсенале современных антибактериальных средств. К свойствам данного характера относятся:
-
уникальный механизм действия среди антимикробных средств — ингибирование фермента бактериальной клетки — ДНК-гиразы;
-
высокая степень бактерицидной активности;
-
широкий спектр антимикробного действия, включающий грамотрицательные и грамположительные аэробные бактерии (некоторые препараты активны также в отношении анаэробов), микобактерии, хламидии, микоплазмы;
-
хорошее проникновение в ткани и клетки макроорганизма, где создаются концентрации, близкие к сывороточным или их превышающие;
-
длительный период полувыведения и наличие постантибиотического эффекта, что определяет их редкое дозирование — 1–2 раза/сут;
-
доказанная в контролируемых клинических исследованиях высокая эффективность при лечении внебольничных и госпитальных инфекций практически любой локализации (верхних и нижних дыхательных путей, мочевыводящей системы, кожи и мягких тканей, костей и суставов, интраабдоминальной, гинекологической, печени и желчевыводящих путей, желудочно-кишечного тракта, глаз, центральной нервной системы, заболеваний, передающихся половым путем);
-
возможность применения в качестве эмпирической терапии при тяжелых инфекциях в стационаре;
-
хорошая переносимость препаратов и небольшая частота побочных эффектов.
Антибактериальная активность
Фторхинолоны — препараты широкого спектра действия с преимущественной активностью в отношении грамотрицательных и грамположительных аэробных бактерий, а также хламидий и микоплазм.
Наиболее выраженной активностью фторхинолоны обладают в отношении грамотрицательных бактерий, главным образом семейства Enterobacteriaceae (Escherichia coli, Proteus spp., Klebsiella spp., Shigella spp., Salmonella spp., Enterobacter spp., Serratia marcescens, Citrobacter spp.), в отношении которых их активность сравнима с цефалоспоринами III–IV поколений (МПК90 обычно менее 1 мг/л). Очень высокой чувствительностью к фторхинолонам обладают N. gonorrhoeae и N. meningitidis (МПК90 менее 0,1 мг/л), менее чувствительны Acinetobacter spp. Препараты оказывают выраженное действие и на другие грамотрицательные бактерии (C. jejuni, M. catarrhalis, Legionella spp.), H. influenzae (включая штаммы, продуцирующие β-лактамазы [1]). P. aeruginosa обычно умеренно чувствительна к фторхинолонам, среди которых наиболее активен ципрофлоксацин [2]. В отношении грамотрицательных бактерий наибольшей активностью обладают ципрофлоксацин и офлоксацин [2].
Активность фторхинолонов в отношении грамположительных бактерий менее выражена, чем в отношении грамотрицательных. Стрептококки и пневмококки менее чувствительны к фторхинолонам, чем стафилококки [3].
В последние годы синтезированы новые препараты группы фторхинолонов, проявляющие более высокую активность в отношении грамположительных бактерий, прежде всего пневмококков, что позволило их выделить в отдельную подгруппу и характеризовать как препараты 2-го поколения или новые фторхинолоны (табл. 1). Их часто характеризуют также как «респираторные» или «антипневмококковые», хотя эти определения не совсем точно отражают их особенности антимикробного спектра в области клинического применения.

Новые фторхинолоны обладают более высокой природной активностью в отношении Streptococcus pneumoniae по сравнению с ранними фторхинолонами, причем самой высокой активностью обладают гемифлоксацин (МПК90 = 0,125 мг/л) и моксифлоксацин (0,25 мг/л), менее выраженной — левофлоксацин (1 мг/л). Отметим, что активность новых фторхинолонов не различается в отношении пенициллиночувствительных и пенициллинрезистентных штаммов пневмококка. В настоящее время устойчивость пневмококков к новым фторхинолонам минимальна (менее 1%), в то время как к ранним существенно выше. Новые фторхинолоны также превосходят ранние по активности в отношении других стрептококков, стафилококков, энтерококков. Некоторые препараты 2-го поколения фторхинолонов (моксифлоксацин, гемифлоксацин) проявляют также активность в отношении метициллинрезистентных штаммов стафилококков.
Все фторхинолоны обладают активностью в отношении хламидий и микоплазм, причем препараты 1-го поколения — умеренной, препараты 2-го поколения — высокой.
Анаэробные бактерии устойчивы или умеренно чувствительны к ранним фторхинолонам, поэтому при лечении больных со смешанной аэробной и анаэробной инфекцией (например, интраабдоминальная и гинекологическая инфекции) фторхинолоны целесообразно сочетать с метронидазолом или линкозамидами. Некоторые новые фторхинолоны (тровафлоксацин, моксифлоксацин и др.) обладают хорошей активностью в отношении анаэробов, включая Clostridium spp. и Bacteroides spp., что позволяет их применять при смешанных инфекциях в режиме монотерапии.
Области клинического применения фторхинолонов
Фторхинолоны с успехом применяются при лечении различных инфекций. В многочисленных контролируемых исследованиях показана высокая клиническая эффективность фторхинолонов при инфекциях практически любой локализации как внебольничных, так и госпитальных [4].
Препараты 1-го поколения главным образом следует применять при госпитальных инфекциях (табл. 2). Их значение при внебольничных инфекциях дыхательных путей ограничено из-за невысокой активности в отношении наиболее частого возбудителя — S. pneumoniae. Наиболее хорошо изученными препаратами являются ципрофлоксацин, офлоксацин и пефлоксацин. Ципрофлоксацин обладает достаточно высокой природной активностью в отношении P. aeruginosa, сравнимой с активностью наиболее активных в отношении этого микроорганизма препаратов — цефтазидима и меропенема. В то же время настораживает отчетливая тенденция, наблюдаемая в последние годы, — рост частоты устойчивых штаммов P. aeruginosa в отделениях реанимации интенсивной терапии (ОРИТ) к фторхинолонам.
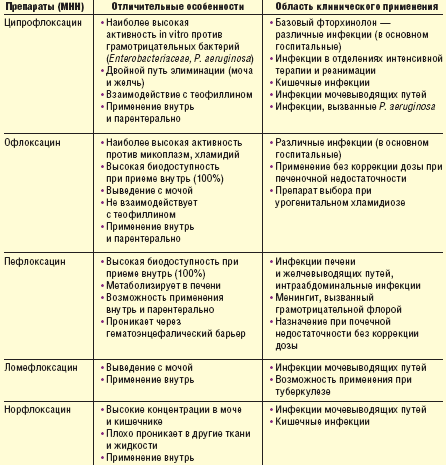
Ранние фторхинолоны (ципрофлоксацин, офлоксацин, пефлоксацин) являются препаратами выбора при лечении различных инфекций мочевыводящих путей, в том числе госпитальных. Хорошее проникновение указанных препаратов в ткань предстательной железы делает их практически безальтернативными средствами при лечении бактериального простатита.
Как было отмечено, ранние фторхинолоны не целесообразно применять при внебольничных респираторных инфекциях. В то же время при госпитальной пневмонии эти препараты имеют важное значение, так как высокоактивны против наиболее актуальных возбудителей (Enterobacteriaceae, S. aureus, P. aeruginosa), причем в ОРИТ при пневмонии, связанной с искусственной вентиляцией легких (ИВЛ), предпочтение следует отдавать ципрофлоксацину, обладающему наиболее выраженной природной активностью против синегнойной палочки (в связи с тем, что в ОРИТ нашей страны частота резистентных к ципрофлоксацину штаммов P. aeruginosa превышает 30%, этот препарат следует назначать только в случае установленной чувствительности микроорганизма). В нереанимационных отделениях хирургического и неврологического профиля при госпитальной пневмонии высокоэффективны офлоксацин и пефлоксацин. Следует отметить, что по природной активности в отношении грамотрицательных бактерий семейства Enterobacteriaceae ранние фторхинолоны не уступают новым или даже их превосходят. В отношении P. aeruginosa самым активным фторхинолоном остается ципрофлоксацин, из новых фторхинолонов реальной антипсевдомонадной активностью обладает только левофлоксацин. Кроме того, устойчивость грамотрицательных бактерий к ранним и новым фторхинолонам обычно перекрестная, то есть в случае устойчивости к ципрофлоксацину с высокой вероятностью возбудитель также будет устойчив к левофлоксацину и моксифлоксацину. Вышесказанное объясняет тот факт, что новые фторхинолоны не имеют существенных преимуществ по сравнению с ранними при лечении госпитальных инфекций.
Важное значение ранние фторхинолоны имеют при интраабдоминальных хирургических инфекциях. В рекомендуемых ранее схемах антибактериальной терапии перитонита в качестве средств 1-го ряда обычно указывались цефалоспорины II–III поколений в сочетании с линкозамидами или метронидазолом. В связи с глобальным ростом устойчивости госпитальных штаммов Enterobacteriaceae к цефалоспоринам III поколения в последние годы фторхинолоны в сочетании с метронидазолом все чаще рекомендуются в качестве средств 1-го ряда. Эффективность различных препаратов ранних фторхинолонов при интраабдоминальных инфекциях сравнима. При инфекциях печени и желчевыводящих путей, по всей видимости, предпочтение следует отдавать пефлоксацину, концентрация которого в желчи более высокая.
Фторхинолоны также рекомендуются больным с панкреонекрозом с целью профилактики инфицирования, хотя в сравнительных исследованиях была показана более высокая эффективность карбапенемов. Широко распространенное мнение о преимуществе пефлоксацина в терапии панкреонекроза вряд ли можно признать обоснованным, так как его концентрация в ткани и секрете поджелудочной железы не выше, чем концентрация, наблюдаемая при применении ципрофлоксацина или офлоксацина. Степень проникновения фторхинолонов в различные ткани происходит путем пассивной диффузии и обусловлена их физико-химическими свойствами — липофильностью, значением рКа и связыванием с белками плазмы, а эти показатели лучше у ципрофлоксацина [5]. Перспективными при интраабдоминальных инфекциях являются новые фторхинолоны — левофлоксацин и моксифлоксацин.
Фторхинолоны обычно не рекомендуются при инфекциях центральной нервной системы (ЦНС) в связи с невысокой пенетрацией в спинномозговую жидкость (СМЖ), однако при менингите, вызванном грамотрицательными бактериями, устойчивыми к цефалоспоринам III поколения, значение фторхинолонов возрастает. В этом случае предпочтительнее использовать пефлоксацин или ципрофлоксацин.
Наличие у некоторых фторхинолонов (ципрофлоксацина, офлоксацина, пефлоксацина) двух лекарственных форм позволяет проводить ступенчатую терапию с целью уменьшения стоимости лечения. В связи с высокой биодоступностью офлоксацина и пефлоксацина дозы этих препаратов при внутривенном и пероральном применении одинаковы. У ципрофлоксацина биодоступность ниже, поэтому при переходе с парентерального введения на прием внутрь с целью поддержания терапевтических концентраций в крови следует увеличить пероральную дозу препарата (например, в/в 100 мг → внутрь 250 мг; в/в 200 мг → внутрь 500 мг; в/в 400 мг → внутрь 750 мг).
Препараты II поколения фторхинолонов характеризуются более высокой активностью в отношении грамположительных инфекций и прежде всего S. pneumoniae [6]. В связи с этим левофлоксацин, моксифлоксацин, спарфлоксацин и гемифлоксацин могут назначаться при внебольничных инфекциях дыхательных путей (табл. 3). Доказана высокая клиническая эффективность левофлоксацина, моксифлоксацина, гемифлоксацина также при респираторных инфекциях. В настоящее время новые фторхинолоны рекомендуются в качестве средств выбора при лечении внебольничной пневмонии и обострения хронического бронхита [7, 8]. В контролируемых исследованиях показано, что левофлоксацин и моксифлоксацин являются самыми эффективными режимами терапии тяжелой внебольничной пневмонии и в режиме монотерапии не уступают, а иногда даже превосходят комбинированные режимы (цефалоспорины III поколения + макролиды). Установлено, что гемифлоксацин, моксифлоксацин и левофлоксацин при обострении хронического бронхита результативнее других режимов антибактериальной терапии по эрадикации H. influenzae и срокам безрецидивного периода [9–12].
Высокая активность этих препаратов в отношении основных возбудителей урогенитальных инфекций (гонорея, хламидиоз, микоплазмоз) позволяет с высокой эффективностью применять их при заболеваниях, передающихся половым путем. В перспективе эти препараты могут занять ведущее место при лечении гинекологических инфекций малого таза (учитывая частое сочетание грамположительных или грамотрицательных бактерий с атипичными микроорганизмами — хламидиями и микоплазмами), однако это требует подтверждения в клинических исследованиях. Некоторые препараты 2-го поколения фторхинолонов, такие как моксифлоксацин, гемифлоксацин, обладают очень широким спектром антимикробной активности, включающим также анаэробные микроорганизмы и метициллинрезистентные стафилококки [13, 14]. Таким образом, данные препараты в перспективе могут стать средствами выбора при эмпирической терапии наиболее тяжелых инфекций в стационаре — госпитальной пневмонии, сепсиса, смешанных аэробно-анаэробных интраабдоминальных и раневых инфекций.
При назначении фторхинолонов следует учитывать возможность фармакокинетического взаимодействия с другими лекарственными средствами. Прежде всего данный риск имеется при пероральном приеме фторхинолонов. Ряд препаратов (антациды, сукральфат, соли висмута, кальция, препараты железа) уменьшает биодоступность фторхинолонов, что может привести к снижению эффективности последних. Некоторые фторхинолоны вызывают повышение концентраций теофиллина в крови при их сочетанном назначении. Это характерно для эноксацина, ципрофлоксацина, в меньшей степени — пефлоксацина и грепафлоксацина. В то же время офлоксацин, левофлоксацин, норфлоксацин, ломефлоксацин не изменяют фармакокинетику теофиллина.
Переносимость и безопасность фторхинолонов
В течение двух десятилетий клинического применения фторхинолоны считались относительно безопасными и хорошо переносимыми препаратами. Фторхинолоны, рекомендованные для медицинского применения, не проявляют канцерогенной, мутагенной и тератогенной активности. Имеются ограничения применения препаратов этой группы — беременным и кормящим женщинам, детям и подросткам в возрасте до 16–18 лет. Это связано с экспериментальными данными о повреждающем действии фторхинолонов в отношении хрящевой ткани неполовозрелых животных. Хотя эти данные не находят подтверждения в клинике (имеется контролируемый мировой опыт назначения фторхинолонов по жизненным показаниям у нескольких тысяч детей без каких-либо отрицательных последствий), данные ограничения сохраняются до настоящего времени. Это противопоказание оправдано, так как строго ограничивает широкое нерациональное использование фторхинолонов в педиатрии до получения надежных данных по их безопасности у этой категории пациентов.
В то же время следует особо отметить, что абсолютно безопасных лекарственных препаратов не существует. Несмотря на огромный опыт безопасного клинического применения фторхинолонов, случаи тяжелых токсических реакций, отмеченных в последние годы у некоторых препаратов этой группы, заставляют более тщательно подойти к изучению их безопасности, анализу нежелательных реакций и определению соотношения «польза/риск».
Наиболее частыми нежелательными реакциями при применении фторхинолонов являются симптомы со стороны желудочно-кишечного тракта (тошнота, рвота, диарея, боли в животе, изменения вкуса), однако в большинстве случаев они носят умеренный характер и не требуют отмены лечения.
Реакции со стороны ЦНС характерны для всех препаратов этого класса, однако они наблюдаются не часто, проявляются, как правило, головной болью, головокружением, сонливостью, расстройством сна (эти симптомы обычно возникают в 1-й день лечения и исчезают сразу после отмены); судороги описаны значительно реже, возникают в основном на 3–4-й день лечения у больных, имеющих предрасполагающие факторы: эпилепсия в анамнезе, мозговая травма, гипоксия, пожилой возраст, сочетанное назначение с теофиллином или нестероидными противовоспалительными средствами. Все фторхинолоны с примерно одинаковой частотой вызывают реакции со стороны ЦНС (5–8%), минимальная нейротоксичность отмечена у офлоксацина и левофлоксацина.
Фторхинолоны вызывают под действием солнечных лучей или УФ-излучения фототоксические реакции. Это связано с фотодеградацией молекулы хинолона под влиянием УФ-лучей и с образованием свободных радикалов О2, повреждающих кожные структуры. Описаны случаи тяжелого фотодерматита. Важно, что фототоксические реакции могут развиваться не только на фоне приема фторхинолона, но и в течение нескольких дней после отмены препарата. Среди фторхинолонов наибольшую фототоксичность проявляют спарфлоксацин и ломефлоксацин (частота 10% и более). Практически не вызывают это осложнение левофлоксацин, тровафлоксацин, моксифлоксацин (< 0,5%). Во всех случаях применения фторхинолонов пациентов следует предупредить о риске инсоляции и стоит воздержаться от назначения физиотерапевтических процедур, связанных с УФ-воздействием.
Нежелательные явления со стороны печени отмечаются у 2–3% больных, получающих фторхинолоны. Наиболее часто они проявляются небольшим бессимптомным повышением сывороточных трансаминаз и щелочной фосфатазы, прекращающимся после отмены препарата. В то же время возможны более серьезные реакции. В одной работе проведен анализ осложнений при применении ципрофлоксацина у 80 млн больных, и только у 144 пациентов выявили серьезные изменения печеночных ферментов, у небольшого числа пацентов развился гепатит, некроз печени или печеночная недостаточность. В двух случаях развилась холестатическая желтуха. При применении эноксацина, норфлоксацина и офлоксацина была отмечена гепатотоксичность. При изучении левофлоксацина, спарфлоксацина, грепафлоксацина, моксифлоксацина, гемифлоксацина изменения печеночных ферментов отмечались редко, были незначительными и быстро приходили к нормальным значениям после отмены препарата. Тяжелые гепатотоксические реакции на фоне тровафлоксацина упомянуты ранее.
Удлинение интервала QT на ЭКГ характерно для этого класса соединений, описано при применении практически всех фторхинолонов, однако клиническое значение этого феномена до конца не ясно, что было доказано при токсикологической доклинической оценке хинолонов на животных. В клинике удлинение QT отмечено на фоне спарфлоксацина, грепафлоксацина, левофлоксацина, в пределах 10 мс, что не имеет существенного клинического значения и не повышает риск опасных желудочковых нарушений ритма. Более того, ряд лекарственных препаратов, широко применяющихся в медицине (хинидин, амиодарон, соталол, цизаприд, терфенадин, астемизол, флуоксетин, макролиды), вызывает удлинение QT в гораздо большей степени. Закономерное сомнение вызывают сообщения о нескольких случаях фатальных аритмий, связанных с применением грепафлоксацина; они и стали предпосылками отзыва лекарства с рынка. При анализе применения ципрофлоксацина более чем у 250 млн человек отмечено, что возможно связанные с препаратом аритмии встречаются в одном случае на 1 млн пролеченных больных. Вместе с тем полностью игнорировать имеющиеся данные не этично. По всей видимости, следует с осторожностью подходить к назначению фторхинолонов больным с желудочковыми аритмиями в анамнезе или синдромом удлиненного QT-интервала, а также избегать сочетанного применения фторхинолонов с другими лекарствами, вызывающими удлинение QT. Однако нельзя рассматривать фторхинолоны как препараты, имеющие аритмогенные свойства, и тем более в этой связи ограничивать их назначение.
В заключение следует отметить, что фторхинолоны являются важнейшими препаратами в современной химиотерапии бактериальных инфекций, что подтверждено 20-летним опытом их клинического применения. Эти препараты с высокой эффективностью назначаются взрослым при лечении инфекций практически любой локализации. В то же время следует предостеречь врачей в отношении неоправданно широкого или необоснованного назначения фторхинолонов, особенно в амбулаторной практике. В последние годы наблюдается увеличение резистентности микроорганизмов к фторхинолонам. Отмечается повышение частоты выделения устойчивых к фторхинолонам штаммов P. aeruginosa, Staphylococcus spp., а также снижение чувствительности у некоторых других микроорганизмов. Наш опыт свидетельствует, что в случае широкого и бесконтрольного применения фторхинолонов в стационаре может довольно быстро снижаться чувствительность к ним госпитальных штаммов микроорганизмов с закономерным снижением клинической эффективности препаратов. В этой связи важным является строгое обоснование назначения фторхинолонов в адекватной дозе в каждом конкретном случае.
1 Прекращено медицинское применение фторхинолонов, прошедших все фазы клинических исследований и внедренных в клинику: темафлоксацина (случаи гемолиза с острой почечной недостаточностью), тровафлоксацина (несколько случаев тяжелого поражения печени, некроза печени, потребовавшего трансплантации), грепафлоксацина (зарегистрированы случаи фатальных нарушений ритма сердца), гатифлоксацина (гипергликемия).
По вопросам литературы обращайтесь в редакцию.
С. В. Яковлев, доктор медицинских наук, профессор
ММА им. И. М. Сеченова, Москва
