Особенности лечения доброкачественной гиперплазии предстательной железы у больных с высоким риском прогрессии заболевания
Введение
Доброкачественная гиперплазия предстательной железы (ДГПЖ) — одно из наиболее частых заболеваний, встречающихся у пожилых мужчин. Распространенность заболевания увеличивается с возрастом, а морфологические признаки доброкачественной гиперплазии простаты обнаруживаются примерно у 90% мужчин старше 80 лет [1].
Основным клиническим проявлением ДГПЖ являются симптомы нижних мочевых путей (СНМП). У мужчин четвертой декады жизни СНМП встречаются примерно в 3,5% случаев, в то время как у пациентов старше 70 лет клинические проявления ДГПЖ возникают в 35% случаев [2]. СНМП значительно ухудшают качество жизни пациентов. В ряде исследований показано, что тяжелые СНМП сильнее беспокоят пациентов, чем такие серьезные заболевания, как артериальная гипертензия, сахарный диабет, стенокардия напряжения и др [3]. Увеличение продолжительности жизни и старение населения приводит к тому, что врачи все чаще сталкиваются с пациентами с выраженными симптомами ДГПЖ. Такие особенности пациентов, как пожилой возраст, тяжелые сопутствующие заболевания, требуют эффективного и безопасного лечения, облегчающего симптомы заболевания и улучшающего качество жизни.
В последние годы стало очевидным, что гиперплазия предстательной железы, несмотря на доброкачественную природу, — прогрессирующее заболевание. Прогрессия проявляется в усилении расстройств мочеиспускания, ухудшении качества жизни, возрастании риска острой задержки мочи (ОЗМ) и необходимости хирургического вмешательства.
Естественное течение ДГПЖ можно проследить в крупных популяционных исследованиях и в плацебо-группах двойных слепых рандомизированных исследований. Одно из них — Olmsted county study — популяционное исследование, в течение 12 лет наблюдавшее 2115 мужчин 40–79 лет. В начале исследования 26% мужчин в возрасте 40–49 лет имели умеренные и сильные СНМП. В возрасте 70–79 лет распространенность СНМП составляла 46%. За время наблюдения отмечались признаки прогрессии заболевания: усугубилась тяжесть СНМП, увеличился объем предстательной железы, ухудшились уродинамические показатели. Средний ежегодный прирост тяжести симптомов по международной шкале IPSS (International Prostate Symptom Score) составил 0,18 баллов/год, ежегодно объем простаты увеличивался в среднем на 1,9%, пиковая скорость потока мочи (Qmax) в среднем ежегодно уменьшалась на 2,1%. Суммарная встречаемость ОЗМ за 4 года составила 2,7%. Всего 3% мужчин были прооперированы по поводу ДГПЖ [3–7].
Интересные данные были получены в двойном слепом плацебо-контролируемом исследовании PLESS (Proscar long-term efficacy and safety study). В плацебо-группе за время 4-летнего наблюдения не было отмечено достоверного усугубления СНМП, снижения скорости потока мочи. Однако в среднем объем простаты ежегодно увеличивался на 14%. За 4 года был отмечен высокий уровень ОЗМ — 7% и оперативных вмешательств — 10% в группе, не получавшей лечение [8].
Исследование MTOPS (Medical therapy of prostatic symptoms) стало первым двойным слепым рандомизированным плацебо-контролируемым исследованием, изучившим влияние медикаментозной терапии на прогрессию ДГПЖ. Клиническая прогрессия заболевания определялась как увеличение суммарного количества баллов по шкале IPSS ≥ 4, возникновение ОЗМ, острой почечной недостаточности, связанной с ДГПЖ, рецидивирующих инфекций мочевых путей, недержания мочи. В плацебо-группе в течение 5 лет наблюдения клиническая прогрессия заболевания наблюдалась у 16,6% пациентов. Наиболее частым проявлением прогрессии (79,5%) явилось субъективное ухудшение СНМП (увеличение IPSS ≥ 4). ОЗМ возникла у 2% пациентов из плацебо-группы, оперативное вмешательство по поводу ДГПЖ выполнено у 5%. За 5 лет наблюдения в группе, не получавшей лечение, объем предстательной железы увеличился на 24%, уровень простатического специфического антигена (ПСА) увеличился на 14% [9].
Данные исследований сделали очевидным тот факт, что ДГПЖ прогрессирует при отсутствии терапии, а выявление пациентов с высоким риском прогрессии заболевания является краеугольным в оптимизации их лечения.
Материалы и методы
На кафедре урологии и хирургической андрологии Российской медицинской академии последипломного образования в период с мая 2007 по декабрь 2007 года проведена оценка клинической эффективности и безопасности применения тамсулозина (Фокусин®) и финастерида (Пенестер) и их комбинированного применения у больных с симптомами нарушения функции нижних мочевых путей, обусловленных ДГПЖ после проведения трансректальной мультифокальной биопсии простаты. Сравнивались данные групп монотерапии Фокусином и комбинированного назначения препаратов. Оценивались результаты лечения 26 пациентов в возрасте от 59 до 77 лет. Средний возраст составил 68 лет, а период наблюдения составил 3 месяца.
Оценивалось влияние приема препаратов на выраженность СНМП по шкале IPSS, размеры предстательной железы на трансректальном ультразвуковом исследовании (ТРУЗИ), максимальную скорость потока мочи (Qmax), среднюю скорость потока мочи (Qave), функциональную емкость мочевого пузыря (Vcomp), объем остаточной мочи (Vres), уровень ПСА, артериальное давление, мнение пациента об эффективности терапии, а также наличие нежелательных явлений (НЯ), вызванных приемом препаратов.
Критериями включения в исследование были возраст старше 50 лет; выраженность симптомов по шкале IPSS ≥ 8 и ≤ 30 баллов; Qmax ≥ 4 мл/с и ≤ 15 мл/с; уровень остаточной мочи не более 125 мл; отсутствие клинических признаков рака предстательной железы (РПЖ), предварительная морфологическая верификация ДГПЖ с помощью трансректальной мультифокальной биопсией простаты.
Критериями исключения являлись хирургические вмешательства на органах малого таза, термотерапия; лучевая терапия органов малого таза; осложненное течение ДГПЖ (в т. ч. камни и дивертикулы мочевого пузыря); ОЗМ в анамнезе, известная непереносимость препаратов групп a-адреноблокаторов, ингибиторов 5α-редуктазы.
Всем пациентам до включения в исследование была проведена трансректальная мультифокальная биопсия предстательной железы (ПЖ) из 12–26 точек в связи с повышенным уровнем ПСА. У всех пациентов при гистологическом исследовании биоптатов была подтверждена ДГПЖ и отсутствовал РПЖ. С целью профилактики воспалительных осложнений после биопсии простаты пациентам был рекомендован прием препаратов группы фторхинолонов в течение 5 дней.
Пациенты в начале исследования заполняли опросник МИЭФ-5 для оценки сексуальной функции. Выявлено, что 85% пациентов либо не живут половой жизнью, либо имеют тяжелую степень нарушения эректильной функции. Учитывая эти данные, дальнейшая оценка сексуальной функции не проводилась.
Тамсулозин принимался ежедневно по 0,4 мг однократно после завтрака. Препарат не титруется. Финастерид принимался ежедневно по 5 мг однократно независимо от приема пищи.
После включения пациентов в исследование наблюдение было разделено на 3 визита. Первый визит через месяц после начала терапии, второй визит и третий визиты каждые три месяца терапии.
Результаты
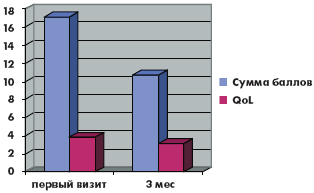
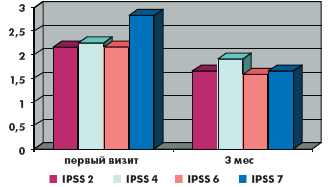
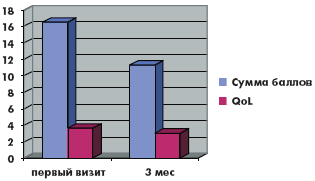
За время наблюдения на фоне лечения в обеих группах произошло значимое снижение как обструктивных, так и ирритативных СНМП, описываемых шкалой IPSS. Качество жизни пациентов (QoL), выраженное в баллах, в группе монотерапии тамсулозином улучшилось с 3,88 до 3,1, в группе комбинированной терапии с 3,66 до до 3,0. Количество баллов в вопросах в группе монотерапии снизилось соответственно: 1-й вопрос (с 1,9 до 1,2 балла), 2-й вопрос (с 3,2 до 1,7 балла), 3-й вопрос (с 2,5 до 1,4 балла), 4-й вопрос (с 2,8 до 1,7 балла), 5-й вопрос (с 2,9 до 2,1 балла), 6-й вопрос (с 1,2 до 0,9 балла), 7-й вопрос (с 2,9 до 1,7 балла). Количество баллов в вопросах в группе комбинированной терапии снизилось соответственно: 1-й вопрос (с 1,7 до 0,9 балла), 2-й вопрос (с 2,2 до 1,7 балла), 3-й вопрос (с 2,1 до 1,5 балла), 4-й вопрос (с 2,2 до 1,9 балла), 5-й вопрос (с 3,2 до 2,3 балла), 6-й вопрос (с 2,2 до 1,6 балла), 7-й вопрос (с 2,8 до 1,7 балла). Сумма баллов снизилась в группе монотерапии с 17,1 до 10,8 балла, а в группе комбинированной терапии с 16,5 до 11,3 балла (рис. 1–6).
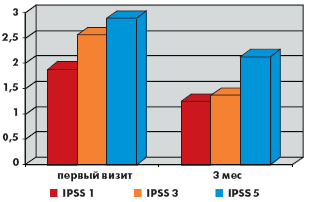
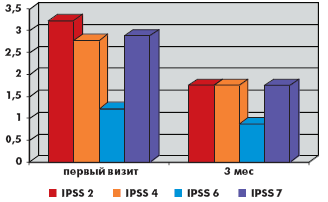
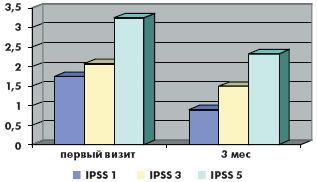
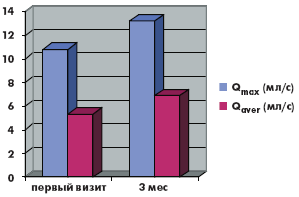
В группе монотерапии максимальная скорость мочеиспускания (Qmax) увеличилась с 10,8 мл/с до 13,3 мл/с, средняя скорость мочеиспускания (Qave) увеличилась с 5,3 мл/с до 6,9 мл/с, объем остаточной мочи (Vres) снизился с 21 мл до 2,5 мл.
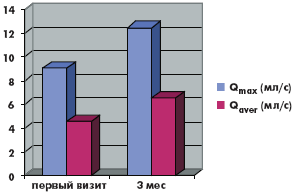
В группе комбинированной терапии Qmax увеличилась с 9,0 мл/с до 12,5 мл/с, Qave увеличилась с 4,6 мл/с до 6,6 мл/с, Vres снизился с 28,4 мл до 6,6 мл (рис. 7, 8).
В группе монотерапии значимого снижения объема простаты не было отмечено, снижение ПСА произошло с 7,2 до 5,0 нг/мл, снижение составило 30,3%.
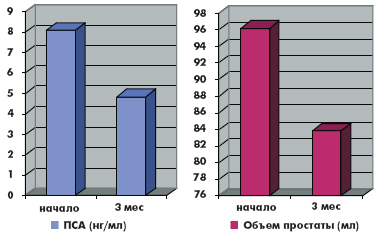
В группе комбинированной терапии отмечено уменьшение объема простаты с 96,2 до 83,8 мл (на 12,8%), произошло снижение уровня ПСА с 8,1 до 4,8 нг/мл (40,1%) (рис. 9).
Обсуждение
В исследованиях (Olmsted county study, PLESS и др.) показано, что объем ПЖ является важным фактором прогрессии заболевания. Так, у пациентов с исходным объемом ПЖ больше 30 см3 в 3,5 раза чаще выявлялись умеренные или тяжелые симптомы, в 2,5 раза чаще отмечалось снижение скорости мочеиспускания, в 3–4 раза увеличивался риск ОЗМ и необходимости в оперативном вмешательстве по сравнению с пациентами с небольшим объемом простаты. Таким образом, объем предстательной железы ≥ 30 см является фактором прогрессии ДГПЖ.
Независимым фактором прогрессии заболевания является ПСА.
ПСА обычно используется в диагностике и наблюдении за больными с раком предстательной железы. Но ПСА является органоспецифическим, а не болезнеспецифичным маркером. После исключения рака простаты (транскректальной мультифокальной биопсии простаты), повышение ПСА может быть объяснено наличием ДГПЖ.
Было доказано, что в доброкачественных железах уровень ПСА тесно коррелировал с объемом простаты. У 89% пациентов с ПСА ≥ 1,5 нг/мл объем простаты составляет более 30 см3. Анализ данных PLESS, MTOPS показывает, что ПСА ≥ 1,5 нг/мл является независимым фактором увеличения объема простаты, ухудшения потока мочи, усиления СНМП и прогрессии ДГПЖ.
В наблюдаемой нами группе получены схожие данные: у всех пациентов повышению ПСА сопутствовали выраженные СНМП, объем ПЖ составил более 30 мл и обструктивные нарушения уродинамических показателей.
Медикаментозное лечение за последнее десятилетие стало стандартным в ведении пациентов с симптоматической ДГПЖ при отсутствии абсолютных показаний к оперативному лечению. По-прежнему ведущими в лечении ДГПЖ остаются препараты двух классов: α1-адреноблокаторы и ингибиторы 5α-редуктазы.
Каковы же особенности лечения ДГПЖ у пациентов с высоким риском прогрессии заболевания? У мужчин с объемом ПЖ больше 30 см3 и/или ПСА ≥ 1,5 нг/мл лечение должно быть направлено на облегчение симптомов заболевания и уменьшение объема простаты.
Многочисленные исследования демонстрируют, что быстрое облегчение СНМН достижимо с помощью препаратов группы селективных α1-адреноблокаторов. Однако результаты MTOPS указывают на то, α1-адреноблокаторы не влияют на объем предстательной железы и не уменьшают риска ОЗМ и оперативного вмешательства по поводу ДГПЖ [11].
Ингибиторы 5α-редуктазы уменьшают объем предстательной железы, ингибируя продукцию дигидротестостерона, и приводят к облегчению СНМП. Показано, что именно у пациентов с большим объемом предстательной железы происходит наиболее значимое уменьшение СНМП в ответ на терапию ингибиторами 5α-редуктазы. Также недавно было продемонстрировано, что еще одним фактором прогноза эффективности лечения ингибиторами 5α-редуктазы и предотвращения прогрессирования заболевания является сывороточный уровень ПСА более 1,5 нг/мл.
Необходимо помнить о том, что через 3–6 месяцев постоянного применения ингибиторов 5α-редуктазы сывороточный уровень ПСА уменьшается вдвое. Применение правила удвоения ПСА позволяет сохранить ценность ПСА в скрининге рака простаты на фоне лечении ингибиторами 5α-редуктазы [11]. Особенностью исследования, проведенного кафедрой урологии РМАПО, является то, что все пациенты, включенные в исследование, имели высокий риск прогрессии заболевания, гистологически исключенный рак предстательной железы и подтвержденная ДГПЖ позволили назначить лечение препаратами 5α-редуктазы независимо от уровня ПСА.
В урологическом сообществе продолжаются активные обсуждения влияния ингибиторов 5α-редуктазы на либидо и эректильную функцию. Обратим внимание на то, что в нашем исследовании 85% пациентов либо не вели половую жизнь, либо имели тяжелую эректильную дисфункцию согласно опроснику МИЭФ-5. Приоритетным для больных являлось улучшение мочеиспускания.
Анализ результатов проведенного исследования показывает, что в обеих группах произошло значимое улучшение качества жизни пациентов, уменьшение СНМП, описываемых шкалой IPSS. И в группе монотерапии тамсулозином, и в группе комбинированной терапии тамсулозином и финистеридом улучшились уродинамические параметры мочеиспускания — Qmax и Qaver, снизился объем остаточной мочи.
На фоне комбинированной терапии уже через 3 месяца лечения выявлено снижение объема простаты и уровня ПСА — значимых факторов прогрессии заболевания. За время наблюдения не появилось признаков прогрессии заболевания.
В группе монотерапии тамсулозином также отмечена тенденция к снижению ПСА, что, очевидно, связано с противовоспалительным эффектом антибактериальной терапии, которую получали пациенты после биопсии простаты.
Отмечена хорошая переносимость и комплаентность лечения.
Эффекты проводимой терапии на прогрессию ДГПЖ будут оценены после более длительных сроков наблюдения за пациентами.
Заключение
СНМП, связанные с ДГПЖ, очень часто встречаются у пожилых мужчин и значительно влияют на их повседневную жизнь. У некоторых пациентов ДГПЖ быстро прогрессирует, приводя к развитию ОЗМ и необходимости хирургического вмешательства. В исследовании Armitage и соавт. показано, что у мужчин с ДГПЖ и сопутствующими заболеваниями спровоцированная ОЗМ увеличивает летальность [14].
Исторически сложилось, что как консервативное, так и оперативное лечение ДГПЖ основывалось на облегчении симптомов заболевания. Более глубокое понимание естественной истории заболевания, появившиеся данные крупных достоверных исследований сделали возможным расставить акценты в лечении ДГПЖ и направить усилия на предотвращение прогрессии заболевания.
Комбинированная терапия препаратами α1-адреноблокаторов и ингибиторов 5a-редуктазы признана терапией выбора у пациентов с высоким риском прогрессии ДГПЖ.
По вопросам литературы обращайтесь в редакцию.
В. Е. Охриц
А. Б. Богданов
Е. И. Велиев, доктор медицинских наук, профессор
РМАПО, Москва
