Лечащий Врач #3, 2008
Место метаболического синдрома в сердечно-сосудистом континууме
Еще во Фрамингемском исследовании (Framingham Offspring Study) метаболический синдром (МС), важнейшими признаками которого считали висцеральное ожирение, атерогенную дислипидемию и инсулинорезистентность, был выявлен у 25% пациентов с сердечно-сосудистыми заболеваниями (ССЗ). Однако в Национальную образовательную программу по Х-синдрому (The National Cholesterol Education Program’s Adult Treatment Panel III (ATP III)) дефиниции, алгоритм диагностики и лечения метаболического синдрома были включены только на рубеже XXI века, после публикаций G. Reaven, в которых было показано, что основной причиной МС является нарушение транспорта глюкозы внутрь клетки — инсулинорезистентность. МС был признан важнейшим и вторым по значимости (после дислипидемии) модифицируемым независимым фактором риска ССЗ [1].
В 2004 году ATP III была уточнена и в качестве критериев МС были предложены:
-
висцеральное (абдоминальное) ожирение;
-
атерогенная дислипидемия;
-
артериальная гипертония;
-
инсулинорезистентность ± нарушение толерантности к глюкозе;
-
провоспалительный статус;
-
тромбофилия.
Таким образом, по данным ATP III, МС является уникальным сочетанием основополагающих, важнейших и провоцирующих факторов риска ССЗ. Основополагающие (underlying) факторы риска ССЗ:
-
ожирение;
-
висцеральное ожирение;
-
гиподинамия;
-
атерогенная диета.
Важнейшие (major) факторы риска ССЗ:
-
курение;
-
артериальная гипертензия (АГ);
-
высокий уровень липопротеинов низкой плотности (ЛПНП);
-
низкий уровень липопротеинов высокой плотности (ЛПВП);
-
случаи раннего (< 55 лет) развития ишемической болезни сердца (ИБС);
-
пожилой возраст.
Провоцирующие (emerging) факторы риска ССЗ (метаболические факторы):
-
высокий уровень триглицеридов;
-
инсулинорезистентность;
-
небольшие размеры частиц ЛПНП;
-
провоспалительный статус;
-
тромбофилия.
МС независимо от дислипидемии, ожирения и сахарного диабета (СД) является предиктором высокого риска развития ССЗ и значительно увеличивает кумулятивный риск смертности от ССЗ. МС увеличивает относительный риск развития острого инфаркта миокарда (ОИМ) на 26%, инсульта — на 69%, в то время как риск характерных для СД микрососудистых осложнений при развитии МС возрастает лишь на 12% (исследования UKPDS, неопубликованные данные, 2005).
По данным исследования ARIC, риск ИБС линейно возрастает с увеличением количества компонентов МС. Для любого количества компонентов МС этот риск выше у женщин, чем у мужчин [2].
Относительный риск развития ИБС у мужчин и женщин зависит от количества компонентов МС (стандартизация по возрасту, расе, уровню холестерина (ХС) ЛПНП и курению; исследование ARIC, 2005).
МС наблюдается приблизительно у четверти взрослого населения США: по данным National Center for Health Statistics, U.S. DEPARTMENT OF HEALTH & HUMAN SERVICES, он имеется у 44% лиц старше 50 лет, у 10% женщин и 15% мужчин с нормальной толерантностью к глюкозе. Распространенность МС среди взрослого населения Западной Европы варьирует, так как зависит от используемых диагностических критериев [3]. По данным АТР III, частота МС составляет 22,4%, по критериям ВОЗ — до 25%, по критериям Европейской группы по исследованию инсулинорезистентности (Еuroреап Group for the study of Insulin Resistance, EGIR) — около 15%. Согласно данным исследования DECOR, распространенность МС среди взрослого населения Западной Европы составляет 15%, в Индии — 13%, в Иране — до 30%. По данным Первого Международного конгресса по преддиабету и МC (2005), в Китае МС зарегистрирован у 10% взрослого населения, в США, Австралии и европейских странах у 15–25% взрослых, и его частота выше у пожилых, недостаточно активных физически и страдающих ожирением людей. В странах Средиземноморья зарегистрирован высокий темп развития МС, достигающий 27% среди лиц в возрасте 20–50 лет. Парадоксально, но МС страдает до 40% городского населения Индии. В Польше, где эпидемиология факторов риска и ССЗ сопоставима с российской, МС выявляют у 30% взрослого населения [4].
В России исследования распространенности МС не проводились, однако ВОЗ располагает данными о настораживающей высокой распространенности основных этиопатогенетических факторов МС в России [1].
На сегодняшний день число больных с МС во всем мире в 2 раза превышает число больных СД 2 типа, и в ближайшие 20 лет увеличится еще на 50%. В литературе высокую распространенность МС в начале XXI века все чаще называют пандемией, побочным эффектом урбанизации и постиндустриального общества, поскольку важными факторами, способствующими развитию МС, является избыточное употребление пищи, содержащей насыщенные жиры, и низкая физическая активность [4–5]. Кроме того, образ жизни современного горожанина является причиной хронического эмоционального стресса и интеллектуального перенапряжения, приводящих к расстройству нейрогормональной регуляции вегетативных функций. Это выражается в нарушении баланса факторов так называемого прессорного, антидиуретического, пролиферативного звена (активация симпатической нервной системы, ангиотензин II, альдостерон, вазопрессин, система эндотелинов, фактор роста, аргинин-вазопрессин, система цитокинов, ингибитор тканевого активатора плазминогена) и депрессорного, диуретического, антипролиферативного звена (система натрийуретических пептидов, простациклин, брадикинин, тканевой активатор плазминогена, монооксид азота, адреномедуллин). Это нарушение баланса в итоге запускает каскад описанного в 1991 г. Dzau и Вraunwald «сердечно-сосудистого континуума», представляющего из себя цепь связанных между собой событий, начиная от факторов риска и заканчивая тяжелыми осложнениями ССЗ [5].
В последние годы к числу возможных этиопатогенетических механизмов МС относят активацию эндоканнабиноидной системы. Известно, что у здорового человека, живущего в состоянии равновесия, эндоканнабиноидная система обычно находится в спокойном состоянии и активируется «по требованию» под воздействием стресса, увеличивая толерантность к стрессу и формируя психофизиологическое состояние покоя. Одним из последствий этого состояния отдыха является стимуляция чувства голода как важнейшего источника удовольствия.
Тканевые феномены высокой активности эндоканнабиноидной системы
Активация эндоканнабиноидной системы происходит под воздействием специфических стимуляторов — эндоканнабиноидов на специфические рецепторы, находящиеся практически во всех отделах головного мозга, жировой ткани (адипозоцитах), желудочно-кишечном тракте и на мембранах клеток иммунной системы. У человека, находящегося в состоянии хронического стресса, у курящих, а также при выраженном ожирении происходит длительная патологическая активация эндоканнабиноидной системы, что увеличивает количество потребляемой пищи и потенцирует ожирение (рисунок).
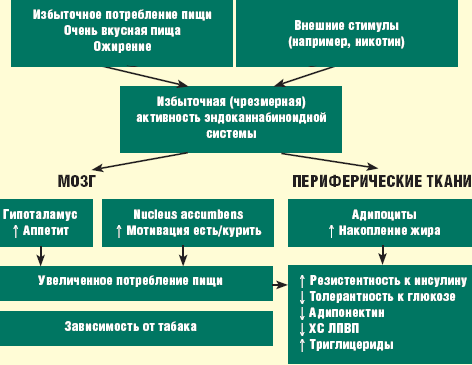
Известно также, что развитие МС генетически детерминировано. Установлен ген (существует более 50 мутаций), определяющий экспрессию инсулиновых рецепторов, который локализуется на 19-й хромосоме, кодирует инсулинорезистентность и гиперинсулинизм у потомков и родственников, болевших СД 2 типа. Так, в Фрамингемском исследовании у потомков была выявлена прямая связь между метаболическими факторами, часто выявляемыми при ожирении, и степенью нарушения толерантности к глюкозе. В течение 18 лет наблюдения у женщин-потомков с исходным индексом массы тела (ИМТ) выше 24 кг/м2 СД 2 типа развивался в 5 раз чаще, а АГ — в 2 раза чаще по сравнению с женщинами, чей ИМТ не превышал 21 кг/м2 [6].
С позиций концепции «сердечно-сосудистого континуума» МС находится в самом центре предикторов ССЗ, поскольку включает факторы риска, общие для АГ, атеросклероза, ИБС, цереброваскулярной болезни (ЦВБ) и СД [7].
Согласно современным представлениям, важнейшими этапами патогенеза МС являются:
-
избыточный вес + висцеральное ожирение;
-
инсулинорезистентность/гиперинсулинемия.
Абдоминальное ожирение сопровождается усиленным синтезом триглицеридов, липопротеинов очень низкой плотности (ЛПОНП), ЛПНП и уменьшением синтеза ЛПВП. При этом типе ожирения адипозоциты висцеральной жировой ткани активно секретируют свободные жирные кислоты и ряд гормонально активных веществ: лептин, свободные жирные кислоты, фактор некроза опухоли-α (ФНО-α), инсулиноподобный фактор роста (ИФР), ингибитор активатора плазминогена (ИАП-1), ангиотензиноген, интерлейкины, простагландины, эстрогены. Триглицериды в больших количествах накапливаются в печени и мышечной ткани и формируют инсулинорезистентность и гиперинсулинемию. Гиперинсулинемия снижает чувствительность тканевых инсулиновых рецепторов, вследствие чего глюкоза и жиры, поступающие с пищей, депонируются жировой тканью, что способствует прогрессированию висцерального ожирения. В свою очередь, при МС утрачивается чувствительность гипоталамических центров к лептину — гормону, регулирующему чувство насыщения. Его содержание увеличивается, и он начинает самостоятельно оказывать инсулиноподобное действие, стимулируя у человека постоянное чувство голода. Длительная гиперинсулинемия истощает секреторный аппарат β-клеток поджелудочной железы, что со временем и приводит к нарушению толерантности к глюкозе и развитию СД 2 типа. Воздействуя на гипоталамические ядра, гиперинсулинемия повышает тонус симпатической нервной системы, что является причиной комплекса сердечно-сосудистых реакций: увеличения сердечного выброса и частоты сердечных сокращений (ЧСС), снижения вариабельности сердечного ритма, активации ренин-ангиотензиновой системы, повышения общего периферического сопротивления сосудов, задержки натрия почками и гиперволемии. Избыток секреции ИАП-1 при инсулинорезистентности снижает активность фибринолитической системы и способствует развитию тромбофилии [7].
Инсулинорезистентность/гиперинсулинемия являются независимой причиной дисфункции эндотелия сосудов с увеличением секреции вазоконстрикторов (эндотелина, тромбоксана) и снижением секреции вазодилататоров (оксида азота (NO) и простациклина), что вносит свой вклад в развитие АГ [7]. Для АГ при МС характерно: отсутствие ночного снижения АД (non dippers); высокий уровень пульсового АД; тахикардия покоя; развитие гипертрофии миокарда с концентрическим ремоделированием левого желудочка сердца; высокое общее периферическое сосудистое сопротивление (ОПСС) сочетается с нормальным сердечным выбросом [8].
Кумуляция таких факторов риска, как ожирение, провоспалительная готовность и тромбофилия даже в молодом возрасте и при отсутствии тяжелой АГ и СД, может стать причиной тяжелых или летальных сердечно-сосудистых осложнений [9].
Клинический пример 1
Летальная массивная тромбоэмболия легочной артерии (ТЭЛА) у больной с тромбозом глубоких вен обеих голеней и правой бедренной вены на фоне ожирения, АГ и нарушения толерантности к глюкозе.
Больная И-ва, 40 лет, госпитализирована скорой медицинской помощью (СМП) в многопрофильный стационар, минуя приемное отделение с диагнозом «гипотония». Поводом к вызову СМП послужило внезапное появление выраженной одышки, слабости и головокружения накануне вечером. Больная госпитализирована в отделение интенсивной терапии (ОИТ) в тяжелом состоянии, но ясном сознании. В анамнезе в течение последних 3 лет артериальная гипертония, прогрессирующее ожирение, одни нормальные роды 10 лет назад. При осмотре: ожирение II–III степени, бледная, отеков и признаков варикозного расширения вен ног нет. Голени симметричны. По задней поверхности правого бедра определяется умеренная болезненность при глубокой пальпации. Частота дыхательных движений (ЧДД) 26 в минуту. АД 80/40, ЧСС 130 в минуту. Живот малодоступен пальпации из-за выраженного абдоминального ожирения, перкуторные границы печени у края реберной дуги, физиологические отправления вчера были без нарушений. На электрокардиограмме (ЭКГ) — синусовая тахикардия, SI — QIII. Признаков острой хирургической и острой очаговой неврологической патологии не выявлено. При лабораторном исследовании: Hb — 148 г/л, лейкоциты 15,3 × 109/л; СОЭ 12 мм/ч, тромбоциты 220 × 109/л, билирубин 10,4 мкмоль/л, мочевина 4,5 ммоль/л, глюкоза 15,6 ммоль/л, амилаза 105 Е/л. Аланиновая (АЛТ) и аспарагиновая (АСТ) аминотрансферазы 135 Е/л и 231 Е/л соответственно, общий белок 66 г/л. Больная консультирована ангиохирургом — высказано предположение о субмассивной ТЭЛА на фоне тромбоза глубоких вен правой ноги и начата интенсивная терапия: инфузия 200 мг Допмина и 100 мг стрептокиназы; болюсно введено 250 мг стрептокиназы, подкожно 10 000 ЕД гепарина. Однако, несмотря на временную стабилизацию гемодинамики, через 5 часов наблюдения больная скончалась.
Патологоанатомический диагноз
Основное заболевание: 180.2 тромбофлебит глубоких вен обеих голеней и правой бедренной вены.
Осложнения: тромбоэмболия основных ветвей легочной артерии. Отек головного мозга.
Сопутствующие заболевания: концентрическая гипертрофия миокарда (масса сердца 320 г, толщина стенки левого желудочка 1,6 см). Сахарный диабет 2 типа, впервые выявленный (глюкоза крови 15–19 ммоль/л).
Характерно, что в описанном выше клиническом случае без сомнения имевший место МС не был диагностирован ни при жизни клиницистами, ни после смерти патологоанатомами, что и сделало невозможной адекватную оценку риска, профилактику ССЗ и ее комплексный посмертный анализ. Следует, однако, отметить, что в МКБ-10 и во многих других классификациях МС отсутствует, также как и нет общепринятого представления о его клинико-морфологических проявлениях.
В клинической практике гиподиагностике МС несомненно способствует отсутствие этой рубрики в МКБ-10 и необходимость активного поиска и интегральной оценки компонентов МС. В последние годы критерии диагностики МС активно обсуждаются, поскольку место СД и нарушения толерантности к глюкозе все еще оцениваются исследователями по-разному. Изначально для диагностики МС наряду с наличием артериальной гипертонии, преддиабета (или сахарного диабета), дислипидемии требовалось определение и инсулинорезистентности по эугликемическому клямп-методу, который является дорогостоящей процедурой, требующей условий клиники [8]. Для упрощения диагностики в 1998 г. ВОЗ предложила схему выявления МС [1]. Согласно ей, имеющееся нарушение толерантности к глюкозе или СД + два нарушения (ожирение/абдоминальное ожирение, артериальная гипертония, гипертриглицеридемия и низкий уровень ХС ЛПНП) позволяют поставить диагноз «метаболический синдром».
Согласно критериям АТР III, принятым также Всероссийским научным обществом кардиологов, диагностика МС может опираться на выявление всего лишь любых 3 из 5 его составляющих:
-
абдоминальное ожирение (окружность талии у мужчин > 102 см и у женщин > 88 см);
-
уровень триглицеридов выше 150 мг/дл (1,69 ммоль/л);
-
уровень ХС ЛПВП < 39/50 мг/дл или 1,04/1,29 ммоль/л (для мужчин/женщин);
-
систолическое АД (САД) > 130 и/или ДАД > 85 мм рт. ст.;
-
уровень глюкозы в плазме крови 110 мг/дл (6,1 ммоль/л) и выше.
Весной 2005 г. Международный диабетический фонд (International Diabetic Foundation, IDF) вновь внес некоторые изменения в критерии МС. В сравнении с критериями АТР III были ужесточены предельные значения окружности талии для центрального ожирения в зависимости от этнически специфичных величин [10]. Так, при центральном ожирении для европеоидов окружность талии должна быть больше 94 см у мужчин и 80 см — у женщин. Для жителей Китая, Малайзии, Индии окружность талии для мужчин должна составлять не более 90 см, для женщин — не более 80 см. МС следует диагностировать при висцеральном ожирении в сочетании с любыми двумя из следующих четырех факторов: триглицериды > 1, ммоль/л или лечение дислипидемии; снижение ХС ЛПВП < 1,0 ммоль/л у мужчин и < 1,3 ммоль/л у женщин или проведение специфического лечения; АД 130/85 мм рт. ст. или антигипертензивная терапия, уровень гликемии натощак > 5,6 ммоль/л или ранее диагностированный СД. В Консенсусе Международной диабетической ассоциации были изложены рекомендации по первичной и вторичной профилактике МС [9–10].
По мнению экспертов, критерии, предложенные ВОЗ, преимущественно прогнозируют риск развития СД, а критерии ATP III — предопределяют риск развития сердечно-сосудистых осложнений. Действительно, полные клинические рекомендации по диагностике и лечению МС содержатся в обновленной в 2004 году Национальной образовательной программе по Х-синдрому, которая, прежде всего, предлагает подробный алгоритм диагностики МС в зависимости от количественной стратификации факторов 10-летнего риска ССЗ на основании фрамингемских критериев (шкала SCORE является наиболее близкой к содержащейся в ATP III) [8–11].
Многочисленные клинические рекомендации сегодня четко определяют основные цели лечения МС. Это:
-
борьба с ожирением и дислипидемией;
-
увеличение физической нагрузки;
-
контроль АГ;
-
коррекция нарушений углеводного обмена.
Однако разработка индивидуальной программы модификации компонентов МС все-таки должна быть основана на объективной количественной оценке спектра и концентрации факторов риска, которые формируют прогноз МС, неразрывно связанный с риском развития ССЗ и сердечно-сосудистых осложнений. Стратификация риска (например, 10-летнего фатального риска ССЗ по шкале SCORE) вооружает врача диверсифицированной стратегией первичной или вторичной профилактики сердечно-сосудистых осложнений, без которой успешная модификация факторов риска, а следовательно, и влияние на исходы ССЗ объективно невозможны. Отсутствие такой стратегии объективной оценки факторов риска ССЗ в практике первичной медицинской помощи означает у больных с многочисленными признаками МС неизбежное развитие фатальных сердечно-сосудистых осложнений [1].
Клинический пример 2
Развитие летального повторного трансмурального инфаркта миокарда (ИМ) у пациента с тяжелым атеросклерозом и МС и высокой концентрацией факторов риска ССЗ.
Больной Л-к, 55 лет, госпитализирован СМП в многопрофильный стационар с диагнозом (ДЗ): ИБС: постинфарктный кардиосклероз, стенокардия, мерцательная аритмия. Обострение хронической обструктивной болезни легких (ХОБЛ). Поводом к вызову СМП послужило нарастание одышки, ортопноэ, перебои в работе сердца в течение 4 предшествовавших дней. В анамнезе: в 1986 перенес ампутацию левой, а в 1999 году — высокую ампутацию правой ноги в связи с гангреной на фоне облитерирующего атеросклероза подколенных артерий, в 1994 году — обширный инфаркт миокарда. В течение последних 10 лет — АГ с редкими эпизодами повышения артериального давления до 160/100 мм рт. ст., около 4 лет — СД 2 типа, постоянная форма мерцания предсердий. В течение двух последних лет периодически в покое беспокоит сжимающая боль за грудиной, проходящая после приема нитроглицерина. Постоянно принимает 2 таблетки Дигоксина в сутки и 1 таблетку Фуросемида 1 раз в 3 дня. При осмотре состояние больного средней тяжести, цианоз губ, одышки в покое нет. ЧДД 22 в минуту. АД 130/80, ЧСС около 120 в минуту. Над легкими в нижних отделах справа — влажные мелкопузырчатые хрипы. Тоны сердца приглушены, ритм сердца неправильный. Живот мягкий безболезненный, печень у края реберной дуги, физиологические отправления в норме. На ЭКГ — тахиформа мерцания предсердий, гипертрофия левого желудочка. С диагнозом: ИБС: постинфарктный кардиосклероз, мерцательная аритмия, недостаточность кровообращения II ст., сердечная астма на фоне сахарного диабета 2 типа, средней тяжести, компенсированного и атеросклероза аорты, коронарных артерий и облитерирующего атеросклероза артерий нижних конечностей, артериальной гипертензии. Высокая ампутация обеих ног в связи с атеросклеротической гангреной; ХОБЛ: хронический бронхит вне обострения. Диффузный пневмосклероз — больной был госпитализирован в отделение плановой кардиологии. При лабораторном исследовании: Hb — 136 г/л, лейкоциты 16,4 × 109/л; СОЭ 34 мм/ч, тромбоциты 253 × 109/л, билирубин 19 мкмоль/л, мочевина 6,5 ммоль/л, глюкоза 9,7 ммоль/л, АЛТ 55 Е/л, АСТ 42 Е/л, общий белок 71 г/л. В клиническом анализе мочи: удельный вес 1020, желтая, прозрачность полная, реакция кислая, белок 0,016, глюкоза не определяется. Больному была назначена терапия, нацеленная на компенсацию недостаточности кровообращения: Лазикс, Верошпирон, Верапамил, Дигоксин. В течение недели лечения состояние больного без существенного улучшения, несмотря на обильный диурез. Сохраняющиеся одышку и рассеянные мелкопузырчатые хрипы расценивают как результат неадекватной диуретической терапии и возможное развитие пневмонии — дозу Лазикса и Верошпирона увеличивают, назначают Цефабол, хотя при рентгенографии грудной клетки данных за пневмонию не получено. На 10 сутки терапии у больного внезапно развивается выраженная одышка в покое, слабость, гипотония, сильная боль в культе левой ноги. Больного переводят в тяжелом состоянии в отделение кардиореанимации с вероятной ТЭЛА, где при консультации ангиохирурга нельзя исключить острый тромбоз бедренной артерии слева. Больному назначают фракционированный гепарин, адекватное обезболивание, допплерографию повздошных и бедренных артерий. Однако на фоне лечения состояние больного остается тяжелым, сохраняется гипотония и через 6 часов наблюдения в отделении больной умирает.
Патологоанатомический диагноз
Комбинированное основное заболевание: I22.0 повторный трансмуральный инфаркт миокарда, постинфарктный кардиосклероз в передней стенке левого желудочка. Стенозирующий атеросклероз коронарных артерий сердца (IV стадия, стеноз около 50%).
Фоновые заболевания:
-
Артериальная гипертензия. Эксцентрическая гипертрофия миокарда (масса сердца 700 г, толщина стенки левого желудочка — 2,0 см).
-
Сахарный диабет 2 типа (клинически).
Осложнения: двухсторонний гидроторакс (по 400,0). Острое общее венозное полнокровие. Отек легких.
Сопутствующие заболевания: операция ампутации обеих нижних конечностей на уровне средней трети бедра в связи с облитерирующим атеросклерозом в 1986 и 1999 годах. Стенозирующий атеросклероз повздошных артерий (III стадия, стеноз до 50%, пристеночные тромбы), левой бедренной артерии (IV стадия, окклюзия просвета). Атеросклероз аорты (III стадия, пристеночные тромбы в брюшном отделе). Хронический бронхит. Пневмосклероз и хроническая обструктивная эмфизема легких. Камни в желчном пузыре.
По вопросам литературы обращайтесь в редакцию.
А. Л. Верткин, доктор медицинских наук, профессор
О. В. Зайратьянц, доктор медицинских наук, профессор
Е. И. Звягинцева
Е. В. Адонина, кандидат медицинских наук
М. И. Лукашов, кандидат медицинских наук
О. В. Любшина, кандидат медицинских наук
О. Ю. Аристархова
М. Т. Гургенидзе
М. М. Шамуилова, кандидат медицинских наук
Э. Н. Микаберидзе
МГМСУ, Москва
