Лечащий Врач #4, 2008
Ювенильные артриты — опыт диагностики и лечения
Проблема воспалительных заболеваний суставов у детей — одна из самых обсуждаемых в педиатрии. Именно ювенильные хронические артриты нередко приводят к инвалидизации детей. За последние 10–15 лет достигнуты определенные успехи в лечении этой патологии. Число детей, передаваемых во взрослую сеть в состоянии инвалидности, значительно сократилось. Тем не менее, далеко не все проблемы решены. Статистика указывает на высокий процент детей с многолетним прогрессирующим течением заболевания, с функциональной недостаточностью, с признаками лекарственной болезни, вызванной противоревматическими средствами.
В течение длительного времени для обозначения указанной патологии использовался разнообразный спектр терминов: болезнь Стилла, ювенильный артрит, ювенильный ревматоидный артрит (ЮРА), инфекционный неспецифический артрит, ювенильный хронический артрит (ЮХА), деформирующий артрит.
В 1994 г. постоянным комитетом педиатрической ревматологии при ВОЗ было предложено устранить все прежние термины и называть все хронические воспалительные заболевания суставов у детей ювенильными идиопатическими артритами (ЮИА). В 1997 году педиатрическим субкомитетом ILAR (Международная лига ревматологических ассоциаций) в Durban (Южная Африка) классификационные аспекты были модифицированы, объединив под этим названием все артриты детского возраста, имеющие хроническое течение [9, 10, 11].
Ювенильный идиопатический артрит определяют как артрит неустановленной причины, присутствующий в течение 6 недель, возникший до 16-летнего возраста, при исключении других заболеваний. В табл. 1 представлены три классификации детских хронических артритов.
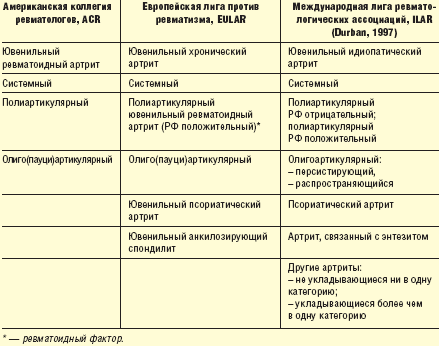
ЮИА представляют собой совокупность болезней, которые имеют различное начало, течение и исход, а также различную этиологию. По мнению составителей, такая классификация необходима для кооперации научных исследований и для лучшего лечения ЮИА. Классификация ILAR не является идеальной, она нуждается в доработке, так как примерно 20% детей с артритом либо не удовлетворяют критериям ни одной категории, либо удовлетворяют критериям сразу нескольких категорий. Это лишний раз подчеркивает трудности диагностики разных форм артритов у детей. Независимо от используемой в каждом конкретном случае классификации необходимо помнить, что ювенильный ревматоидный (хронический, идиопатический) артрит — это гетерогенное заболевание, которое нуждается в ранней диагностике и назначении адекватной терапии.
Опыт работы специализированного кардиоревматологического отделения Детской городской больницы № 2 г. Санкт-Петербурга, которым много лет руководил заслуженный деятель науки Российской Федерации профессор И. М. Воронцов, позволил выработать и подтвердить основные положения, касающиеся нозологии и терапии ювенильных артритов [4]. Традиционно мы используем название ЮРА и в диагностике руководствуемся критериями ЮРА, разработанными ревматологами стран Восточной Европы и России в конце 70-х годов.
Диагностические критерии ЮРА:
-
артрит продолжительностью 3 мес и более;
-
артрит второго сустава, возникающий через 3 месяца и позже;
-
симметричное поражение мелких суставов;
-
контрактуры;
-
теносиновит или бурсит;
-
мышечная атрофия;
-
утренняя скованность;
-
ревматоидное поражение глаз;
-
ревматоидные узелки.
Рентгенологические признаки:
-
остеопороз, мелкокистозная перестройка костной структуры эпифиза;
-
сужение суставных щелей, костные эрозии, анкилоз суставов;
-
нарушение роста костей;
-
поражение шейного отдела позвоночника.
Лабораторные признаки:
-
положительный ревматоидный фактор;
-
положительные данные биопсии синовиальной оболочки.
Общее количество положительных признаков:
-
ЮРА вероятный — 3 признака;
-
ЮРА определенный — 4 признака,
-
ЮРА классический — 8 признаков.
Несмотря на несовершенство этих критериев (как и всяких критериев), они помогают с наибольшей вероятностью выставить диагноз. ЮРА представляет собой хроническое воспалительное заболевание суставов с неясной этиологией и сложным, преимущественно аутоиммунным патогенезом, приводящее к постепенной деструкции суставов и сочетающееся у ряда больных с выраженными внесуставными проявлениями [2]. В случаях неясных и сомнительных применимо название ЮХА как диагноз наблюдения, стремясь через 3–6 мес от начала заболевания заменить его на более четкую нозологическую форму артрита. Принципиальным в диагностике является:
-
стремление к максимальной расшифровке всех форм острых и рецидивирующих артритов для исключения их вирусной или бактериальной природы;
-
разделение хронических артритов на ЮРА и ювенильный спондилоартрит (ЮСА). Эти группы имеют самостоятельные механизмы иммунопатогенеза, разную молекулярно-генетическую основу заболевания. Разными у этих групп являются и мишени иммунной атаки: синовиальная выстилка при ЮРА и хрящевые клетки при В27-ассоциированных артритах (табл. 2);
-
выделение трех основных типов ЮРА: моноолигоартрит, полиартрит, системная форма, коренным образом отличающихся по течению и исходам.
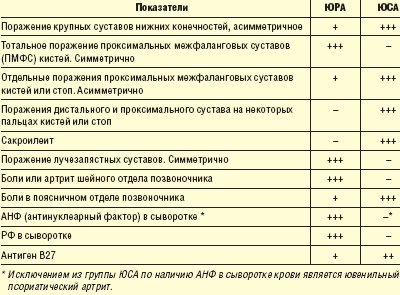
Описанные разграничения позволили сделать терапию более прицельной, отработать алгоритмы терапии при каждом варианте поражения.
Лекарственная терапия ЮРА подразделяется на симптоматическую (нестероидные противовоспалительные средства (НПВС) и глюкокортикоиды) и патогенетическую (иммуносупрессоры).
Согласно классификации, принятой на 5-м заседании Международной лиги по борьбе с ревматизмом ВОЗ (1993 г.), противоревматические лекарственные препараты подразделяются на модифицирующие симптомы заболевания, модифицирующие течение заболевания и контролирующие течение заболевания (табл. 3).

При лечении ювенильного ревматоидного артрита практически не используются соли золота, Д-пеницилламин и хлорамбуцил в связи с малой эффективностью и значимыми побочными свойствами. Ни один из современных препаратов в полной мере достоверно не предотвращает развитие костной деструкции, в связи с чем нет ни одного препарата, который можно было бы отнести к болезнь контролирующей группе антиревматических препаратов.
Основные положения терапии ЮРА:
-
НПВС и глюкокортикоиды являются симптоматическими средствами, оказывают противовоспалительное и болеутоляющее действие, но не останавливают прогрессирование болезни, деструкцию суставов.
-
В случае точной постановки диагноза ЮРА прогрессирующего течения, терапия должна быть «опережающей», т. е. включать в себя «базисные» средства, влияющие на прогрессирование.
-
В ряде случаев, даже при использовании всех вариантов гормонально-цитостатической терапии, не удается достичь желаемого эффекта, что заставляет искать новые группы препаратов.
-
Терапия любых форм артритов должна быть комплексной и включать ортопедические и реабилитационные мероприятия, которые следует начать в стационаре и продолжить в соответствующем санатории и на дому.
Олигомоноартрит детей младшего возраста. Значительно чаще встречается у девочек. Поражаются коленные, голеностопные суставы (чаще по одному, несимметрично), иногда отдельные пальцы на руках. Главная опасность — присоединение увеита, который при этой форме принимает хроническое течение и приводит к слепоте.
В отсутствии увеита артрит имеет довольно благоприятное течение, хотя может протекать длительно (в течение нескольких месяцев и лет). Распространение процесса на другие суставы происходит редко. В терапии используются НПВС, хотя существуют определенные трудности с выбором препарата из-за младшего возраста ребенка. Индометацин и Аспирин имеют возрастные ограничения из-за токсичности, Найз (нимесулид), разрешенный к применению, при длительном использовании также не безопасен. Бруфен, обладающий наименьшей токсичностью, имеет слабую противовоспалительную активность, в основном обладает болеутоляющим эффектом и может быть применен в ряде случаев. При выраженной клинической активности наиболее часто используемым препаратом является Вольтарен (диклофенак) (табл. 4).

Любой из нестероидных противовоспалительных препаратов имеет побочные явления, связанные прежде всего с действием на желудочно-кишечный тракт (гастриты, язвенные поражения, колиты) и почки (интерстициальные поражения). Поэтому их назначение должно быть обоснованным.
Существует индивидуальная чувствительность к различным НПВС, как в отношении эффективности, так и переносимости лечения. Не следует превышать рекомендованные дозы. Нецелесообразным является одновременное применение двух и более препаратов. Пациенты, получающие НПВС, требуют контроля печеночных ферментов (АЛТ, АСТ) и уровня креатинина в сыворотке крови, а при наличии жалоб со стороны органов желудочно-кишечного тракта (ЖКТ) — гастроэнтерологического обследования. Переносимость НПВС в детском возрасте лучше, чем у взрослых пациентов, но все-таки хочется предостеречь педиатров-ревматологов от избыточного, бездумного назначения НПВС при любых артритах.
Некоторые формы олигомоноартритов протекают практически без болей, без параклинической активности. Акцент в терапии в таких случаях необходимо сделать на местном применении средств (мази и гели с НПВС, аппликации с Димексидом, физиотерапевтическое лечение).
При недостаточной эффективности НПВС показано внутрисуставное введение глюкокортикоидов (ГК). В настоящее время для внутрисуставного введения используют метилпреднизолона ацетат и Бетаметазон. Бетаметазон — комбинированный препарат, содержащий быстродействующую (бетаметазона дифосфат) и длительно действующую (бетаметазона дипропионат) составляющие. Эффект от внутрисуставного введения ГК сохраняется в течение 6 недель. В крупные суставы вводится 1 мл Бетаметазона, а в средние — 0,5 мл. Не следует забывать, что локальное введение ГК дает и системный противовоспалительный эффект. Американские детские ревматологи при внутрисуставном введении ГК отдают предпочтение триамцинолону гексацетониду и триамциналону ацетониду в связи с их более длительным местным эффектом и минимальным системным действием [5, 6, 7, 8]. Внутрисуставное введение ГК проводится не более 3 раз в один сустав и не чаще чем 1 раз в месяц.
При неэффективности проводимой терапии в течение 6 месяцев даже при моноолигоартритах подключается иммуносупрессивная терапия в виде метотрексата в дозе 10 мг/м2/нед.
Олигомоноартрит с увеитом. Вовлечение в процесс глаз меняет тактику в сторону усиления терапии (назначение более сильных НПВС, местная терапия увеита). Требуется раннее назначение иммуносупрессивной терапии в виде метотрексата в дозе 10 мг/м2/нед. В случае тяжелого течения увеита — комбинация с циклоспорином в дозе 3,5–5 мг/кг/сут.
Иммуносупрессивная (базисная) терапия является главным компонентом в лечении различных форм ЮРА и при отсутствии противопоказаний должна быть назначена каждому пациенту с этим диагнозом. Особенно важно назначение иммуносупрессивной терапии на ранних стадиях заболевания, что благоприятно сказывается на прогнозе ЮРА. Основным свойством базисных препаратов, независимо от механизма действия, является способность подавлять пролиферацию иммунокомпетентных клеток, а также синовиоцитов и фибробластов, что позволяет купировать ревматоидное воспаление. Особенностью всех иммуносупрессивных препаратов является медленное развитие значимого клинического эффекта (обычно в течение 1–3 месяцев от начала приема). К базисным препаратам первого ряда относится метотрексат, лефлуномид (Арава), циклоспорин А, сульфасалазин (табл. 5). При недостаточной эффективности монотерапии каким-либо из базисных препаратов может быть избрана схема комбинированной базисной терапии препаратами первого ряда, но не более двух базисных препаратов у детей.

Препаратом выбора среди иммуносупрессивных средств первого ряда является метотрексат, который применяется перорально или внутримышечно один раз в неделю, а в остальные дни, с целью снижения токсических эффектов, рекомендуется назначение фолиевой кислоты от 1 до 5 мг в сутки. Оптимальное соотношение иммуносупрессия/токсичность при лечении метотрексатом большинство ревматологов отмечают при введении 15–20 мг/м2 поверхности тела в неделю. Увеличение дозы свыше 25 мг/м2 в неделю повышает частоту побочных реакций и, соответственно, изменяет это соотношение наоборот — токсичность/иммуносупрессия.
Иммуносупрессивные препараты второго ряда: циклофосфамид, хлорамбуцил, азатиоприн — используются в педиатрической практике ограниченно, преимущественно из-за их побочных эффектов.
При неэффективности терапии в течение 6–12 месяцев назначают биологические препараты. Этот термин применяется по отношению к лекарственным средствам, производимым с использованием биотехнологий и осуществляющим целенаправленное блокирование ключевых моментов воспаления с помощью антител или растворимых рецепторов к цитокинам, а также другим биологически активным молекулам. Особенностью этой группы препаратов является быстрое (нередко в течение нескольких дней) развитие выраженного улучшения, что объединяет биологическую терапию с методами интенсивной терапии. Характерная черта биологических средств — потенцирование эффекта в сочетании с базисными препаратами, в первую очередь метотрексатом. В России зарегистрирован препарат из этой группы — инфликсимаб (Ремикейд). Ремикейд представляет собой химерное моноклональное антитело к фактору некроза опухоли-α (ФНО-α). Показанием к биотерапии инфликсимабом у детей являются тяжелые формы ЮРА, не чувствительные к предшествующей иммуносупрессорной терапии. Стандартная доза — 3–6 мг/кг на введение. Начальная доза инфликсимаба составляет 3 мг/кг. Следующее введение препарата через 2 и 4 недели от начала лечения в той же дозе. В дальнейшем этот препарат вводится каждые 8 недель. В случае недостаточной эффективности проводимой терапии следует увеличить дозу инфликсимаба. Препарат вводят внутривенно капельно в течение не менее двух часов, со скоростью не более 2 мл/мин, с использованием инфузионной системы с встроенным стерильным апирогенным фильтром, обладающим низкой белковосвязывающей активностью (размер пор не более 1,2 мкм). Применяется в комбинации с метотрексатом в дозе не менее 15 мг/м2/нед. Ремикейд более эффективен, чем пульс-терапия метилпреднизолоном. Перед началом лечения необходимо полностью исключить наличие у пациента туберкулезной инфекции, ВИЧ-инфекции, хроническое носительство вирусов гепатита В и С. Наиболее частые побочные реакции: аллергические реакции, индукция аутоиммунных синдромов, угнетение противоинфекционного иммунитета и, возможно, противоопухолевого иммунитета. В настоящее время Ремикейд является самым эффективным препаратом в лечении тяжелых форм раннего и позднего ЮРА, но является дорогостоящим препаратом, что ограничивает его использование в практике. В перспективе лечения ЮРА, особенно резистентных форм к обычным базисным препаратам, биотерапия, вероятно, будет являться предпочтительной технологией управления ревматоидным воспалением.
Полиартрит. Классический полиартритический вариант у девочек старшего возраста представляет собой аналог взрослой формы ревматоидного артрита и, особенно при наличии положительного РФ, означает быстрое прогрессирование. Имеются признаки артрита мелких суставов кистей, суставов нижних конечностей. Очень быстро в процесс могут включиться практически все суставы, в том числе шейный отдел позвоночника, нижнечелюстной сустав. Именно при таком варианте недостаточным является применение монотерапии НПВС, необходимо раннее назначение иммуносупрессивной терапии. Препаратом выбора в такой ситуации является метотрексат, назначаемый в дозе 12–15 мг/м2/нед подкожно или внутримышечно. При неэффективности в течение 6–12 месяцев доза метотрексата может быть увеличена до 20 мг/м2/нед при хорошей переносимости. Эффективность и переносимость метотрексата улучшается при сочетании с глюкокортикоидами при внутрисуставном введении и/или коротким курсом per os в низкой дозе (не более 0,5 мг/кг), назначенной по альтернирующей схеме с полной отменой. При неэффективности высоких доз метотрексата в течение 3–6 месяцев и/или появлении побочных действий целесообразно использование комбинированной терапии с сочетанным использованием метотрексата с циклоспорином в дозе 3,5–5 мг/кг/сут [9] или метотрексата в дозе 10–12 мг/м2/нед и лефлуномида [1].
Относясь в целом отрицательно к гормональной терапии при суставных формах ЮРА, мы отмечаем положительный эффект от применения пульс-терапии Метипредом (20–25 мг/кг в сутки в течение трех дней в/в) в случае высокой параклинической активности процесса.
При неэффективности проводимой терапии в течение 6–12 месяцев — использование средств биологической терапии (инфликсимаб).
Системная форма ЮРА. Самый тяжелый вариант течения заболевания, характеризующийся высокой лихорадкой, сыпью, лимфаденопатией, гепатоспленомегалией. Может возникнуть полисерозит, миоперикардит, пульмонит. Отмечаются выраженные реактивные сдвиги в крови. Суставной синдром в дебюте нестойкий и представлен артралгиями и/или нестойкими синовитами. У некоторых больных очень быстро происходит «фиксация» суставного синдрома с быстрым возникновением и прогрессированием деструкции.
Диагностика системных форм ЮРА в дебюте заболевания очень сложна. Необходимо исключение генерализованных форм инфекции, иногда — онкологической патологии. В терапии таких состояний глюкокортикоидная терапия необходима. Она помогает быстро купировать активность процесса, облегчить состояние ребенка. В дебюте используется пульс-терапия Метипредом, в дальнейшем — курс пероральной терапии преднизолоном. Дозы (не менее 1 мг/кг в сутки) и длительность курса индивидуальны. По возможности быстро следует переходить на альтернирующую схему применения. При проведении пульс-терапии Метипредом показана антибиотикотерапия.
При системных вариантах показано в/в использование иммуноглобулинов (ВВИГ). При системных формах ЮРА ВВИГ вводят в дозе 1–2 г/кг на курс (ежедневно, не более 5 г на введение). Это купирует системные проявления, подавляет активность интеркуррентных инфекций. Противопоказано введение ВВИГ при селективном дефиците иммуноглобулина А.
При системных формах ЮРА в тяжелых случаях как препарат интенсивной терапии может назначаться ритуксимаб (химерные анти-CD20-моноклональные антитела).
Течение системной формы может осложниться синдромом макрофагальной активации. Это значительно усложняет терапию, ухудшает прогноз. Препаратом выбора в этих ситуациях является циклоспорин.
В заключение надо отметить, что терапия различных форм ЮРА, особенно тяжелых, прогрессирующих, является задачей непростой, требующей совместного усилия врача, больного ребенка, его родителей и семьи в целом. Основными целями лечения больных ЮРА является подавление иммунопатологической активности процесса, замедление и предотвращение деструктивных процессов в суставах, а также сохранение функциональной способности больного, улучшение качества его жизни. Многомесячная, а иногда и многолетняя медикаментозная терапия должна сочетаться с лечебной физкультурой, специальными упражнениями, направленными на сохранение функции суставов, предотвращение атрофии мышц, средствами ортопедической коррекции. Оптимальным является тесное сотрудничество специализированного отделения и санатория, а также обучение родителей и ребенка правильному функциональному стереотипу поведения, методикам физической реабилитации.
Эффективная терапия приводит к достижению ремиссии заболевания и улучшению качества жизни больного. Никогда не следует забывать, что агрессивность терапии должна соответствовать степени агрессивности болезни. Появление в последние годы новых биологических агентов (инфликсимаб, этанерцепт, ритуксимаб, адалимумаб и т. д.), существенно влияющих на течение заболевания, и первый опыт применения некоторых из них дает надежду на улучшение исходов заболевания.
По вопросам литературы обращайтесь в редакцию.
Г. А. Новик, доктор медицинских наук, профессор
Л. Н. Абакумова, кандидат медицинских наук, доцент
Н. М. Летенкова, кандидат медицинских наук, доцент
Н. В. Слизовский, кандидат медицинских наук, доцент
Н. Н. Слизовская
СпбГПМА, Санкт-Петербург
