Лечащий Врач #5, 2008
Внебольничные инфекции дыхательных путей: место «защищенных» аминопенициллинов
С момента открытия Alexander Fleming пенициллина до настоящего времени бета-лактамные антибиотики остаются одними из самых востребованных препаратов для лечения инфекций дыхательных путей. Начало клинического применения пенициллина «не омрачил» факт обнаружения штамма Escherichia coli, ферментативно разрушающей структуру антибиотика, однако впоследствии данный механизм резистентности оказался наиболее распространенным, что потребовало создания препаратов, способных ингибировать разрушающее действие ферментов — бета-лактамаз микроорганизмов [1].
Идея о том, что бета-лактамные структуры могут ингибировать продуцируемые микроорганизмами бета-лактамазы, воплотилась в жизнь в начале 70-х годов прошлого века, когда был получен первый ингибитор бета-лактамаз — клавулановая кислота [2]. В настоящее время в клинической практике доступны препараты, содержащие в своей структуре следующие ингибиторы бета-лактамаз: клавулановая кислота, сульбактам и тазобактам. Клавулановая кислота по своей структуре является производной Streptomyces clavuligeris, а сульбактам и тазобактам — полусинтетические производные пенициллановой кислоты (сульфоны) (рис.). Все ингибиторы бета-лактамаз имеют в своей структуре бета-лактамное кольцо, что обусловливает возможность образования стабильного комплекса между ингибитором и бета-лактамазой бактерий; это приводит к необратимому подавлению активности фермента и тем самым предотвращает инактивацию антибиотика.
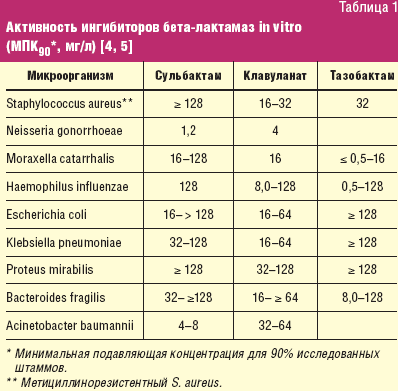
В целом клавуланат, тазобактам и сульбактам имеют сходный спектр ингибирующей активности, однако установлено, что сульбактам имеет ряд преимуществ перед другими ингибиторами. Во-первых, сульбактам в меньшей степени индуцирует продукцию хромосомных бета-лактамаз, характеризуясь низкими темпами роста резистентности микроорганизмов [3]. Во-вторых, сульбактам обладает природной бактерицидной активностью в отношении Acinetobacter spp., Bacteroides fragilis и Neisseria gonorrhoeae [4, 5], в отношении других инфекционных агентов собственная активность ингибиторов бета-лактамаз минимальна и сопоставима между собой (табл. 1). В-третьих, сульбактам обладает значительно большей, чем клавуланат или тазобактам, устойчивостью к изменениям рН раствора. С практической точки зрения это означает, что в условиях актуального инфекционно-воспалительного процесса, протекающего со значительными вариациями кислотности среды, сульбактам активнее проникает в ткани [6]. В-четвертых, сульбактам обладает высокой степенью абсорбции в желудочно-кишечном тракте (биодоступность сульбактам пивоксила при приеме внутрь составляет 85%); в отличие от клавулановой кислоты устойчив к метаболизму и выводится преимущественно в неизмененном виде, что определяет минимальную вероятность возникновения нежелательных реакций со стороны печени и желчевыводящих путей; устойчив в водных растворах (возможность длительного хранения).
В результате сочетания с ингибиторами аминопенициллины восстановили свою природную активность против Haemophilus influenzae, Moraxella сatarrhalis, стафилококков, гонококков, неспорообразующих анаэробов, помимо этого спектр антимикробной активности «защищенных» аминопенициллинов расширился за счет действия на ряд грамотрицательных микроорганизмов (Klebsiella spp. и др.) с природной устойчивостью к пенициллинам, что в конечном итоге обусловило тот ренессанс бета-лактамных антибиотиков, наблюдаемый и поныне [7]. В отношении препаратов, содержащих сульбактам, следует учитывать также собственную антибактериальную активность в отношении Acinetobacter spp., в т. ч. и против полирезистентных штаммов возбудителя, а также высокую антианаэробную активность, что создает перспективы использования препарата в лечении абсцесса легкого и эмпиемы плевры [8, 9].
До 2005 г. в арсенале российского врача присутствовал только один препарат, содержащий сульбактам, — ампициллин/сульбактам. Однако фармакокинетические недостатки ампициллина (низкая биодоступность при приеме внутрь и др.) оказались свойственны и комбинированному препарату, что значительно ограничило применение его пероральной формы.
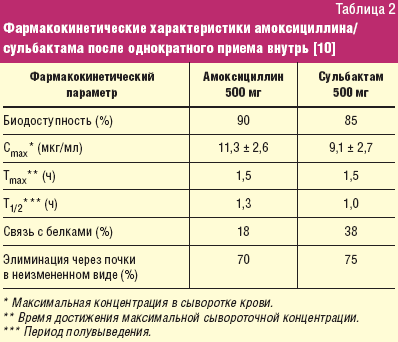
В настоящее время практическому врачу стал доступен амоксициллин/сульбактам*, как в пероральной, так и парентеральной форме (в том числе для внутривенного и внутримышечного применения). Оптимальное соотношение амоксициллина к сульбактаму при приеме внутрь составляет 1:1, а при парентеральном введении (внутримышечном и внутривенном) — 2:1, что обеспечивает оптимальные фармакокинетические свойства «защищенного» аминопенициллина. Время достижения максимальной концентрации в сыворотке крови составляет 1,5 часа, период полувыведения 1–1,3 часа. Большая часть выводится через почки в неизмененном виде (70–75%), при этом создавая в моче бактерицидные концентрации препарата (табл. 2).
Амоксициллин/сульбактам демонстрирует хороший профиль безопасности — по данным метаанализа (30 исследований по оценке эффективности и безопасности антибиотика) прием препарата сопровождался развитием нежелательных явлений (НЯ) в 9,8% случаев. Чаще всего наблюдались нарушения со стороны желудочно-кишечного тракта (диарея, тошнота, рвота), гиперчувствительность и кожная сыпь, при этом большинство НЯ носили транзиторный характер и не требовали отмены препарата [11]. Несомненным преимуществом препарата является меньшая, по сравнению с амоксициллином/клавуланатом, вероятность возникновения гепатотоксических реакций, ассоциированных с приемом антибиотика.
Высокая клиническая эффективность амоксициллина/сульбактама при различных инфекциях доказана в ходе контролированных клинических исследованиях и более чем 20-летней клинической практикой. Одним из основных показаний для назначения антибиотика являются инфекции дыхательных путей (ИДП).
Антибактериальная терапия внебольничных ИДП
Острый тонзиллофарингит (ОТФ). ОТФ в большинстве случаев (30–60% у взрослых, 15–40% у детей) имеет вирусную этиологию и не требует назначения антибиотиков [12, 13]. Среди же бактериальных возбудителей ОТФ ведущая роль принадлежит бета-гемолитическому стрептококку группы А (БГСА), реже (≤ 5%) ОТФ вызывают стрептококки групп C и G, а также другие микроорганизмы [14–17]. Наибольшую опасность при стрептококковом ОТФ представляют возможные осложнения, которые подразделяются на ранние (отит, синусит, паратонзиллярный абсцесс) и поздние (острый гломерулонефрит, острая ревматическая лихорадка), что, безусловно, требует назначения антибактериальной терапии (АБТ). Клиническими маркерами бактериальной инфекции являются: передний шейный лимфаденит, лихорадка, гиперемия и экссудат на задней стенке глотки и миндалинах. Показанием для назначения АБТ служит наличие всех четырех вышеуказанных критериев. Антибиотики показаны и в том случае, если присутствуют два или три из них в сочетании с положительным результатом тестирования на наличие стрептококкового антигена. Отсутствие этих критериев или наличие одного из них делают антибиотикотерапию тонзиллофарингита недостаточно обоснованной [15, 16].
Учитывая высокую чувствительность БГСА к бета-лактамным антибиотикам, препаратом выбора для лечения ОТФ является феноксиметилпенициллин [14]. Однако у 10–15% пациентов антибиотикотерапия феноксиметилпенициллином не приводит к эрадикации БГСА, что может быть связано с его разрушением бета-лактамазами присутствующей в носоглотке ко-патогенной микрофлоры. Вследствие этого при предшествующей (в течение 1 месяца) терапии антибиотиками или при неэффективности феноксиметилпеницилина следует назначать «защищенные» аминопенициллины [13].
Хронический (рецидивирующий) тонзиллофарингит. Под рецидивирующим стрептококковым тонзиллофарингитом понимают множественные эпизоды заболевания в течение нескольких месяцев при наличии соответствующих клинических и эпидемиологических данных, положительных результатов бактериологических или экспресс-методов диагностики БГСА, отрицательных результатов микробиологических исследований в промежутках между эпизодами заболевания и повышением титров противострептококковых антител после каждого случая болезни [15]. При хроническом тонзиллите в микрофлоре миндалин преобладают микроорганизмы, продуцирующие бета-лактамазы [18], что требует назначения «защищенных» аминопенициллинов либо цефалоспоринов III поколения [16].
Острый синусит (ОС). ОС — воспаление слизистой оболочки носовой полости и околоносовых пазух носа, развивающееся чаще всего как осложнение острой респираторной вирусной инфекции. В большинстве случаев этиология заболевания вирусная [20]. В случае же сохранения симптомов (гнойные выделения из носа и/или в ротоглотку, лихорадка, головная боль, боль и болезненность при пальпации в проекции синусов) более 7 дней можно предположить бактериальную природу синусита. Чаще всего возбудителями являются S. pneumoniae (20–43%) и H. influenzae (22–35%), реже встречаются M. catarrhalis, БГСА, S. aureus и другие микроорганизмы [20, 21].
При легком течении ОС (если клинические симптомы сохраняются более 10 дней без улучшения или прогрессируют) у пациентов, не получавших антибиотики в предшествующие 4 недели, препаратом выбора является амоксициллин. В качестве альтернативы могут использоваться ингибиторозащищенные аминопенициллины или цефуроксим аксетил [22].
Легкое течение ОС у пациентов, получавших антибиотики в предшествующие 4–6 недель, а также у больных со среднетяжелым течением заболевания, не получавших антимикробную терапию в предшествующие 4–6 недель, предполагает назначение «защищенных» аминопенициллинов или цефуроксима аксетила; альтернативными препаратами являются респираторные фторхинолоны (левофлоксацин, моксифлоксацин, гемифлоксацин). При среднетяжелом течении ОС у пациентов, ранее получавших антибиотики, назначают ингибиторозащищенные аминопенициллины или респираторные фторхинолоны (только у взрослых). При тяжелой форме ОС антибиотики назначают парентерально, желательно в режиме ступенчатой терапии. Рекомендуется применять ингибиторозащищенные пенициллины, цефалоспорины II (цефуроксим), III (цефотаксим, цефтриаксон) или IV поколений (цефепим), а также карбапенемы. Длительность антибактериальной терапии при ОС обычно зависит от формы и степени тяжести заболевания, составляя, как правило, 7–10 дней [19, 23].
Острый средний отит (ОСО). ОСО — воспаление среднего уха, обычно возникающее как осложнение вирусных инфекций дыхательных путей. О распространенности заболевания говорят следующие данные — только в США с развитием ОСО у взрослых пациентов ежегодно связаны около 31 млн обращений за медицинской помощью и 20–25% назначений антибиотиков [24]. Чаще всего ОСО имеет бактериальную этиологию, основные возбудители — S. pneumoniae и H. influenzae (60–80% всех случаев заболевания). Редкими возбудителями ОСО являются M. catarrhalis, БГСА, S. aureus [25]. До настоящего времени тактика ведения пациентов с ОСО остается неоднозначной, так как заболевание имеет склонность к самоизлечению без проведения антибиотикотерапии, в особенности если возбудителем является M. catarrhalis или H. influenzae. Однако саморазрешение ОСО, вызванного S. pneumoniae, отмечается менее чем в 20% случаев, при этом пневмококковая инфекция обусловливает ряд серьезных осложнений заболевания, таких как бактериальный менингит, абсцесс мозга, тромбоз сигмовидного синуса, лабиринтит, парез лицевого нерва, сепсис. В этой связи целесообразность назначения антибиотиков при ОСО требует тщательного анализа степени тяжести и длительности сохранения клинических симптомов заболевания. При появлении первых признаков болезни рекомендована выжидательная тактика: назначение симптоматической терапии и динамическое наблюдение за состоянием пациента в течение ближайших 24 ч. Абсолютными показаниями к применению антибиотиков считаются возраст до 2 лет, тяжелые формы ОСО, сопровождающиеся выраженным болевым синдромом, температурой тела выше 38°C и сохранением симптомов более одних суток. Препаратом выбора при ОСО является амоксициллин. В случае отсутствия положительного эффекта (сохранение клинических симптомов и отоскопической картины ОСО) по прошествии 3 дней терапии рекомендуется отмена амоксициллина и назначение ингибиторозащищенных аминопенициллинов или цефуроксима аксетила внутрь либо 3-дневное назначение цефтриаксона в/м. В качестве альтернативы амоксициллину (особенно у детей, часто получающих АБТ) предлагается использование амоксициллина/сульбактама либо клавуланата, цефуроксима аксетила или цефтриаксона в качестве препаратов первого ряда. Продолжительность антибактериальной терапии при ОСО составляет 7–10 дней [26, 27].
Хронический синусит, хронический средний отит. При хронических синуситах и средних отитах чаще всего выделяют микробные ассоциации, анаэробов и грамотрицательную флору (E. coli, P. aeruginosa, K. pneumoniae, Proteus spp., Enterobacter spp. и др.). Реже встречаются S. aureus и H. influenzae [25]. Лечение как хронического синусита, так и отита предполагает комплексный подход. Обязательно взятие пункции пазухи или мазка из среднего уха с последующим бактериологическим исследованием. Кроме того, необходимо проведение антимикробной химиотерапии препаратами расширенного спектра, способными преодолевать действие бета-лактамаз и активными против анаэробной флоры. Препаратами выбора являются «защищенные» аминопенициллины и респираторные фторхинолоны (левофлоксацин, моксифлоксацин) [19, 25, 27]. Длительность антибактериальной терапии составляет в среднем 3–4 недели.
Эпиглоттит — быстро прогрессирующее воспаление надгортанника и окружающих тканей, которое может привести к полной обструкции дыхательных путей. Чаще всего встречается у мальчиков 2–4 лет. Клиническими симптомами заболевания являются: боль в горле, лихорадка, дисфония и дисфагия при отсутствии видимых изменений со стороны ротоглотки. Основной возбудитель эпиглоттита — H. influenzae типа В, реже (у взрослых пациентов) — S. pneumoniae, БГСА, S. aureus и анаэробы [27, 28]. Лечение эпиглоттита направлено на поддержание проходимости дыхательных путей (трахеостомия, интубация эндотрахеальной или назотрахеальной трубками) и эрадикацию H. influenzae. Препаратами выбора являются ингибиторозащищенные пенициллины, цефалоспорины II (цефуроксим), III (цефотаксим, цефтриаксон) или IV поколений (цефепим). Рекомендован внутривенный путь введения (возможна ступенчатая терапия), длительность антибиотикотерапии составляет 7–10 дней [28].
Обострение хронической обструктивной болезни легких (ХОБЛ). По современным представлениям до 75–80% обострений ХОБЛ имеют инфекционную природу и наиболее вероятными возбудителями обострения заболевания являются H. influenzae, S. pneumoniae и M. catarrhalis, удельный вес которых, по данным различных исследователей, составляет 13–46%, 7–26% и 9–20% соответственно. Реже выделяются H. parainfluenzae, S. aureus, P. aeruginosa и представители семейства Enterobacteriaceae [29].
Классическими признаками, характеризующими обострение заболевания, являются: появление или усиление одышки; увеличение объема отделяемой мокроты; усиление гнойности мокроты. Наличие всех трех вышеуказанных критериев описывается как I тип, двух из них — как II тип, одного — как III тип обострения заболевания [30]. Показаниями для назначения АБТ являются: обострение ХОБЛ I типа; обострение ХОБЛ II типа при наличии гнойной мокроты; тяжелое обострение ХОБЛ, требующее проведения респираторной поддержки.
Важнейшее значение имеет разделение на простое (неосложненное) и осложненное обострение ХОБЛ. В первом случае у пациентов отсутствуют факторы риска неэффективности антибиотикотерапии и для этой категории больных наиболее вероятными возбудителями являются H. influenzae, M. сatarrhalis, H. parainfluenzae, S. pneumoniae с природным уровнем чувствительности к антибиотикам. В качестве препаратов выбора рекомендуются амоксициллин или современные макролиды (азитромицин, кларитромицин). Альтернативой им является применение ингибиторозащищенных пенициллинов (амоксициллин/клавуланат) и респираторных фторхинолонов.
В свою очередь, у пациентов с признаками осложненного обострения ХОБЛ высока вероятность выделения полирезистентных микроорганизмов и для лечения рекомендуются «защищенные» аминопенициллины или респираторные фторхинолоны [29].
Внебольничная пневмония (ВП). В настоящее время ингибиторозащищенные аминопенициллины являются препаратами выбора в лечении нетяжелой ВП у амбулаторных больных в возрасте старше 60 лет и/или при наличии сопутствующих заболеваний (хронический бронхит/ХОБЛ, сахарный диабет, застойная сердечная недостаточность, хроническая почечная недостаточность, заболевания печени, дистрофия) [31]. Именно у такого рода пациентов заболевание возникает в результате влияния пенициллинорезистентных S. pneumoniae, а также H. influenzae, S. aureus и грамотрицательных бактерий семейства Enterobacteriaceae.
У госпитализированных пациентов с нетяжелой ВП рекомендуется парентеральное применение амоксициллина/сульбактама либо клавуланата (желательна ступенчатая терапия) в сочетании с макролидным антибиотиком (кларитромицин, азитромицин) для приема внутрь. В случае тяжелого течения ВП (лечение в условиях отделения реанимации и интенсивной терапии) «защищенные» аминопенициллины применяются в комбинации с внутривенным введением макролида [31].
Ингибиторозащищенные аминопенициллины являются препаратами первого ряда у пациентов, злоупотребляющих алкоголем, страдающих сахарным диабетом. Кроме того, амоксициллин/сульбактам либо клавуланат применяются в режиме монотерапии или в комбинации с макролидом для лечения пневмонии у лиц, проживающих в домах престарелых [32].
Эффективность амоксициллина/сульбактама при лечении взрослых и детей с ВП продемонстрирована в ходе многих клинических исследований. Так, например, согласно результатам многоцентрового исследования, участниками которого стали 84 пациента с ВП, клиническая эффективность ингибиторозащищенного аминопенициллина, применявшегося в дозе 1000 мг (875 мг амоксициллина и 125 мг сульбактама) 2 раза в сутки в течение 7 дней составила 97,4%. Следует отметить, что у 6,5% пациентов, включенных в исследование, была диагностирована пневмококковая бактериемия [33].
Российские врачи также обладают опытом применения препарата при ВП. В собственном исследовании изучалась эффективность и безопасность амоксициллина/сульбактама при лечении нетяжелой ВП у пациентов старше 60 лет и/или у больных с сопутствующими заболеваниями (хронический бронхит, сахарный диабет, застойная сердечная недостаточность и др.). В исследование было включено 27 больных ВП, средний возраст которых составил 61,7 ± 5,1 года. По данным исследования амоксициллин/сульбактам продемонстрировал высокую клиническую (92,6%) и бактериологическую эффективность (88,9%), наряду с хорошим профилем безопасности — частота НЯ составила 14,8% [34].
Абсцесс легкого. Более чем в половине случаев возникновение заболевания обусловлено анаэробными микроорганизмами — Fusobacterium nucleatum, Peptostreptococcus spp., Bacteroides spp., в остальных случаях выделяют ассоциации анаэробных и аэробных микроорганизмов (в первую очередь — K. pneumoniae и K. оxytoca, существенно меньшее значение имеют S. aureus, H. influenzae и S. pneumoniae). Общепринятым стандартом в лечении абсцесса легкого до настоящего времени остается применение бензилпенициллина по 2 млн ЕД внутривенно с интервалом 4 часа в комбинации с метронидазолом; в последующем, при достижении отчетливого клинико-рентгенологического улучшения, осуществляется переход на пероральную терапию амоксициллином и метронидазолом внутрь [35]. Однако слабой стороной такой терапии является тот факт, что 15–20% штаммов потенциальных возбудителей абсцесса легкого оказываются резистентными к бензилпенициллину (прежде всего, это фузобактерии и бактероиды). Кроме того, на сегодняшний день доказанным является преимущество линкосамидов (клиндамицин по 600 мг в/в с интервалом 6–8 ч с последующим переходом на прием антибиотика внутрь по 300 мг с интервалом 6 ч) по сравнению с традиционной терапией бензилпенициллином. В связи с этим российские эксперты в качестве препаратов выбора для эмпирической терапии абсцесса легкого рекомендуют ингибиторозащищенные аминопенициллины (амоксициллин/клавуланат, ампициллин/сульбактам) либо цефоперазон/сульбактам. При отсутствии этих антибиотиков либо их неэффективности могут использоваться карбапенемы, другие ингибиторозащищенные пенициллины (тикарциллин/клавуланат, пиперациллин/тазобактам) либо комбинации клиндамицина с аминогликозидами [36].
Эмпиема плевры. В этиологии заболевания ведущую роль занимают грамотрицательные бактерии (15–32%) и анаэробы (5–19%) — так называемая подострая/хроническая эмпиема плевры. На долю S. aureus приходится от 7 до 15% случаев, S. pneumoniae выделяется у 5–7% больных, еще реже встречается H. influenzae — острая, постпневмоническая эмпиема. В 20–25% случаев обнаруживают микробные ассоциации, прежде всего, анаэробов и аэробов, представленных грамотрицательными бактериями [37]. В большинстве случаев проводится именно целенаправленная антибактериальная терапия с учетом данных микробиологического исследования содержимого плевральной полости. Однако если гнойный выпот оказывается стерильным, назначаются антибиотики, активные в отношении вероятных возбудителей острой постпневмонической эмпиемы плевры, это, прежде всего, S. pneumoniae, S. pyogenes, S. aureus и H. influenzae. В данной клинической ситуации целесообразно применение цефалоспоринов II–IV поколения (цефотаксим, цефтриаксон, цефепим).
При подостром/хроническом течении эмпиемы препаратами выбора являются «защищенные» аминопенициллины (амоксициллин/клавуланат, амоксициллин/сульбактам, ампициллин/сульбактам, цефоперазон/сульбактам, тикарциллин/клавуланат), альтернативная терапия — цефалоспорины III–IV поколений, карбапенемы [36]. Как правило, без хирургического вмешательства невозможно добиться излечения пациента, и в большинстве случаев требуется торакотомическое дренирование, реже применяется торакоскопия и декортикация.
По вопросам литературы обращайтесь в редакцию.
А. А. Зайцев, кандидат медицинских наук
Е. В. Колобанова
А. И. Синопальников, доктор медицинских наук, профессор
ГИУВ МО РФ, Москва
