Лечащий Врач #5, 2008
Диагностика и лечение синдрома беспокойных ног
Сндром беспокойных ног (СБН) — сенсомоторное расстройство, характеризующееся неприятными ощущениями в нижних конечностях, которые появляются в покое (чаще в вечернее и ночное время), вынуждают больного совершать облегчающие их движения и часто приводят к нарушению сна [1, 4, 8]. СБН был впервые описан Thomas Willis в 1672 г., однако систематическое исследование синдрома началось лишь с 40-х годов XX века работами шведского невролога K. A. Ekbom, в честь которого СБН назвали синдромом Экбома [7].
Эпидемиология
Современные популяционные исследования показывают, что распространенность СБН среди взрослого населения составляет 5–10%, при этом примерно в двух третях случаев симптомы возникают хотя бы раз в неделю и в одной трети случаев — более чем два раза в неделю, существенно нарушая качество жизни [5, 15]. СБН встречается во всех возрастных группах, но чаще отмечается в среднем и пожилом возрасте (в этой возрастной группе его распространенность достигает 10–15%). Однако не менее трети случаев СБН впервые проявляется на втором-третьем десятилетиях жизни. У женщин СБН встречается в 1,5 раза чаще, чем у мужчин, причем эта диспропорция еще более усиливается за счет того, что женщины чаще обращаются за медицинской помощью по поводу СБН [21]. По данным ряда исследователей, с СБН связаны примерно 15% случаев хронической инсомнии [8].
Этиология
Более чем в половине случаев СБН возникает в отсутствие какого-либо другого неврологического или соматического заболевания (первичный, или идиопатический СБН). Первичный СБН, как правило, проявляется в первые три десятилетия жизни (СБП с ранним началом) и может носить наследственный характер. В различных клинических сериях СБН доля семейных случаев колебалась от 30 до 92%. Анализ семейных случаев свидетельствует о возможном аутосомно-доминантном типе передачи с почти полной пенетрантностью, но вариабельной экспрессивностью патологического гена. Предполагают как полигенную, так и моногенную природу заболевания. В некоторых семьях выявлена связь СБН с локусами на 12, 14 и 9 хромосомах. Возможно, в значительной части случаев заболевание имеет мультифакториальную природу, возникая в результате сложного взаимодействия генетических и внешних факторов [3, 5, 8].
Три основные причины вторичного (симптоматического) СБН: беременность, конечная стадия уремии и дефицит железа (при наличии анемии или в ее отсутствие). СБН выявляется у 15–52% больных с уремией, в том числе почти у трети больных, находящихся на диализе, почти у 20% беременных (часто симптомы появляются лишь во II–III триместре и исчезают в течение месяца после родоразрешения, но иногда стойко сохраняются). Кроме того, случаи СБН описаны при сахарном диабете, амилоидозе, криоглобулинемии, недостаточности витамина В12, фолиевой кислоты, тиамина, магния, а также алкоголизме, заболеваниях щитовидной железы, ревматоидном артрите, синдроме Шегрена, порфирии, облитерирующих заболеваниях артерий или хронической венозной недостаточности нижних конечностей. При многих из этих состояний СБН возникает на фоне симптомов аксональной полиневропатии. Описан СБН и у больных с радикулопатиями, а также с поражениями спинного мозга, как правило, шейного или грудного отделов (например, при травмах, спондилогенной шейной миелопатии, опухолях, миелитах, рассеянном склерозе). Симптоматический СБН чаще дебютирует после 45 лет (СБН с поздним началом) и обычно имеет тенденцию к более быстрому прогрессированию [2, 5].
СБН иногда выявляют у больных с болезнью Паркинсона, эссенциальным тремором, синдромом Туретта, болезнью Гентингтона, боковым амиотрофическим склерозом, постполиомиелитическим синдромом, однако остается неясным, объясняется ли это сочетание случайным совпадением (из-за высокой распространенности СБН), наличием общих патогенетических механизмов или применением лекарственных средств [2, 13].
Патогенез
Эффективность дофаминергических средств и возможность ухудшения симптомов под влиянием нейролептиков указывают на то, что ключевым звеном патогенеза СБН является дефектность дофаминергических систем. Однако характер этой дисфункции остается неясным. В последние годы с помощью позитронно-эмиссионной томографии (ПЭТ) у больных с СБН выявлено умеренное снижение захвата [18F]-флуородопы в скорлупе, что свидетельствует о дисфункции дофаминергических нейронов черной субстанции, но, в отличие от болезни Паркинсона, численность этих нейронов не снижается [20]. По мнению ряда авторов, ведущую роль в патогенезе СБН играет дисфункция не нигростриарной системы, а нисходящих диэнцефально-спинальных дофаминергических путей, источником которых служит группа нейронов, расположенных в каудальном отделе таламуса и перивентрикулярном сером веществе среднего мозга [13]. Эта система регулирует прохождение сенсорной импульсации через спинной мозг и, возможно, сегментарные механизмы двигательного контроля.
Четкий суточный ритм клинических проявлений СБН может отражать заинтересованность структур гипоталамуса, в частности супрахиазмального ядра, регулирующего суточные циклы физиологических процессов в организме. Усиление симптомов СБН в вечернее время можно также объяснить, основываясь и на дофаминергическую гипотезу: ухудшение совпадает по времени с суточным снижением уровня дофамина в мозге, а также с периодом наиболее низкого содержания железа в крови (ночью этот показатель снижается почти наполовину). Связь СБН с дефицитом железа может определяться важной ролью железа в функционировании дофаминергической системы [19].
Возникновение СБН на фоне поражений периферической нервной системы свидетельствует о важности дисфункции периферической нервной системы в генерации симптомов. По клинической картине, в том числе по суточному ритму симптомов и отзывчивости на лекарственные средства, СБН, связанный с поражением периферической нервной системы, мало чем отличается от первичного СБН, что свидетельствует об их патогенетическом родстве. Возможно, у части больных СБН полиневропатия, дефицит железа, злоупотребление кофе или другие факторы лишь выявляют имеющуюся наследственную предрасположенность, что отчасти размывает границу между первичным и вторичным вариантами СБН [2].
Клиническая картина
Клинически СБН характеризуется двумя основными группами симптомов: субъективными патологическими ощущениями и избыточной двигательной активностью, которые тесно связаны между собой. Сенсорные симптомы СБН представлены ощущениями зудящего, скребущего, колющего, распирающего или давящего характера, а также иллюзией «ползания мурашек». Некоторые больные жалуются на тупую мозжащую или интенсивную режущую боль, но чаще эти ощущения не имеют болезненного характера, хотя и бывают крайне тягостными и неприятными. Болезненные патологические ощущения, испытываемые пациентами, принято обозначать дизестезиями, неболезненные — парестезиями, однако граница между ними условна [4]. Патологические ощущения при СБН поначалу имеют ограниченную локализацию и чаще всего возникают в глубине голеней, реже (как правило, при полиневропатии) — в стопах. При последующем прогрессировании они нередко распространяются вверх, вовлекая бедра и руки, изредка туловище и область промежности. Неприятные ощущения обычно возникают с обеих сторон, но более чем в 40% случаев бывают асимметричными, а иногда даже односторонними.
Характерная особенность патологических ощущений при СБН заключается в зависимости от двигательной активности и позы. Обычно они возникают и усиливаются в покое (в положении сидя и особенно лежа), но уменьшаются при движении. Чтобы облегчить свое состояние, больные вынуждены вытягивать и сгибать конечности, встряхивать, растирать и массировать их, ворочаться в постели, вставать и ходить по комнате или переминаться с ноги на ногу. У каждого пациента формируется свой «репертуар» движений, помогающих ему уменьшить неприятные ощущения в конечностях. Во время движения неприятные ощущения уменьшаются или проходят, но стоит больному лечь, а иногда и просто остановиться, как они вновь усиливаются.
Симптомы СБН имеют четкий суточный ритм, появляясь или усиливаясь в вечерние и ночные часы. В среднем максимальной выраженности они достигают в период от 0 до 4 часов утра, а минимальной — в период от 6 до 10 часов утра. Первоначально у большинства больных симптомы появляются примерно через 15–30 минут после того, как они ложатся в постель. Но в последующем время их появления может становиться все более ранним, вплоть до дневных часов. В тяжелых случаях характерный суточный ритм исчезает, и симптомы становятся перманентными. Они могут возникать не только в лежачем положении, но и в положении сидя и способны сделать невыносимыми посещение кино или театра, полет на самолете, длительную поездку в автотранспорте.
Прямым следствием неприятных ощущений в конечностях и необходимости постоянно совершать движения является нарушение сна— инсомния. Больные долго не могут заснуть и часто просыпаются ночью. Следствием инсомнии является быстрая утомляемость и сниженное внимание в дневное время. Жалоба на плохой сон является ведущей у большинства больных, и именно она чаще всего приводит их к врачу. У многих пациентов отмечается сопутствующая депрессия.
Нарушения сна при СБН усугубляют периодические движения конечностями (ПДК), которые возникают во сне у 80% больных с СБН. Они представляют собой ритмичные кратковременные подергивания, которые чаще всего наблюдаются в ногах, носят стереотипный характер и включают тыльное сгибание больших пальцев стопы, иногда с веерообразным разведением остальных пальцев или сгибанием всей стопы. В более тяжелых случаях происходит также сгибание ног в коленных и тазобедренных суставах. ПДК продолжаются от 0,5 до 5 с и возникают сериями с интервалами в 20–40 с на протяжении нескольких минут или часов. В легких случаях ни сами больные, ни их близкие родственники не подозревают о наличии ПДК; они могут быть выявлены только с помощью полисомнографии. В тяжелых случаях движения не прекращаются всю ночь и могут быть причиной частых пробуждений. В целом интенсивность ПДК хорошо коррелирует с выраженностью проявлений СБН, поэтому их регистрация с помощью полисомнографии может служить надежным объективным методом оценки эффективности терапии СБН [11].
При общем и неврологическом осмотре у больных с первичным СБН обычно не выявляются какие-либо отклонения. Но при симптоматическом СБН можно обнаружить признаки соматического или неврологического заболевания, прежде всего полиневропатии.
Течение заболевания
При первичном СБН симптомы обычно сохраняются в течение всей жизни, однако их интенсивность может значительно колебаться — она временно усиливается в период стресса, вследствие употребления кофеинсодержащих продуктов, после интенсивных физических нагрузок, во время беременности. В большинстве случаев со временем отмечается тенденция к медленному нарастанию симптомов. Но иногда наблюдаются периоды стационарного течения или ремиссии, которые могут продолжаться от нескольких дней до нескольких лет. Длительные ремиссии отмечаются у 15% больных. При вторичном СБН течение зависит от основного заболевания. Ремиссии при симптоматических формах наблюдаются редко [3, 4, 5].
Диагностика
СБН относится к частым заболеваниям, но диагностируется редко — в основном из-за малой осведомленности практических (практикующих) врачей, которые зачастую склонны объяснять жалобы больных неврозом, психологическим стрессом, заболеваниями периферических сосудов, суставов, остеохондрозом позвоночника. Однако в большинстве случаев диагностика СБН несложна и основывается на жалобах больного. Критерии диагностики СБН, предложенные Международной исследовательской группой по СБН [4], представлены в таблице.
СБН приходится дифференцировать с акатизией, синдромом «болезненные ноги — движущиеся пальцы», гипническими подергиваниями, ночными крампи, парестетической мералгией, полиневропатией, фибромиалгией. Диагностировав СБН, следует исключить вторичный характер синдрома, проведя тщательное неврологическое и соматическое обследование больного. Объем лабораторного и инструментального обследования диктуется необходимостью исключения полиневропатии (в том числе с помощью электронейромиографии), анемии, уремии, сахарного диабета, хронических заболеваний легких, ревматических болезней, дефицита железа, магния и витаминов. Следует отметить, что о дефиците железа в организме более надежно свидетельствует уровень ферритина, а не сывороточного железа. При отклонении от типичной клинической картины синдрома или при неэффективности стандартной терапии показана полисомнография.
Общие принципы лечения
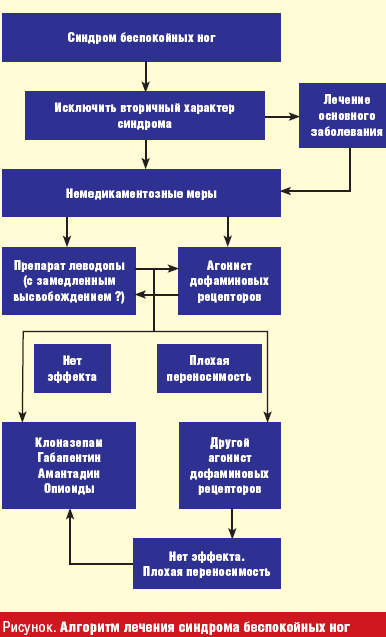
При симптоматическом СБН лечение в первую очередь должно быть направлено на коррекцию первичного заболевания или восполнение выявленного дефицита (железа, фолиевой кислоты, магния и т. д.). Коррекция дефицита железа с назначением препаратов железа показана в том случае, когда содержание ферритина в сыворотке ниже 45 мкг/мл. Обычно назначают сульфат железа (325 мг) в сочетании с витамином С (250–500 мг) 3 раза в день между приемами пищи. При первичном СБН основой лечения является симптоматическая терапия, с помощь которой удается добиться полного регресса симптомов у значительной части больных. Симптоматическая терапия включает как немедикаментозные меры, так и применение лекарственных средств.
Немедикаментозная терапия
В первую очередь важно выяснить, какие препараты принимает больной и по возможности отменить те из них, которые могут усиливать проявления СБН (нейролептики, метоклопрамид, антидепрессанты — как трициклические, так и селективные ингибиторы обратного захвата серотонина, препараты лития, тербуталин, антигистаминные средства и антагонисты Н2-рецепторов, нифедипин и другие антагонисты кальция).
Всем больным рекомендуют посильную умеренную физическую нагрузку в течение дня, соблюдение определенного ритуала отхода ко сну, вечерние прогулки, вечерний душ, сбалансированную диету с отказом от употребления в дневное и вечернее время кофе, крепкого чая и других кофеинсодержащих продуктов (например, шоколада или кока-колы), ограничение алкоголя, прекращение курения, нормализация режима дня.
Eще Eкbom (1945) отмечал, что симптомы СБН более выражены у больных с холодными стопами, тогда как при повышении температуры тела они облегчаются. В связи с этим теплая ножная ванна или легкий разогревающий массаж ног перед сном могут значительно улучшить состояние. В ряде случаев оказываются эффективными чрескожная электростимуляция, вибромассаж, дарсонвализация голеней, рефлексотерапия или магнитотерапия [7].
Лекарственная терапия
Лекарственные средства при СБН принято назначать в тех случаях, когда он значительно нарушает жизнедеятельность больного, вызывая стойкое нарушение сна, а немедикаментозные меры оказываются недостаточно эффективными. В легких случаях можно ограничиться приемом седативных средств растительного происхождения или назначением плацебо, которые могут дать хороший, но иногда лишь временный эффект.
В более тяжелых случаях приходится выбирать препарат из четырех основных групп: бензодиазепинов, дофаминергических средств, антиконвульсантов, опиоидов [17].
Бензодиазепины ускоряют наступление сна и уменьшают частоту пробуждений, связанных с ПДК, но относительно мало влияют на специфические сенсорные и двигательные проявления СБН, а также ПДК. Из бензодиазепинов чаще всего применяют клоназепам (0,5–2 мг на ночь) или алпразолам (0,25–0,5 мг). При длительном применении бензодиазепинов возникает опасность развития толерантности с постепенным снижением эффекта и формирования лекарственной зависимости. К отрицательным сторонам действия бензодиазепинов относится также возможность появления или усиления сонливости в дневное время, снижения либидо, усиления апноэ во сне, возникновения эпизодов спутанности сознания в ночное время, а также усугубления когнитивных нарушений у лиц пожилого возраста. В связи с этим в настоящее время бензодиазепины в легких или умеренно выраженных случаях применяют эпизодически — в периоды ухудшений, а в тяжелых случаях, требующих постоянного лечения, их назначают лишь при неэффективности дофаминергических средств [16, 17].
Дофаминергические препараты (препараты леводопы и багонисты дофаминовых рецепторов) — основные средства лечения СБН. Они влияют на все основные проявления СБН, в том числе и на ПДК. Дофаминергические средства столь эффективны при СБН, что положительная реакция на них может служить дополнительным критерием диагностики СБН, а ее отсутствие, как, например, и при болезни Паркинсона, следует считать основанием для пересмотра диагноза. Эффект дофаминергических средств при СБН проявляется в дозах, которые существенно ниже тех, что применяются при болезни Паркинсона. По-видимому, дофаминергические средства одинаково эффективны как при первичном, так и при симптоматических вариантах СБН [6].
Леводопу при СБН применяют с 1985 года, когда впервые была показана ее эффективность у этой категории больных. В настоящее время леводопу назначают в комбинации с ингибиторами ДОФА-декарбоксилазы бензеразидом (Мадопар) или карбидопой (Наком, Синемет). Лечение начинают с 50 мг леводопы (примерно 1/4 таблетка Мадопара «250»), которые больной должен принять за 1–2 ч до сна. При недостаточной эффективности через неделю дозу повышают до 100 мг, максимальная доза — 200 мг. Прием леводопы обеспечивает адекватный эффект у 85% больных. У многих больных она остается эффективной на протяжении многих лет, причем у части пациентов ее эффективная доза может оставаться стабильной и даже снижаться [10]. Препараты леводопы обычно хорошо переносятся больными СБН, а побочные эффекты (тошнота, мышечные спазмы, головная боль напряжения, раздражительность, головокружение, сухость во рту) обычно бывают легкими и не требуют отмены препарата. Учитывая быстрое наступление эффекта, отсутствие необходимости в титровании дозы препараты леводопы могут рассматриваться как средства выбора при перемежающемся ухудшении симптомов.
Тем не менее при длительном приеме у значительной части больных эффективность леводопы снижается, при этом длительность действия разовой дозы уменьшается до 2–3 ч, после чего может следовать рикошетное усиление симптомов СБН и ПДК во второй половине ночи. В этом случае рекомендуют увеличение дозы препарата или добавление его второго приема непосредственно перед сном или при ночном пробуждении. Однако при увеличении дозы леводопы рикошетное усиление симптомов может не устраняться, а лишь смещаться на ранние утренние часы, при этом его интенсивность может увеличиваться. Опыт показывает, что более разумной альтернативой в этой ситуации является переход на препарат леводопы с замедленным высвобождением (Мадопар ГСС). Препарат с замедленным высвобождением, действующий на протяжении 4–6 ч, обеспечивает хороший сон в течение всей ночи и предупреждает утреннее рикошетное усиление симптомов.
Примерно у половины больных на фоне длительного лечения леводопой симптомы постепенно начинают появляться все раньше (иногда даже днем), становятся более интенсивными и распространенными (так называемая «аугментация»). Чем выше доза леводопы, тем сильнее аугментация [14], поэтому увеличение дозы леводопы в этой ситуации лишь усугубляет положение, замыкая порочный круг. При применении Мадопара ГСС в качестве базисной терапии СБН рикошетное усиление и аугментация наблюдаются реже, чем при приеме стандартных препаратов леводопы. В связи с этим Мадопар ГСС в настоящее время часто используют как средство первоначального лечения СБН (1–2 капсулы за 1–2 ч до сна). Иногда разумно рекомендовать пациенту за 1 ч до сна 100 мг леводопы в составе стандартного препарата или растворимого быстродействующего препарата, что обеспечивает относительно быстрое наступление эффекта, и 100 мг леводопы в составе препарата с замедленным высвобождением (например, 1 капсулу Мадопара ГСС). При развитии аугментации рекомендуется либо заменить леводопу на агонист дофаминовых рецепторов, либо добавить его к ней (снизив дозу леводопы).
Агонисты дофаминовых рецепторов (АДР) стали применяться при СБН вскоре после того, как была показана эффективность леводопы, — с 1988 года. Опыт показывает, что эффективность АДР при СБН примерно соответствует эффективности леводопы. АДР могут рассматриваться как средства выбора при необходимости длительного ежедневного приема препаратов. При СБН применяют как эрголиновые препараты (бромокриптин, каберголин), так и неэрголиновые (прамипексол, пирибедил) [12, 14]. Неэрголиновые препараты имеют преимущество, поскольку лишены таких побочных эффектов, как вазоспастические реакции, плевролегочный, ретроперитонеальный фиброз, фиброз сердечных клапанов. Во избежание тошноты АДР принимают сразу после приема пищи, а их дозу подбирают путем медленного титрования. Прамипексол первоначально назначают в дозе 0,125 мг, затем постепенно увеличивают до достижения эффекта (обычно не более 1 мг). Эффективная доза пирибедила составляет 50–150 мг. При лечении бромокриптином начальная доза составляет 1,25 мг, а эффективная доза колеблется от 2,5 до 7,5 мг. Лечение каберголином начинают с 0,5 мг, а его эффективная доза составляет 1–2 мг. Указанную дозу обычно назначают однократно за 1–2 ч до сна, но в тяжелых случаях может быть необходим дополнительный прием препарата в ранние вечерние часы. Побочные эффекты при приеме АДР включают тошноту, утомляемость, головную боль, головокружение, дневную сонливость. Для предупреждения тошноты в начале лечения может быть назначен домперидон.
При длительном применении АДР признаки аугментации выявляются примерно у 25–30% больных, однако они почти никогда не бывают столь тяжелыми, как при лечении леводопой. Если один из АДР оказался неэффективным, можно попробовать заменить его другим препаратом из этой группы. Важно заметить, что дофаминергические средства, устраняя симптомы СБН, не всегда приводят к нормализации сна, что требует добавления к ним седативного препарата (бензодиазепина или тразодона).
Следует заметить, что, вероятно, благодаря отсутствию денервации и нормальной численности дофаминергических нейронов, дофаминергические средства оказываются эффективными при СБН в дозах, значительно ниже тех, что применяются при болезни Паркинсона. Более того, такие побочные эффекты, как дискинезии, психозы, импульсивность, компульсивные действия (обычные для болезни Паркинсона) исключительно редки при СБН.
В тех немногочисленных случаях, когда больной плохо переносит дофаминергические средства, а бензодиазепины неэффективны или вызывают непереносимые побочные эффекты, прибегают к антиконвульсантам или опиоидам. Из антиконвульсантов в настоящее время чаще всего применяют габапентин — в дозе от 300 до 2700 мг/сут [9]. Всю суточную дозу обычно назначают однократно в вечернее время. Опиоидные препараты (кодеин, 15–60 мг; дигидрокодеин, 60–120 мг, трамадол, 50–400 мг на ночь и др.) способны значительно уменьшить симптомы СБН и ПДК, но риск развития лекарственной зависимости делает их применение оправданным только в самых тяжелых случаях при неэффективности всех других способов лечения. Алгоритм лечения СБН представлен на рисунке.
При СБН возможно применение и некоторых других средств (клонидина, препаратов фолиевой кислоты, магния, витаминов Е, В, С), однако их эффективность не подтверждена в контролируемых исследованиях [18]. У части больных эффективны амантадин, баклофен, золпидем, бета-блокаторы (например, пропранолола) могут ослабить симптомы, но иногда вызывают их усиление.
Лечение СБН приходится проводить длительно на протяжении многих лет, в связи с чем очень важно следовать единой стратегии лечения. Иногда его проводят лишь в период усиления симптомов, но нередко больные для поддержания медикаментозной ремиссии вынуждены принимать те или иные препараты пожизненно. Лечение лучше начинать с монотерапии, выбирая препарат с учетом его эффективности у каждого конкретного больного и наличия сопутствующих заболеваний. При недостаточной эффективности монотерапии или в тех случаях, когда из-за побочных эффектов не удается достигнуть терапевтической дозы одного из препаратов, возможно применение комбинации средств с различным механизмом действия в относительно небольших дозах. В ряде случаев целесообразно проводить ротацию нескольких эффективных у данного больного препаратов, что позволяет сохранять их эффективность многие годы.
Особую трудность вызывает лечение СБН у беременных. Ни один из препаратов, обычно применяемых при СБН, не может считаться безопасным при беременности. Поэтому при развитии СБН во время беременности обычно ограничиваются немедикаментозными мерами (например, прогулкой и теплым душем перед сном) и назначением фолиевой кислоты (3 мг/сут), а также препаратов железа (при наличии их дефицита). Лишь в тяжелых случаях допускается применение малых доз клоназепама, а при их неэффективности — малых доз леводопы.
Для лечения депрессии у больных с СБН могут использоваться тразодон и ингибиторы моноаминоксидазы (МАО). Данные об эффекте селективных ингибиторов обратного захвата серотонина у пациентов СБН и ПДК противоречивы. Однако у части больных они, тем не менее, могут улучшать состояние, что объясняется подавлением активности дофаминергических нейронов. Трициклические антидепрессанты, как и нейролептики, противопоказаны.
Заключение
СБН — одно из самых частых неврологических заболеваний. Современные методы лечения позволяют добиться практически полного устранения симптомов и существенного улучшения качества жизни у подавляющего большинства больных. В связи с этим ключевое значение приобретает своевременная диагностика синдрома — врачи должны научиться распознавать за внешне «банальными» жалобами пациентов на бессонницу или неприятные ощущения в ногах это весьма своеобразное и, что особенно важно, курабельное заболевание.
Литература
-
Аверьянов Ю. Н., Подчуфарова Е. В. Синдром беспокойных ног // Неврологический журнал, 1997. № 3. С. 12–16.
-
Левин О. С. Синдром беспокойных ног // Диагностика и лечение экстрапирамидных расстройств / под ред. В. Н. Штока. М., 2000. С. 124–138.
-
Левин О. С. Синдром беспокойных ног // Экстрапирамидные расстройства. Руководство по диагностике и лечению / под ред. В. Н. Штока, И. А. Ивановой-Смоленской, О. С. Левина. М.: Медпресс-информ, 2002. С. 425–434.
-
Allen R. P., Walters A. S., Monplaisir J. et al. Restless legs syndrome // Slep. Med.,2003. V.4. P. 101–119.
-
Allen R. P. Contraversies and challenges in defining etiology and pathophysiology of restless legs syndrome // Am. J. Med., 2007. V.120. S. 13–21.
-
Becker P. M., Jamieson A. O., Brown W. D. Dopaminergic agents in restless legs syndrome and periodic limb movements of sleep: response and complications of extended treatment in 49 cases // Sleep, 1993. V.16. P. 713–716.
-
Ekbom K. A. Restless legs // Acta Med. Scand., 1945. V. 158. P. 5–123.
-
Earley C. J. Restless legs syndrome // N. Engl. J. Med., 2003. V. 348. P. 2103–2109.
-
Happe S., Klosch G., Saletu B. et al. Treatment of idiopathic restless legs syndrome (RLS) with gabapentin // Neurology, 2001. V.57. P. 1717–1719.
-
Kaplan P. W. Levodopa in restless legs syndrome // Ann Pharmacotherapy, 1992. V. 26. P. 244–245.
-
Montplaisir J., Godbout R., Poirier G. et al. Restless legs syndrome and periodic movements in sleep: physiopathology and treatment with l-dopa // Clin. Neuropharmacol.,1986. V. 9. P. 456–463.
-
Montplaisir J., Nicolas A., Denesle R. et al. Restless legs syndrome improved by pramipexole // Neurology, 1999. V.52. P. 938–943.
-
Ondo W., Jankovic J. Restless legs syndrome. Clinicoetiologic correlates // Neurology, 1996. V. 47. P. 1435–1441.
-
Paulus W., Trenkwalder C. Pathophysiology of dopaminergic therapy — related augmentationin rextlesslegs syndrome // Lancet Neurology, 2006. V. 5. P. 878–886.
-
Phillips B., Young T., Finn L. et al. Epidemiology of restless legs symptoms in adults//Arch. Int. Med., 2000. V.160. P. 2137–2141.
-
Saletu M., Anderer P., Saletu-Zyhlarz G. et al. Restless legs syndrome (RLS) and periodic limb movement disorder (PLMD) acute placebo-controlled sleep laboratory studies with clonazepam // Eur. Neuropsychopharmacol., 2001. V. 11. P. 153–161.
-
Silber M. H., Ehrenberg B. L., Allen R. P. et al. An algorithm for the management of restless legs syndrome // Mayo Clin Proc., 2004. V. 79. P. 916–922.
-
Steiner J. C. Clonidine helps restless legs syndrome // Neurology, 1987. V. 37(Suppl. 1). P. 278.
-
Trenkwalder C., Henning W. A., Walters A. S. et al. Circadian rhythm of periodic limb movements and sensory symptoms of restless legs syndrome // Mov. Disord., 1999. V.14. P. 102–110.
-
Turjanski N., Lees A. J., Brooks D. J. Striatal dopaminergic function in restless legs syndrome: 18F-dopa and 11C-raclopride PET studies // Neurology, 1999. V.52. P. 932–937.
-
Ulfberg J., Nystrom B., Carter N. et al. Prevalence of restless legs syndrome among men aged 18 to 64 years: an association with somatic disease and neuropsychiatric symptoms // Mov. Disord., 2001. V. 16. P. 1159–1163.
-
Walker S. L., Fine A., Kryger M. H. L-DOPA/carbidopa for nocturnal movement disorders in uremia // Sleep, 1996. V.19.
P. 214–218.
Таблица. Критерии диагностики СБН
О. С. Левин, доктор медицинских наук, профессор
РМАПО, Москва
