Лечащий Врач #6, 2008
Новые горизонты комбинированной терапии артериальной гипертензии
Артериальная гипертензия (АГ) остается самым частым сердечно-сосудистым заболеванием, распространенность которого в нашей стране превышает 39% [1]. Будучи основным модифицируемым фактором риска заболеваний сердца, сосудов и почек и одним из принципиально важных триггеров сердечно-сосудистого и почечного континуумов, АГ расценивается сегодня как болезнь, определяющая величину сердечно-сосудистой и отчасти почечной смертности как в национальном, так и в мировом масштабах [2].
Краеугольным камнем лечения АГ остается снижение повышенного АД до целевых значений и длительное удержание его на этом уровне. Правомерность данного подхода не вызывает ни малейших сомнений и подтверждается как результатами проспективных клинических испытаний, так и увеличением продолжительности жизни взрослого населения США и Западной Европы по мере улучшения популяционного контроля АГ. Сегодня может вызвать лишь улыбку утверждение R. D. Kennedy, писавшего в 1974 г., что «пожилые больные с уровнем диастолического АД ниже 120 мм рт. ст., не предъявляющие жалоб, не нуждаются в лечении».
Международные и национальные рекомендации [3–6] едины во мнении относительно целевых значений АД, которых необходимо достигать при терапии АГ. Для большинства больных это менее 140 и 90 мм рт. ст., а для больных сахарным диабетом (СД) и/или нарушениями функции почек целевой уровень АД ниже — менее 130 и 80 мм рт. ст. В последних Европейских рекомендациях по диагностике и лечению АГ круг лиц, у которых необходимо добиваться снижения АД ниже 130 и 80 мм рт. ст., существенно расширился. В эту группы вошли наряду с больными СД и/или поражениями почек также и пациенты с высоким и очень высоким уровнями сердечно-сосудистого риска, а также перенесшие инфаркт миокарда (ИМ) или мозговой инсульт (МИ) [5, 6]. Пациенты с метаболическим синдромом (МС) также вошли в группу высокого риска, соответственно, у них требуется достижение пониженных значений целевого АД [5, 6]. По-видимому, в дальнейшем можно ожидать пересмотра целевых значений АД в сторону уменьшения, поскольку зависимость между уровнем АД и величиной сердечно-сосудистого риска является непрерывной [7]. Фрамингемское исследование достоверно показало, что даже уровень АД 130–139 и 85–89 мм рт. ст. обеспечивает двукратное увеличение риска сердечно-сосудистых событий по сравнению с таковым при уровне АД ниже 120 и 80 мм рт. ст. [8].
Частота достижения целевого уровня АД в России остается невысокой. К 2006 г. удалось достичь контроля АГ у 21,5% пациентов [1], в то время как в США этот показатель уже в 2000 г. составлял 34% [3]. Этим во многом объясняется высокий уровень сердечно-сосудистой смертности и низкая продолжительность жизни в нашей стране [1].
Достижение и длительное поддержание АД на уровне целевых значений представляет собой непростую задачу, особенно когда речь идет о пониженных цифрах целевого АД (< 130 и 80 мм рт. ст.) у пациентов с высоким и очень высоким риском. Наиболее проблемную в этом отношении группу составляют больные СД и/или поражением почек. Анализ 10 крупных рандомизированных клинических испытаний (РКИ) антигипертензивной терапии, проведенный в 2002 г., показал, что у пациентов с СД целевой уровень диастолического АД (ДАД) < 85 мм рт. ст. был достигнут лишь в трети исследований, а целевой уровень систолического АД (САД) < 130 мм рт. ст. — ни в одном из 10 испытаний [9]. В испанском исследовании, проведенном в 47 клиниках, было отмечено, что даже в специализированных гипертонических отделениях частота контроля АГ (целевое АД ниже 130 и 85 мм рт. ст.) у больных СД и хронической нефропатией не превышает 13% и 17% соответственно, более чем в 3 раза уступая показателям контроля АД (47%) у лиц без диабета и нефропатии. Более низкие цифры ДАД (< 80 мм рт. ст.) достигаются еще реже — в 10 и 12% случаев соответственно [10]. Результаты отечественного исследования РОСА также показали, что частота контроля АГ у больных СД практически в 3 раза ниже, чем у больных без диабета, причем это соотношение сохранялось как в группе активной ступенчатой терапии, так и в группе произвольного лечения [11]. Расширение показаний для снижения АД ниже 130 и 80 мм рт. ст. за счет включения пациентов, перенесших ИМ, МИ, а также имеющих МС, делает эту проблему еще более актуальной.
Существенные трудности при достижении целевого АД возникают при лечении пожилых больных с изолированной систолической АГ (ИСАГ), поскольку известно, что добиться нормализации САД значительно труднее, чем ДАД. По данным американского популяционного исследования NHANES III достижение целевого уровня ДАД зарегистрировано у 73% больных АГ, тогда как САД — лишь у 34% [12], что диктует необходимость использования более активных подходов к лечению АГ у пожилых. Это может быть весьма сложно в условиях полиморбидности и большого числа принимаемых пожилыми больными лекарственных препаратов.
Причины недостаточно высокой частоты достижения целевого АД многочисленны и разнообразны. Однако трудно переоценить значение правильного выбора стратегии лечения АГ и тактики назначения конкретных антигипертензивных препаратов, что находится в прямой компетенции врача. Это прежде всего касается выбора между монотерапией и комбинированной терапией АГ. Не менее важной является и проблема приверженности пациентов к лечению, во многом определяемая свойствами назначенных врачом препаратов.
На сегодняшний день не вызывает сомнений тот факт, что монотерапия может быть эффективна не более чем у половины больных с АГ I степени. При более тяжелой АГ эффективность монотерапии прогрессивно снижаетcя.
Результаты множества проспективных РКИ антигипертензивной терапии убедительно показывают, что в подавляющем большинстве случаев невозможно достичь целевых значений АД с помощью монотерапии. Так, в исследовании HOT, считающемся сегодня классическим, на момент включения 59% пациентов получали монотерапию, тогда как через 3,2 года один препарат принимали лишь 32% пациентов. При этом отмечалась четкая зависимость между величиной целевого ДАД и частотой комбинированной терапии. Для достижения ДАД < 90 мм рт. ст. комбинированная терапия потребовалась в 63% случаев, ДАД < 85 мм рт. ст. — в 68% случаев, а для ДАД < 80 мм рт. ст. — в 74% случаев (причем средняя величина ДАД в этой группе составила 81 мм рт. ст., то есть цель так и не была достигнута) [13]. И в других РКИ частота назначения двух и более антигипертензивных препаратов также оказалась велика: в исследовании SHEP — 45%, MAPHY — 48,5%, ALLHAT — 62%, STOP-Hypertension — 66%, IPPPSH — 70%, INVEST — 84%, LIFE — 92%, COOPE — 93%, а в исследовании VA комбинация потребовалась всем пациентам.
Достижение более низких значений целевого АД у больных СД и/или поражением почек с помощью монотерапии вообще представляется практически нереальным. Метаанализ 5 исследований (UKPDS, HOT, ABCD, MDRD, AASK) у больных СД, почечной недостаточностью или обеими патологиями показал, что количество необходимых антигипертензивных препаратов колеблется между 2,5 и 3,7 [14]. В исследовании IDNT, включавшем наиболее тяжелую категорию пациентов — больных СД с хронической почечной недостаточностью (ХПН), достичь целевого уровня АД удалось только при назначении комбинации четырех антигипертензивных препаратов различных групп [15]. Даже достижение сравнительно высокого уровня АД в исследовании UKPDS (< 150 и 85 мм рт. ст.) потребовало трех и более антигипертензивных средств у 29% пациентов [16].
При этом необходимо заметить, что в описанных исследованиях применялись самые различные группы антигипертензивных препаратов, включая так называемые «новые» — антагонисты кальция (АК), ингибиторы ангиотензинпревращающего фермента (ИАПФ), блокаторы рецепторов ангиотензина (БРА), то есть необходимость в комбинированной терапии не зависела от исходно применявшегося класса лекарств.
Необходимость применения нескольких препаратов для достижения целевого АД подтверждает и реальная клиническая практика. По результатам отечественной фармакоэпидемиологической программы ПИФАГОР II 82% больных АГ принимают более одного препарата и среднее количество антигипертензивных препаратов составляет 1,72 на 1 пациента [17].
Дополнительным аргументом в пользу применения комбинированной терапии могут служить и результаты исследования VALUE. Это крупное РКИ, включавшее 15313 пациентов, среди прочего показало, что жесткий контроль и более быстрое снижение АД обеспечивает лучшие исходы независимо от применяемого лекарственного препарата. Так, в подгруппе с немедленным ответом на лечение (снижение САД ≥ 10 мм рт. ст. у ранее нелеченных пациентов или САД ниже исходного в группе леченных) относительный риск (ОР) комбинированного показателя сердечных событий достоверно снизился на 12%, инсульта на 17%, летальных исходов на 10% по сравнению с подгруппой медленного ответа [18]. Это испытание дало новые веские аргументы в пользу агрессивного, раннего и жесткого контроля АД. Очевидно, что такого эффекта легче достичь с помощью комбинированной терапии, частота которой в исследовании VALUE достигала 47,6% и 43,3% в группах валсартана и амлодипина соответственно.
Кроме того, необходимость применения в лечении АГ комбинированной терапии обосновывается многофакторной природой заболевания и гетерогенностью механизмов повышения АД. Сочетание различных факторов и механизмов у каждого пациента индивидуально и теоретически могло бы быть учтено при выборе терапии [19]. Однако в настоящий момент не существует надежных и доступных методов идентификации принципиальных механизмов повышения АД у конкретного больного АГ. Это приводит к тому, что на практике врачу нередко приходится заниматься длительным подбором антигипертензивной терапии методом «проб и ошибок», при этом без гарантии результата. Помимо того, в случае применения монотерапии зачастую возникает эффект «ускользания», развивающийся вследствие компенсаторной гиперактивации прессорных систем, не подавленных единственным антигипертензивным препаратом.
На сегодня именно комбинированная терапия является основной стратегией лечения АГ. Показания к ее назначению в международных рекомендациях претерпели значительную эволюцию и на сегодняшний день в Американских рекомендациях 2003 г. [3] комбинированная терапия показана всем больным, начиная со 2 стадии АГ, то есть при уровне АД ≥ 160 и 100 мм рт. ст., а также допускается как альтернатива монотерапии при меньших значениях АД. В предыдущих Европейских рекомендациях 2003 г. комбинированная терапия (низкодозовая) рекомендовалась в качестве альтернативы монотерапии уже при I степени АГ, а начиная со II степени — в большинстве случаев [4]. В новых Европейских рекомендациях 2007 г. показания к назначению комбинированной терапии еще более расширились, распространившись на пациентов с высоким и очень высоким риском, больных СД и МС, перенесших ИМ или МИ, то есть тех, у кого требуется достижение целевых значений АД на уровне ниже 130 и 80 мм рт. ст. [5]. Эти положения в полной мере адаптированы и отечественными Рекомендациями третьего пересмотра [6].
Комбинированная терапия обеспечивает следующие преимущества:
-
значительное усиление антигипертензивного эффекта за счет взаимного потенцирования действия отдельных препаратов. Это происходит вследствие подавления различных прессорных систем, а также нейтрализации контррегуляторных механизмов, уменьшающих эффективность отдельных препаратов;
-
снижение частоты нежелательных явлений. Во-первых, взаимное потенцирование антигипертензивного эффекта позволяет использовать в комбинациях более низкие дозы препаратов, что снижает частоту побочных эффектов. Во-вторых, большинство рациональных комбинаций обеспечивают взаимную нейтрализацию побочных действий отдельных препаратов;
-
повышение частоты ответа на лечение и частоты достижения целевых уровней АД. Комбинация лекарственных средств, обеспечивающая блокирование нескольких механизмов поддержания повышенного АД, увеличивает вероятность воздействия на прессорную систему, наиболее активную у данного конкретного пациента. Назначение комбинированной терапии в два раза увеличивает вероятность ответа на лечение;
-
более эффективную защиту органов-мишеней АГ и, следовательно, более выраженное снижение риска осложнений.
Однако данные преимущества реализуются только в случае рационального сочетания лекарственных препаратов, число которых в последних Европейских и в отечественных рекомендациях существенно сократилось, поскольку комбинации бета-адреноблокатора (бета-АБ) с диуретиком и бета-АБ с альфа-адреноблокатором признаны нерациональными [5]. Исключение давно ставшей традиционной комбинации бета-АБ + диуретик обусловлено ее неблагоприятным влиянием на метаболизм липидов и углеводов и потенцированием инсулинорезистентности, то есть, по сути, продиабетогенным действием.
К наиболее рациональным сочетаниям антигипертензивных препаратов относятся комбинации:
-
ИАПФ + диуретик;
-
ИАПФ + АК;
-
БРА + диуретик;
-
БРА + АК;
-
дигидропиридиновый АК + бета-АБ;
-
недигидропиридиновый АК + диуретик [5].
Вместе с тем комбинированной терапии присущи и недостатки. Наиболее существенным из них являются усложнение режима терапии и повышение ее стоимости, что негативно сказывается на приверженности больных к лечению. Последняя сама по себе является важнейшим фактором, определяющим частоту достижения целевых значений АД и, следовательно, эффективность терапии АГ и профилактики ее осложнений.
Рациональным решением данной проблемы является использование фиксированных комбинаций лекарственных препаратов.
К их несомненным достоинствам относятся:
-
снижение количества принимаемых таблеток, что сопровождается повышением приверженности пациентов к лечению;
-
простота назначения и титрования доз, что также улучшает приверженность и контроль за соблюдением рекомендаций врача;
-
дальнейшее уменьшение частоты нежелательных явлений, поскольку, в силу синергизма действия, в фиксированных комбинациях используются пониженные дозы лекарственных препаратов;
-
уменьшение стоимости лечения, так как фиксированные комбинации всегда дешевле, чем соответствующие лекарственные препараты, назначенные по отдельности.
Наиболее часто в нашей стране применяются фиксированные комбинации ИАПФ с диуретиком. Комбинация ИАПФ с АК до последнего времени была представлена на отечественном рынке лишь одним препаратом — Тарка (трандолаприл + верапамил). Поэтому представляет большой интерес появление нового комбинированного препарата «Экватор®», содержащего ИАПФ лизиноприл в дозе 10 мг и дигидропиридиновый АК амлодипин в дозе 5 мг.
Комбинация ИАПФ и дигидропиридинового АК является одной из наиболее привлекательных и обоснованных. Этим препаратам свойственно синергичное действие прежде всего в отношении снижения АД.
Подобный синергизм, с одной стороны, обеспечивается одновременным влиянием препаратов на разные прессорные системы, а с другой стороны — подавлением активации контррегуляторных механизмов, неизбежно развивающейся при использовании единственного антигипертензивного препарата.
Известно, что ренин-ангиотензин-альдостероновая система (РААС) и симпатическая нервная система (СНС) находятся в тесной физиологической взаимосвязи, обеспечивая тонкую регуляцию деятельности сердца и сосудов. Данная связь является двунаправленной, каждая система активирует другую при стимуляции [20]. В частности, ангиотензин II (АII) связывается с рецепторами симпатических нервных окончаний, способствуя выбросу норадреналина, а также действует постсинаптически, усиливая сократительный ответ на стимуляцию альфа-адренорецепторов. Проникая через гематоэнцефалический барьер и воздействуя на центры регуляции, АII повышает эфферентную симпатическую активность. С другой стороны, стимуляция бета-адренорецепторов юкстагломерулярного аппарата почек приводит к выбросу ренина и активации РААС. Эти механизмы играют важнейшую роль в формировании АГ, поддержании высокого уровня АД и развитии поражения органов-мишеней. С другой стороны, снижение АД с помощью лекарственных средств в определенный момент приводит к рефлекторной активации СНС и (частично за счет снижения перфузии почек) вторичной стимуляции РААС. Это может приводить к уменьшению эффективности антигипертензивной терапии, а также способствовать повышению потребности миокарда в кислороде и приводить к развитию осложнений, особенно у пациентов, страдающих ИБС.
Дигидропиридиновые АК, обеспечивая достаточно выраженную вазодилатацию, зачастую приводят к рефлекторной активации СНС (хотя этот эффект наиболее выражен для короткодействующей формы нифедипина), проявляющейся повышением плазменных концентраций катехоламинов и тахикардией [21]. ИАПФ, напротив, снижают АД, не только не увеличивая плазменные концентрации катехоламинов [22, 23], но и ингибируя симпатическую активность [24]. Частично этот эффект ИАПФ объясняется повышением тонуса n. vagus [25].
Кроме того, собственное натрийуретическое действие дигидропиридиновых АК, хотя и слабовыраженное, тем не менее, может способствовать компенсаторному повышению активности РААС. Добавление ИАПФ позволяет преодолеть активацию РААС и таким образом усиливает эффективность АК. С другой стороны, известно, что ИАПФ менее эффективны при низкорениновой форме АГ. Некоторое повышение активности РААС на фоне приема дигидропиридинового АК усиливает действие ИАПФ.
Вместе с тем известны существенные различия в антигипертензивной эффективности АК и ИАПФ. Так, АК более эффективны у пожилых, при объем-зависимой АГ и у лиц негроидной расы. ИАПФ, напротив, эффективнее в более молодых группах больных, у лиц белой расы и при сниженных значениях объема циркулирующей плазмы. Комбинация этих двух действующих начал в одном препарате существенно расширяет границы его применения, позволяя использовать его в разных возрастных и этнических группах, при различных патогенетических вариантах АГ.
Синергизм дигидропиридонового АК и ИАПФ в отношении снижения АД четко продемонстрирован на примере фиксированной комбинации амлодипина с беназеприлом. В двойном слепом РКИ в параллельных группах у 308 больных АГ в течение 8 недель изучалась эффективность лечения беназеприлом (20 мг), амлодипином (5 мг), их комбинацией или плацебо. Скорректированное на эффект плацебо снижение АД составило 12,4/6,7 мм рт. ст. в группе беназеприла, 16,2/8,8 мм рт. ст. в группе амлодипина и 24,7/13,2 мм рт. ст. в группе комбинированной терапии, то есть комбинация оказалась эффективнее каждого из препаратов в отдельности. Важно, что эффективность комбинации отмечена независимо от пола и возраста пациентов. При этом частота ответа на лечение (достижение ДАД < 90 мм рт. ст. или снижение ДАД ≥ 10 мм рт. ст.) была достоверно выше в группе комбинированной терапии (87,0%), чем в группах беназеприла (53,3%), амлодипина (67,5%) и плацебо (15,8%) [26].
Концепция комплексной модификации риска у больных АГ подразумевает помимо собственно снижения АД также и воздействие на механизмы поражения органов-мишеней на различных этапах сердечно-сосудистого и ренального континуумов. В этом отношении комбинация дигидропиридинового АК и ИАПФ выглядит весьма привлекательно, поскольку во множестве экспериментальных работ показано схожее действие обеих групп препаратов на ряд процессов, протекающих при АГ в сердце, почках и сосудах (табл. 1).
ИАПФ остаются лидерами по способности вызывать регресс гипертрофии левого желудочка (ГЛЖ), что определяется их способностью подавлять активность РААС, которая играет центральную патогенетическую роль в развитии поражения органов-мишеней, в том числе сердца. АК, как показали несколько метаанализов [27–29], по способности вызывать регрессию ГЛЖ уступают только ИАПФ, превосходя препараты других классов, а метаанализ Schmieder [30] показал преимущества дигидропиридиновых АК длительного действия (в частности, амлодипина) над другими классами препаратов. Поэтому применение препарата «Экватор®» у больных АГ с ГЛЖ представляется перспективным.
ИАПФ на сегодня являются основной группой нефропротективных средств. Способность этих препаратов замедлять прогрессирование диабетической и недиабетической нефропатии как у пациентов с АГ, так и при нормальных значениях АД, уменьшать экскрецию белка с мочой как на стадии микроальбуминурии (МАУ), так и на стадии манифестной протеинурии, а также снижать смертность больных ХПН убедительно доказана. Нефропротективные свойства лизиноприла продемонстрированы в двойном слепом плацебо-контролируемом исследовании EUCLID, в котором применение препарата в течение 2 лет у больных СД с нефропатией и ретинопатией обеспечило достоверное уменьшение экскреции альбумина на 18,8% и достоверное снижение частоты МАУ на 49,7% [31].
Считается, что среди АК значимыми нефропротективными свойствами обладает лишь верапамил, особенно при использовании его в комбинации с ИАПФ трандолаприлом как у больных с диабетической нефропатией (исследования EDICTA, TRAVEND, BENEDICT), так и в отсутствие СД (исследование PROCOPA). Данные в отношении дигидропиридиновых АК до последнего времени оставались разрозненными и противоречивыми. Однако в исследовании Sys-Eur применение нитрендипина сопровождалось уменьшением выраженности микроальбуминурии у больных СД [32], а в крупном РКИ INSIGHT применение нифедипина в виде гастроинтестинальной терапевтической системы ассоциировалось с более медленным снижением почечной функции, чем в группе комбинированной терапии диуретиками [33].
Комбинация лизиноприла с амлодипином, по-видимому, обладает значительным нефропротективным потенциалом. В двойном слепом рандомизированном сравнительном исследовании у больных СД 1-го типа с нефропатией, которые находились на постоянной терапии максимальными дозами лизиноприла, изучалась возможность дальнейшего снижения альбуминурии путем добавления к лечению либо амлодипина в дозе 10 мг/сут, либо кандесартана 16 мг/сут. Через 24 недели было отмечено достоверное снижение отношения альбумин/креатинин в моче в группе амлодипина на 54% и на 56% в группе кандесартана. Различий между группами отмечено не было, кроме того, уменьшение альбуминурии в обеих группах не коррелировало со степенью дополнительного снижения АД, что подчеркивает собственно нефропротективный эффект препаратов [34].
Синергизм дигидропиридинового АК и ИАПФ в отношении эндотелиальной дисфункции и процессов ремоделирования сосудов при АГ открывает новые перспективы по применению данной комбинации. Однако в данной области необходимы дополнительные исследования, поскольку антиатеросклеротический эффект ИАПФ пока не может считаться класс-эффектом. Наиболее четко он показан для рамиприла и периндоприла, а у эналаприла, например, таковой отсутствует. Антиатерогенные свойства АК, напротив, могут расцениваться как класс-эффект, поскольку продемонстрированы для всех представителей этого класса (как дигидропиридинов, так и недигидропиридинов) в экспериментальных работах и РКИ. Так, в плацебо-контролируемом исследовании PREVENT применение амлодипина у больных ИБС обеспечило достоверное уменьшение скорости прогрессирования атеросклеротического поражения сонных артерий [35]. И хотя не было выявлено влияния препарата на прогрессирование коронарного атеросклероза по данным коронарной ангиографии, но применение амлодипина обеспечило снижение частоты новых случаев нестабильной стенокардии на 33% и потребности в реваскуляризации миокарда на 43%. В исследовании CAMELOT [36] у больных ИБС с нормальным АД показано отсутствие прогрессирования атеросклероза на фоне приема амлодипина, тогда как в группе эналаприла отмечалась тенденция к его прогрессированию и несомненное прогрессирование в группе плацебо.
Таким образом, имеющиеся органопротективные свойства ИАПФ и АК позволяют сформировать дополнительные показания для применения этих препаратов в отдельных группах больных АГ, что нашло свое отражение в Европейских рекомендациях 2007 г. (табл. 2).
Очевидно, что комбинация дигидропиридинового АК амлодипина и ИАПФ лизиноприла позволяет существенно расширить список возможных показаний, обеспечивая органопротекцию широкому кругу больных АГ.
Немаловажно, что АК являются метаболически нейтральными препаратами, а ИАПФ, как известно, способны даже улучшать толерантность к глюкозе, поэтому комбинация амлодипина с лизиноприлом подходит для лечения пациентов с АГ на фоне СД, нарушенной толерантности к глюкозе и/или МС. Оба компонента данной комбинации являются безопасными в плане развития СД de novo. Оценка способности различных классов антигипертензивных препаратов уменьшать число новых случаев СД у больных АГ оценивалась в метаанализе [37] 22 РКИ, включавших 143153 пациента. В качестве референтного агента использовались диуретики, для которых ОШ было принято за 1,0. По влиянию на число новых случаев СД классы антигипертензивных препаратов и плацебо расположились в следующем порядке: БРА (ОШ = 0,57), ИАПФ (ОШ = 0,67,), АК (ОШ = 0,75), плацебо (ОШ = 0,77), бета-АБ (ОШ = 0,90). Таким образом, если сравнивать с плацебо, БРА, ИАПФ и АК достоверно снижают число новых случаев СД, тогда как диуретики и бета-АБ — увеличивают.
Последний аспект представляется весьма значимым, поскольку неуклонный рост числа больных СД 2-го типа во всем мире представляет собой важнейшую медико-социальную проблему.
Комбинация дигидропиридинового АК и ИАПФ позволяет также нейтрализовать некоторые побочные действия, свойственные входящим в них компонентам. В частности, одним из неблагоприятных эффектов АК является отечность голеней, частота развития которой достаточно высока и нередко служит причиной отмены препарата. Отеки голеней возникают примерно у 5% пациентов, получающих амлодипин в дозе 5 мг/сут, а при увеличении дозы до 10 мг/сут их частота возрастает до 25%. В основе развития этого побочного эффекта лежит артериолярная дилятация, приводящая к повышению внутрикапиллярного давления (внутрикапиллярной гипертензии) и, следовательно, усилению экссудации жидкости из капилляров в интерстициальное пространство (рис. 1а).
При этом не происходит повышения объема циркулирующей плазмы и задержки натрия, поскольку дигидропиридиновые АК обладают собственным натрийуретическим действием. Поэтому отеки, возникшие на фоне применения АК, не поддаются коррекции с помощью диуретиков. Однако они уменьшаются при использовании препаратов, снижающих внутрикапиллярное давление, в частности ИАПФ и БРА, которые дилятируют не только прекапилярные артериолы, но и посткапиллярное венозное русло (рис. 1б).
В нескольких работах было показано, что добавление к амлодипину ИАПФ беназеприла позволяет резко снизить частоту развития отеков и их выраженность. В частности, в одном из исследований при использовании амлодипина в дозе 5 мг/сут отеки отмечены у 5% пациентов, а при дозе 10 мг/сут — у 24% пациентов. При использовании в этом же исследовании фиксированных комбинаций 5 мг амлодипина с 10 мг либо с 20 мг беназеприла частота отеков составила всего 2,2% и 1,5% соответственно [38]. В исследование LOGIC включались пациенты с отеками, развившимися на фоне приема амлодипина. Перевод больных на прием фиксированной комбинации амлодипина и беназеприла позволил существенно уменьшить отеки у 80% пациентов, причем даже у принимавших сверхвысокие дозы амлодипина (до 20 мг/сут) [39].
Помимо этого, отмечено, что ИАПФ способны ослаблять рефлекторную тахикардию, вызванную приемом дигидропиридиновых АК [40]. На фоне совместного применения АК и ИАПФ реже возникают головные боли, приливы и покраснение лица [41], поскольку данные побочные эффекты АК дозозависимы, а фиксированные комбинации позволяют использовать АК в меньших дозах без потери общей антигипертензивной эффективности.
Эффективность и безопасность новой фиксированной комбинации амлодипина и лизиноприла Экватор® оценивались в многоцентровом двойном слепом плацебо-контролируемом РКИ HAMLET [42]. В исследование включались больные 18–65 лет с нелеченной или плохо контролируемой АГ I–II степени (АД 140–179/90–99 мм рт. ст.). В исследование не включались пациенты с симптоматической АГ, серьезными сердечно-сосудистыми и почечными осложнениями (ИМ или нарушения мозгового кровообращения за прошедшие три месяца, ХПН), злокачественными новообразованиями, тяжелыми заболеваниями печени или легких, гиперкалиемией и ожирением (индекс массы тела (ИМТ) > 35 кг/м2). Также исключались больные с ангионевротическими отеками и женщины детородного возраста при отсутствии надежной контрацепции. Исследование состояло из 14-дневного вводного периода (пациенты принимали плацебо) с последующим 8-недельным терапевтическим периодом, когда больных рандомизировали на 3 группы в зависимости от назначенного препарата: 1-я группа — 10 мг лизиноприла в день, 2-я группа — 5 мг амлодипина в день, 3-я группа — комбинация обоих препаратов в тех же дозах. После процедуры рандомизации в исследование был включен 181 пациент, 14 пациентов в последующем выбыло из исследования в ходе вводного периода. Таким образов, в испытании участвовали 175 пациентов, средний возраст которых составил 48,6 ± 10 лет, индекс массы тела 27,7 ± 3,7 кг/м2, 23,5% больных курили (рис. 2).
Больные всех трех групп каждое утро получали две таблетки: 1-я группа — лизиноприл и плацебо, 2-я группа — амлодипин и плацебо, 3-я группа — лизиноприл и амлодипин. АД измеряли в день включения (-14 день), в начале исследования (0 день), а также к концу 2-й и 8-й недели приема препаратов. Хорошо отвечающими на терапию считали тех пациентов, у которых АД нормализовалось (< 140/90 мм рт. ст.) или отмечалось снижение САД на 20 мм рт. ст., а ДАД на 10 мм рт. ст.
К концу 8 недели в группе амлодипина в среднем АД снизилось с 155,4 (± 10,2)/97,7 (± 4,9) до 140,8 (± 13,7)/86,3 (± 7,1) мм рт. ст; в группе лизиноприла — с 156,4 (± 10,4)/97,3 (± 5,7) до 139,8 (± 12,9)/87,2 (± 7,7) мм рт. ст.; в группе комбинированной терапии — с 156,4 (± 9,6)/97,5 (± 5,0) до 136,3 (± 11,9)/86,0 (± 6,6) мм рт. ст. (рис. 3–рис. 4).
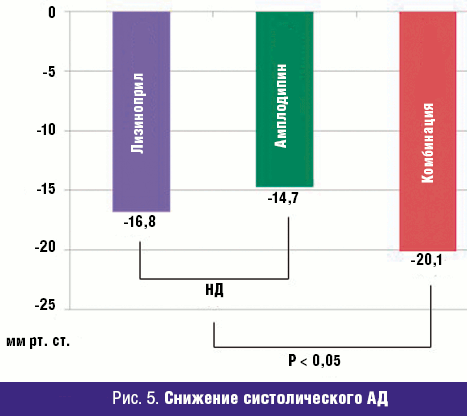
САД в группе комбинированной терапии снижалось более выражено (статистически достоверно) по сравнению с группой монотерапии амлодипином (-20,1 ± 13,6 и -14,7 ± 13,0 мм рт. ст. соответственно). Снижение САД в группе комбинированной терапии также превосходило изменения давления в группе лизиноприла (-16,8 ± 10,2), однако различия были статистически недостоверны. Различия между группой комбинированной терапии и обобщенной группой, получавшей любой вид монотерапии, достигли статистической значимости (р < 0,0236) (рис. 5).
Доля лиц, хорошо реагирующих на терапию, в период продолжительного действия препаратов была схожей в группах комбинированной терапии (68,9%), амлодипина (73,3%) и лизиноприла (69,3%). По сравнению с этим, в период максимального эффекта препаратов число лиц, хорошо реагирующих на терапию, было достоверно большим на фоне приема комбинации (90,1%), чем на фоне приема амлодипина (79,3%; р = 0,0333) или лизиноприла (75,8%; р = 0,0080), а также по сравнению с обобщенными данными больных, получавших любой вид монотерапии (р = 0,0098). Статистически достоверных различий между двумя группами больных, получавших монотерапию, выявлено не было.
В связи с нежелательными явлениями из исследования были исключены всего 3 пациента (один — в связи с головной болью, второй — в связи с повышением АД в период приема плацебо, третий — в связи с необходимостью внутрисердечного исследования и предстоящей операцией на сердце). В группе амлодипина 9 больных отметили нежелательные эффекты, вероятно связанные с терапией. 7 пациентов предъявляли жалобы, не связанные с терапией. В группе лизиноприла у 8 больных были жалобы, связанные с лечением, у 5 — не связанные с лечением. В группе комбинированной терапии у 7 пациентов отмечались явления, вероятно связанные с терапией, и у 7 — не были обусловлены приемом препарата. Однако во всех группах выраженность жалоб не препятствовала продолжению лечения.
Таким образом, все пациенты, принимавшие участие в исследовании, хорошо реагировали на прием препаратов, у большинства больных АД нормализовалось или существенно снизилось. Эффективность в группе комбинированной терапии во время ожидаемого максимального эффекта превосходила таковую в группах монотерапии. Комбинация амлодипина и лизиноприла оказалась более эффективна в снижении САД по сравнению с обоими режимами монотерапии. Это может иметь важное значение с учетом обсуждавшихся выше сложностей достижения целевых значений САД в старшей возрастной группе и у больных СД.
Таким образом, новая фиксированная комбинация амлодипина и лизиноприла Экватор® представляет собой эффективный антигипертензивной препарат с хорошим профилем переносимости. Органопротективные свойства входящих в него компонентов, их синергичное действие на процессы, протекающие в органах-мишенях, и значительный спектр дополнительных показаний для их использования позволяют рекомендовать данный препарат для широкого применения в практике лечения АГ.
По вопросам литературы обращайтесь в редакцию.
В. И. Подзолков, доктор медицинских наук, профессор
К. К. Осадчий, кандидат медицинских наук, доцент
ММА им. И. М. Сеченова, Москва
