Лечащий Врач #9, 2008
Разработка и внедрение в практику здравоохранения РФ новой отечественной расщепленной виросомальной вакцины против гриппа
Грипп представляет серьезную проблему для здравоохранения всех стран мира. Ежегодно эпидемии охватывают до 10% всего населения планеты, а во время гриппозных пандемий это число может возрастать в 4–6 раз. Поэтому решение вопроса профилактики гриппа рассматривается ВОЗ в качестве одной из первоочередных задач. На сегодняшний день наиболее действенным методом борьбы, сочетающим высокую специфичность, профилактическую эффективность и экономичность, является вакцинация. Короткий инкубационный период, острое начало заболевания, высокая контагиозность инфекции способствуют ее молниеносному распространению среди человеческой популяции, что резко снижает возможность применения других средств защиты, в том числе химиопрофилактики. Российские ученые разработали гриппозную вакцину нового вида «Грифор®».Разработанная технология приготовления вакцины «Грифор®» позволила обеспечить презентацию поверхностных антигенов вируса гриппа в виде виросом, а внутренних антигенов вируса гриппа— в виде мицелл с максимальным сохранением их антигенной структуры. Этого удалось достигнуть благодаря применению высокоэффективного современного детергента октилгликозида. В процессе расщепления вирионов детергентом стало возможным максимально перевести в растворимое состояние поверхностные антигены вируса гриппа (гемагглютинин и нейраминидазу), внутренние антигены (мембранный белок и рибонуклеокапсид), а также значительную часть липидов вирусной мембраны. Благодаря применению оригинальной технологии сборки вирусных антигенов в составе вакцины «Грифор®», липиды в сочетании с поверхностными антигенами образуют псевдовирусные структуры, известные в мировой литературе как виросомы.
Морфологический анализ проводили методом электронной микроскопии с использованием технологии негативного контрастирования.
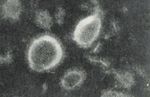 Проведенный анализ показал, что основными морфологическими структурами в составе вакцины «Грифор®» являются вирусспецифические виросомы размером от 90 нм до 180 нм (рисунок).
Проведенный анализ показал, что основными морфологическими структурами в составе вакцины «Грифор®» являются вирусспецифические виросомы размером от 90 нм до 180 нм (рисунок).
Вакцину «Грифор®» следует считать вакциной нового поколения по следующим причинам: 1)наличие виросом в составе вакцины «Грифор®» потенциально увеличивает ее иммуногенность при вакцинации людей, не имеющих «иммунной памяти» к антигенам вируса гриппа; 2)презентация поверхностных антигенов в виде виросом, а также наличие внутренних антигенов, выделенных с максимальным сохранением антигенной структуры, позволяет индуцировать развитие клеточного иммунитета у людей,вакцинированных препаратом «Грифор®».
В период 2005–2008 года были проведены доклинические и клинические исследования вакцины «Грифор®».
Доклиническое изучение реактогенности и безопасности проводили на белых мышах, морских свинках и кроликах.
Исследования на лабораторных животных доказали, что вакцина «Грифор®» нетоксична, безопасна, обладает выраженными иммуногенными свойствами, что позволило рекомендовать проведение I фазы клинических исследований препарата на ограниченном контингенте добровольцев. Клиническое исследование (I фаза) вакцины «Грифор®» проводили на основании решения Федерального комитета по этике и разрешения Росздравнадзора на базе ГУ НИИ вакцин и сывороток им. И. И. Мечникова РАМН (г. Москва) на здоровых добровольцах с целью изучения реактогенности, безопасности и иммуногенности препарата. В клиническом исследовании приняли участие 40 человек, в возрасте от 18 до 50 лет, полностью соответствующие критериям включения протокола клинических исследований. Методом случайной выборки все добровольцы были разделены на 2 группы. В 1 группе 20 человек были привиты вакциной «Грифор®», с содержанием гемагглютинина (ГА)— 45 мкг/доза— по 15 мкг ГА штаммов вирусов гриппа подтипов А (H1N1 и H3N2) и типа В. Во 2 группе (контрольной)— 20 человек, в качестве плацебо получили раствор натрия хлорида изотонического в объеме 0,5 мл.
Вакцину вводили однократно внутримышечно (в дельтовидную мышцу). Наблюдение за добровольцами проводили в течение 28 дней после вакцинации (первые 7 дней проводился осмотр добровольцев врачом-исследователем, с 8 по 28 дни добровольцы заполняли дневники самонаблюдения).
По результатам клинического исследования были сделаны следующие выводы:
-
Вакцинация препаратом «Грифор®» не сопровождалась развитием нежелательных явлений в поствакцинальном периоде, а возникшие слабовыраженные общие и местные реакции были кратковременны и не вызывали ухудшения состояния здоровья привитых, что свидетельствовало о безопасности препарата.
-
К 28 дню поствакцинального периода наблюдалось снижение среднего уровня общего IgE (рср0–28<0,001), что связано с входящими в состав вакцины «Грифор®» специфическими структурами виросомами, способными изменять соотношение Th1/Th2 в сторону Th1.
-
Иммунизация добровольцев вакциной «Грифор®» обеспечила следующие показатели иммуногенности к вирусу гриппа типов А (H1N1), A (H3N2) и В:
-
уровень сероконверсии 55%, 50% и 45%;
-
уровень серопротекции 95%, 90% и 100%;
-
кратность прироста антител 3,8; 3,5 и 2,7 соответственно;
-
у добровольцев с исходным титром антител ≤1:20 после вакцинации препаратом «Грифор®» наблюдался 4-кратный прирост антител в 100% случаях к вирусу гриппа типа А (H1N1) и В и в 70%— к вирусу гриппа типа А (H3N2). Клиническое исследование (II фаза) вакцины «Грифор®» проводилась на 2 базах: ГУ НИИ вакцин и сывороток им. И. И. Мечникова РАМН (г. Москва) и ГУ НИИ гриппа РАМН (г. Санкт-Петербург) в соответствии с решением Федерального комитета по этике и разрешением Росздравнадзора. Целью данного исследования являлось изучение реактогенности, безопасности и иммуногенности вакцины «Грифор®» при однократной иммунизации людей в возрасте от 18 до 60 лет.
В простом слепом сравнительном клиническом исследовании приняли участие 300 волонтеров, по 150 человек на каждой базе, полностью соответствующие критериям включения протокола. Методом случайного распределения все добровольцы были поделены на 3 группы.
В 1 группе 50 человек были привиты вакциной «Грифор®» с содержанием гемагглютинина— 45 мкг/доза— по 15 мкг гемагглютинина штаммов вирусов гриппа подтипов А (H1N1 и H3N2) и типа В. Во 2 группе 50 человек были привиты вакциной «Грифор®» с содержанием гемагглютинина— 35 мкг/доза— по 10 мкг гемагглютинина штаммов вируса гриппа типа А (H1N1) и A (H3N2) и 15 мкг НА типа В.
В 3 группе 50 человек были привиты препаратом сравнения— вакциной «Ваксигрип» с содержанием гемагглютинина— 45 мкг/доза— по 15 мкг гемагглютинина штаммов вирусов гриппа подтипов А (H1N1 и H3N2) и типа В.
Полученные при исследовании данные позволили сделать следующие выводы:
-
вакцинация добровольцев препаратами «Грифор®» в дозах 35 и 45 мкг и «Ваксигрип» в дозе 45 мкг не сопровождалась развитием тяжелых местных и общих реакций в поствакцинальном периоде, а возникшие слабовыраженные реакции были кратковременны и не вызывали ухудшения состояния здоровья привитых, что свидетельствовало о безопасности препарата;
-
однократная внутримышечная иммунизация добровольцев вакцинами «Грифор®» и «Ваксигрип» позволила обеспечить следующие показатели иммуногенности к вирусу гриппа типов А (H1N1), A (H3N2) и В:
-
✦Грифор® в дозе 35 мкг:
-
уровень сероконверсии 89,8%, 83,9% и 77,5%;
-
уровень серопротекции 91,1%, 86% и 70,4%;
-
кратность прироста антител 16,7; 8,5 и 8 соответственно.
-
✦Грифор® в дозе 45 мкг:
-
уровень сероконверсии 93,3%, 88,4% и 77,4%;
-
уровень серопротекции 90,6%, 93% и 75,2%;
-
кратность прироста антител 17,4; 10 и 6,8 соответственно.
-
✦Ваксигрип в дозе 45 мкг:
-
уровень сероконверсии 94,8%, 92,2% и 82,3%;
-
уровень серопротекции 96,1%, 94,4% и 84,4%;
-
кратность прироста антител 24,8; 11 и 11,5 соответственно.
В соответствии с требованиями ВОЗ была проведена оценка длительности сохранения поствакцинального иммунитета через 6 месяцев у вакцинированных добровольцев (табл. 1).
В результате изучения длительности сохранения поствакцинального иммунитета (на 180 дней от начала иммунизации) было показано, что уровень сохранения величины титров антител у добровольцев, привитых вакциной «Грифор®», был выше по сравнению с таковым у привитых вакциной «Ваксигрип». По-видимому, это обусловлено тем, что вакцина «Грифор®», в отличие от вакцины «Ваксигрип», содержит в своем составе виросомы. При сравнительном изучении гриппозных вакцин рядом авторов было отмечено, что виросомальные вакцины индуцируют более высокую иммуногенность и более длительное сохранение протективных антител, по сравнению с традиционными субъединичными и расщепленными вакцинами, по-видимому в результате адъювантных свойств .
Результаты сравнительного клинического исследования II фазы показали, что иммуногенности вакцин «Грифор®» в дозировках 35 мкг и 45 мкг, а также вакцины «Ваксигрип» практически одинаковы и соответствуют всем трем критериям CPМP EMEA. Дополнительно был проведен анализ достоверности различий по уровням сероконверсии и уровням серопротекциии по всем трем серотипам вируса гриппа между исследуемыми препаратами. Из полученных результатов следует, что по уровню сероконверсий вакцина «Ваксигрип» достоверно отличается от вакцины «Грифор®» в дозе 35 мкг и «Грифор®» в дозе 45 мкг только по серотипу В. Вакцина «Грифор®» в дозе 35 мкг по уровню сероконверсии достоверно не отличается от вакцины «Грифор®» в дозе 45 мкг (р<0,05). По уровню серопротекции все три препарата («Грифор®» в дозе 35 мкг, «Грифор®» в дозе 45 мкг и «Ваксигрип») достоверно не отличаются (р<0,05). В соответствии с утвержденным протоколом клинического исследования на аккредитованных исследовательских базах: ГУ научно-исследовательский институт гриппа РАМН (ГУ НИИ гриппа РАМН, г. Санкт-Петербург), Пермская государственная медицинская академия им. академика Е. А. Вагнера (ПМА им. академика Е. А. Вагнера, г. Пермь) и Сибирский государственный медицинский университет Росздрава (СибГМУ, г. Томск) было проведено клиническое исследование по изучению профилактической эффективности вакцины «Грифор®» в эпидсезон 2007–2008 гг.
В многоцентровом, контролируемом, проспективном, рандомизированном исследовании приняли участие 5 611 добровольцев (мужчины и женщины) в возрасте от 18 лет и старше, рандомизированные в две группы в соотношении 1,2:0,8. Основная группа— 3107 добровольцев (из Санкт-Петербурга— 1018; из Томска— 1585; из Перми— 504) привиты вакциной «Грифор®». В организованных коллективах была сформирована группа наблюдения, численностью 2504 человека (из Санкт-Петербурга— 1000; из Томска— 1000; из Перми— 504), у которых при подтверждении диагноза «грипп» сопоставлялась заболеваемость с основной группой.
Профилактическую эффективность вакцины оценивали по двум показателям:
-
индекс эффективности (ИК) К = b/a, где К— индекс эффективности, а— заболеваемость на 1000 среди вакцинированных, b— заболеваемость на 1000 среди невакцинированных;
-
коэффициент эффективности (КЭ) E = 100×(b – a)/b, где Е— коэффициент эффективности (в %), а— заболеваемость среди вакцинированных, b— заболеваемость среди невакцинированных.
В случае заболевания и лабораторного подтверждения диагноза «грипп» у добровольцев основной группы и группы наблюдения была сопоставлена заболеваемость, оценены клиническое течение и тяжесть заболевания, возникновение осложнений.
На протяжении исследования осуществляли дифференциальную диагностику гриппа с другими вирусными и бактериальными инфекциями. Грипп диагностировали на основании клинических данных, а именно выявления основных симптомов: высокая температура, достигающая 39–40°С, длительностью около 3–4 дней; озноб; насморк; першение и боль в горле; сухой, лающий кашель, который сохранялся в течение 2 недель; общая выраженная слабость, недомогание, разбитость; боль и «ломота» в мышцах и суставах; одышка; боль при движении глаз, конъюнктивит.
Кроме того, для подтверждения клинического диагноза «грипп» среди вакцинированных и невакцинированных участников исследования проведены серологические исследования парных сывороток в первые дни заболевания и через 14–21 день, а также оценены клиническое течение и тяжесть заболевания.
Общая продолжительность наблюдения для каждого участника клинического исследования составила не менее 6 месяцев.
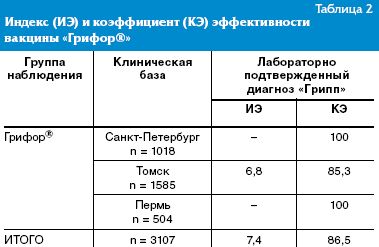
Проведенный анализ заболеваемости гриппом и ОРВИ в эпидемический сезон 2007–2008 гг. у привитых добровольцев и наблюдательной группы (невакцинированные) в Санкт-Петербурге, Томске и Перми позволил рассчитать профилактическую эффективность новой отечественной инактивированной расщепленной гриппозной вакцины «Грифор®». Коэффициент эффективности вакцины «Грифор®» в отношении лабораторно подтвержденного гриппа составляет 86,5%, а индекс эффективности 7,4 (табл. 2).
Высокие показатели профилактической эффективности вакцины «Грифор®» по сравнению с зарубежными расщепленными и субъединичными вакцинами могут быть обусловлены отсутствием в их составе виросом. Согласно результатам морфологического анализа доказано, что вакцина «Грифор®» является виросомальной. По данным литературы презентация поверхностных антигенов вируса гриппа (гемагглютинина и нейраминидазы) в составе виросом существенно изменяет иммуногенность этих антигенов для вакцинированных людей. Показано, что виросомальная вакцина «Инфлексал В» обладала более высокой иммуногенностью по сравнению с традиционными расщепленными вакцинами второго поколения, в частности, по сравнению с расщепленной вакциной «Флюарикс». Антигены вируса гриппа в составе виросом способны индуцировать не только гуморальный, но и клеточный иммунитет, тем самым обеспечивая перекрестную защиту от дрейфующих эпидемических штаммов вирусов гриппа. Таким образом, более высокая иммуногенность и способность индуцировать клеточный иммунитет позволяют считать виросомальные гриппозные вакцины наиболее оптимальными для профилактической вакцинации против вируса гриппа.
Важным фактором усиления иммуногенных свойств вакцины «Грифор®» является наличие в ее составе помимо поверхностных антигенов, представленных в виде виросом, также внутренних антигенов вируса гриппа (белка нуклеокапсида и мембранного белка), выделенных с помощью оригинальной технологии, позволяющей максимально сохранить их биологическую и иммунохимическую нативность. Из литературы известно, что добавление в состав вакцины «Ваксигрип» мембранного белка вируса гриппа, выделенного с максимальным сохранением нативности, существенно усилило протективную способность вакцины в опытах на лабораторных животных. Согласно результатам II фазы клинического изучения было показано, что показатели длительности сохранения поствакцинального иммунитета у добровольцев, привитых вакциной «Грифор®» были существенно выше, по сравнению с аналогичным показателем у привитых вакциной «Ваксигрип», что, возможно, обусловлено наличием виросом в составе вакцины «Грифор®» и их адъювантными свойствами. Это подтверждается данными литературы относительно зарубежных виросомальных вакцин. В результате проведенных доклинических и клинических исследований показано, что вакцина «Грифор®» является ареактогенной, безопасной и высокоиммуногенной, а также обладает высокой профилактической эффективностью, что позволяет считать ее первой российской виросомальной вакциной нового поколения, которая соответствует по всем показателям зарубежных виросомальных вакцин. В 2008 г. вакцина «Грифор®» была зарегистрирована в Российской Федерации (РУ № ЛСР-001419/08 от 11.03.2008 г.) и разрешена к медицинскому применению.
По вопросам литературы обращайтесь в редакцию.
В. В. Зверев*, доктор медицинских наук, профессор, академик РАМН Н. А. Михайлова*, доктор медицинских наук, профессор С. А. Коровкин, доктор медицинских наук, профессор А. Н. Миронов, кандидат медицинских наук С. Я. Мельников, кандидат биологических наук М. К. Ерофеева**, доктор медицинских наук Н. В. Дылдина И. Ю. Никоноров** В. Л. Максакова**, кандидат медицинских наук *ГУ НИИ вакцин и сывороток им. И. И. Мечникова РАМН, **ГУ НИИ гриппа РАМН, Москва ООО «ФОРТ», Рязань
