Лечащий Врач #10, 2008
Оптимизация терапии вагинальных дисбиозов
Изучение микроэкологии влагалища (вагинального биотопа), начатое более 100 лет тому назад А. Дедерлейном, показало, что настоящая экосистема сложная, многокомпонентная, гормонально зависимая и легкоранимая. Состояние ее динамического равновесия определяется, во-первых, уровнем гликогена в клетках эпителия влагалища, который в свою очередь связан с функциональным состоянием яичников, затем концентрацией лактофлоры, рН влагалищного содержимого и состоянием местного иммунитета.
Наличие индигенной флоры является одним из основных механизмов защиты половых путей от патогенных бактерий. Выраженный антагонистический эффект в отношении широкого круга патогенов проявляют лактобациллы, которые помимо образования молочной кислоты продуцируют перекись водорода, и бактериоцины, угнетающие развитие посторонних микробов. Кроме того, лактобактерии и неспорообразующие анаэробы проявляют высокую конкурентоспособность в заселении экологической нищи. Имеет большое значение и фактор адгезии индигенной флоры между собой и к поверхности эпителиоцитов. Специфическое прикрепление обеспечивается как за счет выростов в виде пилей и фимбрий, так и особыми химическими агентами— лектинами-гликопротеинами. В результате таких взаимодействий формируется гликокаликс, защищающий микробный пул от воздействия неблагоприятных факторов— антител, лизоцима, бактериофагов. Все вышеперечисленное входит в понятие «колонизационная резистентность», означающее совокупность механизмов, придающих стабильность влагалищного биотопа и предотвращающих заселение данной ниши.
В последнее десятилетие все больше внимания уделяется проблеме микозов, актуальность ее обусловлена продолжающимся ростом заболеваемости различными видами грибковой инфекции во всем мире, в частности, хроническими кандидозами кожи и слизистых, висцеральными микозами с поражением желудочно-кишечного тракта, респираторной системы и репродуктивных органов.
В акушерской и гинекологической практике прослеживается явная тенденция увеличения числа заболеваемости инфекционными процессами нижнего отдела гениталий, в частности бактериальным вагинозом и кандидозной инфекцией. Последние два заболевания зачастую объединяют в понятие «дисбиоз влагалища», который можно определить как полимикробный инфекционный синдром, представляющий собой патологию экосистемы влагалища, вызванную дисбалансом, проявляющимся уменьшением количества ферментирующих лактобацилл с одновременным увеличением количества условно-патогенных микроорганизмов.
В нашей стране вагинальный дисбиоз прочно занимает одно из ведущих мест в структуре причин обращений пациенток на амбулаторно-поликлинический этап оказания медицинской помощи населению. Внедрение современных технологий в клиническую микробиологию позволило существенно расширить представления специалистов и наглядно продемонстрировать, что отрицательное воздействие эндогенных и экзогенных факторов на микрофлору биотопов макроорганизма различной локализации, в том числе влагалища, ведет к развитию разнообразных патологических процессов как воспалительного, так и невоспалительного генеза. Несмотря на значительные успехи, достигнутые в диагностике, терапии и профилактике дисбиозов влагалища, их частота продолжает оставаться высокой (Стрижаков А. Н. с соавт., 2003; Радзинский В. Е. с соавт., 2006; Кира Е. Ф. с соавт., 2007; Макаров О. В. с соавт., 2007; Culligan P. J. et al., 2005; Klebanoff M. A. et al., 1991, 2005).
Одной из важных причин этого является рост числа иммунодефицитных состояний, наблюдаемый на фоне ухудшения экологической обстановки, нерационального питания, стрессов, «бума самодиагностики и самолечения» с бесконтрольным применением лекарственных средств, в первую очередь антибиотиков. Чаще всего генитальная инфекция обусловлена несколькими патогенными факторами: вирусами, бактериями, грибами, простейшими, которые вызывают схожие по клиническому течению, но различные по патогенезу и методам лечения заболевания.
Многие авторы (Буданов П. В. с соавт., 2005; Бондаренко К. Р. с соавт., 2007; Мальцева Л. И. с соавт., 2007; Eschenbach D. A., 2004), изучавшие различные механизмы вагинального кандидоза, подчеркивают, что грибы рода Candida нередко участвуют в различных микробных ассоциациях и могут являться маркерами воспалительных заболеваний мочеполовых органов.
Подробная микробиологическая характеристика кандидозной инфекции влагалища представлена в исследовании А. С. Анкирской и соавт. (1998). Авторами выделены три микробиологических варианта вагинального биоценоза при обнаружении дрожжеподобных грибов Candida: у 68% пациенток установлена кандидозная моноинфекция; у 18,3%— грибы рода Candida вегетировали в составе полимикробных ассоциаций, характерных для бактериального вагиноза; у 13,7%— при культуральном исследовании получен рост дрожжеподобных грибов в титре менее 103 КОЕ/мл (при микроскопическом исследовании клинического материала влагалища грибов не выявлено, лейкоцитарная реакция отсутствует), что позволило авторам расценить данный вариант как «нормоценоз» влагалища.
Анализ видового и количественного состава микрофлоры влагалища пациенток с урогенитальным кандидозом позволил выделить В. И. Кисиной с соавт. (1999) следующие типы вагинального микроценоза у обследованных женщин:
I тип. Выделение дрожжеподобных грибов рода Candida с сохранением лактофлоры у 12,1% пациенток в концентрации 104–105 КОЕ/мл, у 18,97%— в концентрации 106–107 КОЕ/мл.
IIа тип. Выделение дрожжеподобных грибов рода Candida в количестве 105–107 КОЕ/мл на фоне полимикробной микрофлоры с наличием Gardnerella vaginalis и/или Mobiluncus, «ключевых» клеток, снижения/отсутствия лактобацилл у 12,1% пациенток.
IIб тип. Картина микроценоза, аналогичная таковой при типе IIа, в ассоциации с Mycoplasma hominis и/или Ureaplasma urealyticum в количестве < 104 КОЕ/мл, со снижением/отсутствием лактофлоры у 13,8% пациенток.
III тип. Выделение дрожжеподобных грибов рода Candida в количестве 104–106 КОЕ/мл в ассоциации с Chlamydia trachomatis, с сохранением лактофлоры у 22,4% пациенток.
IVa тип. Выделение дрожжеподобных грибов рода Candida в количестве 105–107 КОЕ/мл в ассоциации с С. trachomatis, M.hominis и/или U.urealyticum, с сохранением лактофлоры у 8,6% пациенток.
IVб тип. Выделение дрожжеподобных грибов рода Candida в количестве 105–107 КОЕ/мл в ассоциации с М.hominis и/или U.urealyticum, с сохранением лактофлоры у 24,1% пациенток.
Кроме этого, у 87,9% пациенток обнаружен один или несколько факультативно-анаэробных микроорганизмов (стафилококки, коринебактерии, кишечная палочка, энтерококки) в концентрации от 103 до 106 КОЕ/мл.
При анализе результатов изучения кишечного микроценоза установлено умеренное уменьшение численности популяции бифидобактерий, лактобактерий в сочетании с резким снижением содержания полноценных Escherichia coli у 56,9% пациенток. Наряду с изменениями количественного состава нормальной микрофлоры зарегистрированы и ее качественные сдвиги: значительное увеличение количества лактозонегативных энтеробактерий у 53,4% пациенток, Escherichia coli со сниженными ферментативными свойствами у 20,7%, кокковых форм в количестве 106–108 КОЕ/мл (Staphilococcus aureus, S.saprophiticus, S.epidermidis) у 77,6% пациенток. Повышенная пролиферация дрожжеподобных грибов рода Candida в количестве 105–108 КОЕ/мл обнаружена в кишечнике у 46,6% обследованных.
Следует отметить, что манифестация кандидозной инфекции на фоне уже имеющегося инфекционного процесса влагалища усугубляет течение последнего и затрудняет лечение. Таким образом, формируется своеобразный порочный круг: кольпиты любой этиологии способствуют активации вульвовагинального кандидоза, который, в свою очередь, осложняет течение и усложняет лечение кольпита, обусловленного бактериально-вирусной инфекцией (Краснопольский В. И. с соавт., 2005; Мальцева Л. И. с соавт., 2004, 2007).
Все чаще приходится сталкиваться с необоснованными подходами к диагностике и лечению вульвовагинального кандидоза, что объясняется, с одной стороны, недостаточно полной осведомленностью врачей в вопросах современных особенностей этиологии и патогенеза настоящего заболевания, с другой стороны, излишне агрессивным лоббированием интересов производителей как оригинальных, так и генерических антимикотиков. Одним из вопросов, важных для гинекологов, сталкивающихся с проблемой кандидозной инфекции, является причина ее резистентности к традиционным методам терапии.
Традиционными подходами к лечению вагинальных дисбиозов следует признать различные методы, основанные на стадийности проводимого лечения и базирующиеся на понятиях коррекции, элиминации и восстановления влагалищного биотопа (Кира Е. Ф., 2001, 2007; Кондулукова И. А. с соавт., 1999; Линева О. И. с соавт., 2005; Мельников В. А., 2007; Шляпников М. Е., 2005, 2008). Применяемые для коррекции многокомпонентные препараты для локального (интравагинального) введения всегда оставались популярны как среди практикующих врачей, так и среди пациенток, благодаря высокой комплаентности, относительно невысокой стоимости курса лечения в сочетании с достаточной клинической и микробиологической эффективностью.
Одним из таких препаратов, появившихся в последнее время на российском рынке, является «Метрогил Плюс» в виде вагинального геля, содержащий наряду с традиционно используемым для лечения бактериального вагиноза метронидазолом, антимикотический компонент— клотримазол, что дает полное основание для использовании препарата в первую очередь для коррекции бактериального вагиноза, сочетанного с микотической инфекцией. Обоснованным следует считать введение в состав препарата именно клотримазола, поскольку, согласно исследованием последних лет (Кудрина М. И. с соавт., 2005; Пестрикова Т. Ю с соавт., 2005), параллельно с ростом резистентности грибов к флуконазолам происходит процесс восстановления чувствительности к таким ранее традиционно используемым на протяжении десятилетий препаратам, как нистатин и клотримазол (Жестков А. В. с соавт., 2007; Шляпников М. Е. с соавт., 2008). Дополнительным преимуществом препарата, выгодно отличающим его от большинства вагинальных форм, следует отметить гелевую основу, способствующую максимально равномерному распределению активных компонентов препарата на слизистой оболочке влагалища и экзоцервикса.
Нами проведено проспективное исследование эффективности использования препарата у 30 женщин репродуктивного возраста с верифицированным состоянием дисбиоза влагалища.
При анализе жалоб, с которыми обратились пациентки, выявлено, что большинство пациенток беспокоит наличие выделений из половых путей (60%), выделения с неприятным запахом (20%), наличие зуда, жжения в области вульвы и промежности (20%). У 4 пациенток (13,3%) выделения усиливались и начинали беспокоить только после полового акта или перед менструацией. У 2 пациенток (6,7%) выделения усиливались на фоне запоров кишечника (табл. 1).У 5 (16,6%) пациенток жалобы отсутствовали. Диагноз был поставлен при профилактическом обращении после гинекологического осмотра и микроскопии влагалищных выделений.
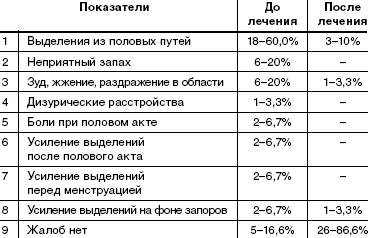
После пятидневного курса лечения препаратом «Метрогил Плюс» в виде вагинального геля субъективные жалобы отсутствовали у 86,6% женщин. У 10% сохранялись жалобы на выделения из половых путей: 1 случай (3,3%)— только выделения, 1 случай (3,3%) выделения в сочетании с усиливающимся зудом, 1 случай (3,3%) жалобы на усиление выделений на фоне запора.
Характер выделений описан в табл. 2. До лечения у пациенток при гинекологическом осмотре выделения носили следующий характер: в основном обильные (56,6%), жидкие (33,3%) или пенистые (20%), серо-белые (40%) или молочные (43,3%), с неприятным запахом(60%). У 3 женщин из 30 (10%) при гинекологическом осмотре выделения соответствовали норме.
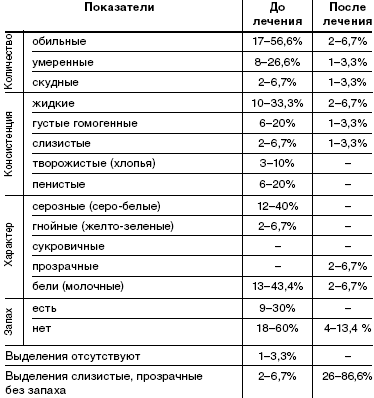
При осмотре после лечения препаратом «Метрогил плюс» в виде вагинального геля у 26 (86,6%) пациенток выделения имели критерии нормы: умеренные, слизистые, прозрачные, без запаха. У 4 пациенток (13,4%) выделения имели патологический характер: обильные 6,7%, жидкие 6,7%. Серозных, гнойных, пенистых, с неприятным запахом выделений после лечения не наблюдалось.
Из табл. 3 видно, что у большинства пациенток слизистая влагалища при вагинальном дисбиозе не изменена (63,3%). Но у 26,6% пациенток отмечалась гиперемия слизистой влагалища, у 6,7%— отечность, в 1 случае (3,3%)— мацерация слизистой влагалища.

После лечения в 96,7% видимой патологии слизистой влагалища не отмечается. В 1 случае (3,3%) сохранялась умеренная гиперемия.Эффективность действия препарата по этому признаку составляет 91%.
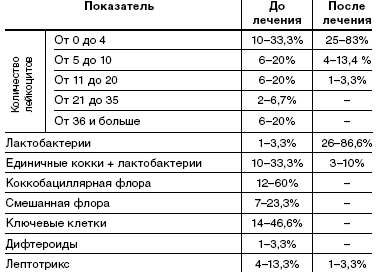
При анализе микроскопии влагалищного содержимого у пациенток исследуемой группы до лечения в 20% в мазке большое количество лейкоцитов, в 60% коккобациллярная флора, в 46,6%— в мазке «ключевые клетки», в 23,3% смешанная флора. Влагалищная флора, состоящая только из лактобактерий, в одном случае— 3,3%.
После лечения у 86,6% пациенток влагалищная флора состояла только из лактобактерий, лактобактерии с единичными кокками у 10% пациенток, наличие лептотрикса отмечалось в 3,3% случаев. В 83,3% мазков лейкоциты были единичные, большого количества лейкоцитов не отмечалось (табл. 4).
Степень чистоты влагалища до лечения в 96,7% случаев была IV; II степени чистоты влагалища до лечения в исследуемой группе пациентов не было. После курса лечения препаратом «Метрогил Плюс» в виде вагинального геля в 76,6% случаев стала II степень чистоты.
Данные, приведенные в табл. 5, наглядно демонстрируют достаточно высокий комплаенс использования препарата «Метрогил Плюс» в виде вагинального геля.

Таким образом, на основании проведенного исследования можно сделать вывод о высокой клинической и лабораторной эффективности использования препарата «Метрогил Плюс» в виде вагинального геля при коррекции дисбиотических состояний влагалищного биотопа. Наличие в составе препарата двух высокоэффективных компонентов— метронидазола и клотримазола, гелевой основы, обусловливающей равномерное распределение активных компонентов на слизистой оболочке, в сочетании с высоким комплаенсом, предопределяют максимально широкое применение Метрогила Плюс в качестве препарата «первой линии» у женщин с вагинальными дисбиозами.
По вопросам литературы обращайтесь в редакцию.
Н. В.Спиридонова, доктор медицинских наук, доцент М. Е.Шляпников, кандидат медицинских наук, доцент Е. А.Махлина *СГМУ, *клиника «Панацея», Самара
