Лечащий Врач #3, 2009
Как и когда начинать комбинированную терапию сахарного диабета 2-го типа (консенсус ADA и EASD, 2008)
Сахарный диабет (СД) — одно из самых распространенных заболеваний в мире. По данным эпидемиологических исследований заболеваемость СД удваивается каждые 15 лет. Прогнозируется неуклонный рост популяции больных, и к 2025 году по прогнозу Международной диабетической федерации (IDF) их число их вырастет до 400 млн, 93–95% которых составят пациенты с СД 2-го типа.
Такая же тенденция характерна и для Российской Федерации, где в настоящее время насчитывается более 8 млн человек, страдающих СД, и с каждым годом их число прогрессивно возрастает.
Значимость заболевания в современном обществе и медицине определяется его распространенностью, тяжестью течения и исходов, а также экономическим бременем для государства и общества в целом.
В связи с ранней инвалидизацией и высокой смертностью от сосудистых осложнений СД относится к числу заболеваний, которые наносят наибольший экономический ущерб. Ежегодные затраты на лечение больных с СД в мире к 2025 году возрастут со 153 млрд до 213–394 млрд долларов. Дополнительное бремя пандемии составят еще 314 млн человек с нарушенной толерантностью к глюкозе.
Современный подход к лечению СД 2-го типа направлен не только на ликвидацию проявлений декомпенсации углеводного обмена, но и на предупреждение развития поздних осложнений заболевания. Европейской ассоциацией по изучению диабета (EASD) в 1999 г. были предложены показатели целевых значений гликемии, сформулировано и внедрено в практику понятие интенсивной терапии СД. Это подразумевает не только ликвидацию субъективных симптомов заболевания, но и достижение целевых значений гликемии, т. е. уровня гликогемоглобина HbA1c < 6,5%, гликемии натощак менее 5,5–6,0 ммоль/л и постпрандиальной гликемии 7,5–9,0 ммоль/л.
Таким образом, достижение компенсации заболевания на протяжении максимально длительного периода времени является одной из основных задач лечения СД 2-го типа.
СД 2-го типа, как следствие периферической инсулинорезистентности, является составной частью метаболического синдрома, в состав которого входят висцеральное ожирение, дислипидемия, гиперкоагуляция и артериальная гипертензия. Полученные результаты многочисленных исследований, проводившихся в рамках доказательной медицины, подтвердили, что только «многофакторный» подход к лечению СД 2-го типа, включающий достижение целевого уровня артериального давления и ликвидацию дислипидемии, достоверно снижает риск прогрессирования сердечно-сосудистых заболеваний и общей смертности.
Необходимость изменения «традиционного» подхода к лечению заболевания на более агрессивный или, как сейчас принято называть, «интенсивный» была подтверждена не только большей эффективностью клинических исходов, но, в конечном итоге, на сегодняшний день является единственным способом значительно сократить экономические потери на лечение осложнений СД.
Одной из особенностей СД 2-го типа является длительное и практически бессимптомное течение. Отсутствие клинических симптомов при умеренной гипергликемии создает иллюзию благополучия, становится причиной низкой обращаемости пациентов в медицинские учреждения. Все это приводит к тому, что на момент выявления СД 2-го типа (обычно случайного) у больных уже имеются осложнения самого диабета в виде нарушения зрения, почек, атеросклеротические поражения сосудов сердца, мозга и нижних конечностей.
В 2006 году Американской диабетической ассоциацией (ADA) совместно с Европейской ассоциацией по изучению диабета (EASD) был разработан консенсус по медикаментозному лечению больных СД 2-го типа. Данный алгоритм был создан на основании всестороннего анализа результатов клинических исследований с высоким уровнем доказательности, а также с учетом коллективных знаний и клинического опыта членов экспертного совета о клинической эффективности, рисках и экономических затратах на лечение СД [5].
Появление новых классов пероральных сахароснижающих препаратов (ПССП) в дополнение к известным лечебным мероприятиям с доказанной эффективностью (изменение образа жизни, использование метформина, производных сульфонилмочевины и инсулина) значительно расширило терапевтические возможности и определило возникновение проблемы выбора наиболее рациональной терапевтической тактики [6].
В январе 2009 года опубликован обзор, в котором, с учетом накопленной за последние два года информации о безопасности и эффективности лекарственных препаратов, ведущие специалисты в области диабетологии проанализировали и дополнили современные подходы к лекарственной терапии СД 2-го типа в рамках существующего консенсуса от 2006 г. [7].
Авторы подчеркивают, что, несмотря на появление новых классов сахароснижающих препаратов и увеличение числа возможных вариантов комбинированной терапии СД 2-го типа, современное лечение заболевания, принявшего характер эпидемии, не позволяет достичь и сохранить целевые показатели гликемии у большого числа больных.
Учитывая высокую социальную и экономическую значимость проблемы лечения СД, в большинстве стран мира разработаны национальные программы для борьбы с этим заболеванием. 7 октября 1996 года в соответствии с Указом Президента Российской Федерации «О мерах государственной поддержки лиц, больных сахарным диабетом» была принята Федеральная целевая программа «Сахарный диабет» [8]. Основными задачами программы являются проведение организационных, диагностических, лечебных и профилактических мероприятий, направленных на снижение распространенности CД, уменьшение инвалидизации и летальности от этого заболевания. Несмотря на существование подобной программы, следует отметить, что качество и объем медицинской помощи пациентам в нашей стране не полностью соответствуют общепринятым мировым стандартам, что убедительно демонстрируют данные эпидемиологических исследований. Согласно последним данным эпидемиологических исследований в Российской Федерации лишь 25% пациентов с СД 2-го типа достигают целевых значений гликированного гемоглобина (< 6,5–7%) [9].
Каковы основные причины того, что 3/4 больных по-прежнему находятся в декомпенсации СД? С одной стороны, пациенты не всегда выполняют рекомендации врача относительно изменения образа жизни, а также недостаточно регулярно проводят самоконтроль. С другой стороны, как отмечают многие эксперты, практические врачи не всегда активно следуют алгоритмам ведения больных СД 2-го типа.
Современный комплексный подход к лечению СД 2-го типа включает:
1) изменение образа жизни, включающее изменение питания и увеличение физической активности;
2) раннее и своевременное назначение пероральных сахароснижающих препаратов и инсулинотерапии;
3) обучение пациентов, включающее возможность проведения самоконтроля уровня гликемии;
4) проведение ранней профилактики и лечения поздних осложнений.
Возвращаясь к консенсусу ADA и EASD ведения пациентов с СД 2-го типа (2006), необходимо отметить, что его несомненно отличительной чертой по сравнению со всеми предшествующими рекомендациями стало изменение первого этапа лечения СД 2-го типа. До 2006 г. изменение образа жизни обычно рекомендовалось пациентам в дебюте заболевания в качестве монотерапии. В консенсусе определено, что наряду с изменением образа жизни пациентам необходимо назначить медикаментозную терапию.
В чем причина изменения принципиального подхода к лечению в дебюте заболевания? С одной стороны, избыточное гиперкалорийное питание и малоподвижный образ жизни являются основными предрасполагающими факторами развития заболевания, а их коррекция оказывает достоверный положительный эффект не только на уровень гликемии, но и влияет на такие факторы риска сердечно-сосудистых осложнений СД 2-го типа, как ожирение, артериальная гипертензия и атерогенный липидный профиль [10]. Однако на практике оказалось, что снижение веса у большинства пациентов в дебюте заболевания является временным явлением. Исключение составляют пациенты, у которых проводится хирургическая коррекция ожирения, позволяющая достигнуть после операции снижения веса в среднем на 20 и более килограмм [11]. Рекомендации по увеличению физической активности также могут иметь определенные ограничения, связанные с пожилым возрастом пациентов, тяжестью сопутствующих осложнений СД, например, наличием у пациентов тяжелой нейропатии или синдрома диабетической стопы.
Тем не менее, нельзя забывать, что гипокалорийное питание и повышение физической активности остается чрезвычайно важной составляющей комплексного подхода к лечению СД. Для достижения более стойкого результата изменения образа жизни желательно проведение обучения пациентов в «Школе для больных СД 2-го типа». Цель обучения больных диабетом — не просто передача суммы знаний, а формирование мотивации и новых психологических установок с тем, чтобы пациенты смогли взять на себя часть ответственности за лечение своего заболевания, изменить поведение в отношении диабета.
В ходе обучения все пациенты с СД 2-го типа должны быть информированы о том, что данное заболевание характеризуется непрерывно прогрессирующим течением. Его развитие претерпевает ряд последовательных этапов — от инсулинорезистентности и гиперинсулинемии на ранней стадии заболевания к постепенному снижению секреторной функции бета-клеток вплоть до полного ее истощения, что приводит к абсолютному дефициту инсулина на фоне сохраняющейся инсулинорезистентности. В связи с этим если на первых этапах лечения часто бывает достаточно назначения монотерапии, то развитие заболевания потребует обязательного проведения комплексной терапии ПССП с последующим переходом на инсулинотерапию.
Пациентам также необходимо объяснять, что достижение устойчивой компенсации СД 2-го типа невозможно без проведения регулярного самоконтроля гликемии, подтвержденного результатами исследования уровня гликированного гемоглобина.
На сегодняшний день хорошо изучены механизмы действия, эффективность, безопасность и переносимость так называемых «старых» ПССП — производных сульфонилмочевины и метформина. В то же время целый ряд новых классов сахароснижающих препаратов, к которым относятся тиазолидиндионы, агонисты глюкагоноподобного пептида и ингибиторы дипептидилпептидазы IV (ДПП-IV) не могут похвастаться солидной доказательной базой, прежде всего в плане их безопасности. При анализе консенсуса 2006 г. эксперты решили определить 2 варианта (ряда) лечения — варианта «подтвержденной безопасной терапии» и варианта «менее хорошо подтвержденной терапии» (рис. 1) [7].
Также в представленный алгоритм по лечению СД 2-го типа, разработанный экспертами ADA и EASD в 2006 г. и дополненный в 2008 г., не вошли ингибиторы альфа-глюкозидаз, глиниды, ингибиторы ДПП-IV. Авторы объясняют это либо относительно низким сахароснижающим эффектом по сравнению с препаратами первого и второго ряда (например, снижение HbA1c при использовании ингибиторов альфа-глюкозидаз в качестве монотерапии составляет всего 0,5–0,8%), либо недостатком данных по их безопасности.
К первому ряду препаратов, имеющих достаточный период клинического использования с доказанной безопасностью, относятся метформин, производные сульфонилмочевины и инсулин. Все эти препараты имеют длительный период использования в клинической практике, мощную доказательную базу их безопасности и клинической эффективности, а также значительные преимущества по сравнению с более новыми классами ПССП с позиции анализа затраты/эффективность.
Первым шагом лечения СД 2-го типа в дебюте заболевания является назначение медикаментозной терапии в комплексе с рекомендациями по изменению образа жизни. Согласно алгоритму, пероральную терапию следует начинать с назначения метформина (Глюкофаж) (при условии отсутствия нарушения функции почек или риска возникновения такого нарушения). Одновременно необходимо проводить мониторинг почечной функции и риска ее значительного ухудшения (до скорости клубочковой фильтрации ниже 60 мл/мин/1,73 м2) у получающих метформин пациентов.
Почему именно метформин был выбран препаратом № 1 на первом этапе лечения СД 2-го типа?
В основе формирования приоритетов в выборе ПССП лежат принципы, базирующиеся на клинической эффективности сахароснижающего действия; наличии дополнительных неантигипергликемических (непрямых) эффектов, которые могут снизить риск поздних осложнений, безопасности, переносимости; простоте использования; стоимости лекарственного средства.
Метформин — единственный из группы бигуанидов, разрешенных к использованию во всем мире, является высокоэффективным ПССП. В среднем монотерапия метформином позволяет снизить уровень на 1,5% по сравнению с исходным уровнем. А выполнение пациентами рекомендаций по изменению образа жизни при приеме эффективных доз метформина позволяет достичь снижения уровня HbA1c до 2% [12].
За последние 50 лет механизм действия препарата был достаточно подробно изучен, а за годы клинической практики получены неоспоримые доказательства положительного влияния метформина на профилактику сердечно-сосудистых осложнений.
Действие метформина на углеводный обмен представлено несколькими механизмами, напрямую не влияющими на выброс инсулина бета-клетками. Метформин подавляет продукцию глюкозы печенью (преимущественно за счет подавления глюконеогенеза и, в меньшей степени, гликогенолиза). Поскольку печеночный синтез глюкозы у больных с СД 2-го типа усилен примерно в 2–3 раза по сравнению со здоровыми людьми, метформин является единственным ПССП, способствующим нормализации уровня гликемии натощак [13].
Во-вторых, метформин до 50% повышает чувствительность к инсулину периферических тканей (инсулин-стимулированный захват глюкозы скелетными мышцами и адипоцитами) [14]. В инсулин-чувствительных тканях препарат улучшает транспорт глюкозы путем повышения активности тирозинкиназы в инсулиновых рецепторах, а также улучшает транспорт глюкозы белками-переносчиками — GLUT-1 в плазматической мембране и GLUT-4 во внутриклеточных мембранах. Пострецепторное действие метформина проявляется в стимуляции неокислительного пути обмена глюкозы (синтез гликогена, превращение глюкозы в лактат и триглицериды). Таким образом, метформин оказывает метаболический эффект на инсулин-чувствительные ткани, что приводит к снижению уровня гликемии.
Метформин обладает слабым анорексигенным эффектом, обусловленным прямым контактом препарата со слизистой желудочно-кишечного тракта. Снижение аппетита приводит к уменьшению поступления глюкозы с пищей, постепенному снижению веса и в конечном итоге — уменьшению инсулинорезистентности. Также метформин замедляет скорость всасывания углеводов в кишечнике, что приводит к снижению постпрандиальной гликемии. Считается, что это связано с уменьшением моторики тонкой кишки и скорости опорожнения желудка.
Революционным клиническим исследованием по изучению сравнительной эффективности различных вариантов сахароснижающей терапии стало многоцентровое проспективное исследование United Kingdom Prospective Diabetes Study (UKPDS), в котором было показано, что основными факторами развития поздних осложнений и высокой смертности при СД 2-го типа являются хроническая гипергликемия и артериальная гипертензия. Более строгий контроль уровня гликемии приводил к существенному снижению риска микрососудистых осложнений. В то же время производные сульфонилмочевины и инсулин, оказывая сравнимый с метформином сахароснижающий эффект, в значительно меньшей степени влияли на частоту развития макрососудистых осложнений [15]. В отличие от производных сульфонилмочевины и инсулина, метформин оказывал более существенный профилактический эффект на снижение частоты инфаркта миокарда на 39%, общей смертности на 36% и смертности от СД на 42%.
Дополнительным непрямым эффектом метформина является снижение окисления свободных жирных кислот (на 10–30%) (устранение липотоксичности), что не только улучшает чувствительность к инсулину, но и может опосредованно улучшать секрецию инсулина бета-клетками, через снижение глюкозотоксичности [16].
Еще одним важным действием метформина является его положительное влияние на систему гемостаза. Препарат ускоряет тромболизис, снижает концентрацию фибриногена и повышает фибринолитическую активность, увеличивает концентрацию тканевого активатора плазминогена и подавляет активность ингибитора активатора плазминогена.
Таким образом, метформин оказывает комплексное патогенетическое терапевтическое действие при СД 2-го типа, путем подавления продукции глюкозы печенью и повышения чувствительности периферических тканей и печени к инсулину. Дополнительно метформин снижает скорость всасывания глюкозы в кишечнике, подавляет аппетит, препятствует набору веса тела и способствует его снижению, снижает глюкозотоксичность и уровень свободных жирных кислот, положительно влияет на гемостаз, окислительный стресс и реологические свойства крови. Комплексное влияние препарата на процессы атерогенеза объясняет существенный кардиопротективный эффект, сравнимый с использованием статинов для профилактики сердечно-сосудистых осложнений. Все вышеперечисленные доказанные клинические эффекты позволили метформину занять лидирующее место в современных рекомендациях по лечению и профилактике СД 2-го типа.
Еще одной важной особенностью этого препарата является отсутствие риска возникновения гипогликемических состояний, так как метформин не оказывает прямого стимулирующего действия на бета-клетки поджелудочной железы. Раньше считалось, что назначать метформин следует только пациентам с ожирением или избыточной массой тела, но в 2007 году на конгрессе EASD были представлены доказательства, что эффективность действия препарата не зависит от величины индекса массы тела (ИМТ).
Согласно алгоритму титрации, лечение следует начинать с низких доз (500 мг в день) однократно или в два приема в день, во время еды (в завтрак и/или в ужин) с постепенным еженедельным увеличением дозы на 500–850 мг. Эффективная средняя терапевтическая доза обычно составляет 2000–2500 мг в день, увеличение дозы более 3000 мг не рекомендуется. Разовый прием практически не снизит гипергликемию, так как антигипергликемический эффект препарата реализуется постепенно (через 3–4 недели от начала лечения) через сложные механизмы при условии постоянного приема [17].
Переносимость препарата достаточно хорошая, а из побочных эффектов наиболее часто наблюдаются желудочно-кишечные расстройства: метеоризм, тошнота, рвота, «металлический привкус во рту», снижение аппетита, диспепсия, боль в животе, диарея. Эти явления зависят от дозы препарата, чаще возникают при первом применении метформина, их интенсивность снижается при приеме препарата во время или после еды, а также рекомендуется постепенная титрация дозы.
Из других побочных эффектов следует назвать нарушение всасывания витамина В12 и повышение уровня гомоцистеина при длительном применении препарата. Возможно возникновение аллергической реакции (кожной сыпи) и индивидуальная непереносимость.
К сожалению, ни один из существующих на сегодняшний день ПССП, используемый в виде монотерапии даже в максимальной дозе, не способен длительно удерживать нормальный уровень HbA1с < 6,5–7%. Это связано с тем, что ни один из существующих препаратов не действует одновременно на все механизмы, лежащие в основе развития СД 2-го типа.
В основе патогенеза этого сложного заболевания лежат три эндокринных дефекта: инсулинорезистентность, нарушение секреции инсулина и избыточный синтез глюкозы в печени. И если на начальных этапах заболевания ведущую роль играет нарушенная чувствительность к инсулину, то прогрессирование заболевания приводит все к большему угнетению секреторного ответа.
Возникновение на определенном этапе развития заболевания недостаточной эффективности монотерапии (на практике — это повышение уровня HbA1с > 6,5–7%) требует перехода ко второму шагу лечения заболевания — проведению комбинированной терапии (рис. 1).
Как правило, переход от первого ко второму этапу лечения может различаться среди пациентов от 3 месяцев до нескольких лет (обычно до 5 лет) и зависит от множества факторов (длительности стадии предиабета, времени установления диагноза, индивидуальных особенностей патогенеза заболевания и др.).
Анализ всех классов ПССП показывает, что биологический эффект будет максимален при титрации до максимальных доз. Однако достижение максимальной дозы может приводить к увеличению частоты побочных эффектов (гипогликемия или желудочно-кишечные проблемы), не оказывая при этом существенного влияния на гипергликемию.
Говоря о последних достижениях в управлении СД 2-го типа, необходимо отметить кардинальное изменение стратегии лечения, заключающейся в значительном укорочении периода времени, требуемого для перехода от одной стадии лечения к другой. Большинству специалистов хорошо известен традиционный (пошаговый) подход к лечению, касающийся титрации дозы ПССП и добавления к терапии новых групп сахароснижающих препаратов. Сейчас этот подход образно называют «ориентированным на неудачу», так как переход к следующему этапу лечения происходил лишь после того, как невозможность достижения компенсации гликемии становилась очевидной [18] (рис. 2). Так, первой рекомендацией при впервые выявленном заболевании было изменение образа жизни, после чего многие пациенты просто пропадали из поля зрения врача на несколько месяцев или лет. При повторном обращении к специалисту пациенту назначалась терапия одним из ПССП, и только через определенное время проводилась постепенная титрация дозы до максимальной. Только через несколько лет от начала заболевания назначалась комбинированная терапия ПССП, и, порой, слишком поздно осуществлялся переход на инсулинотерапию (часто тогда, когда у пациента уже наблюдалось развитие и прогрессирование поздних осложнений заболевания) [19]. Основная проблема подобной «пошаговой» тактики состоит в том, что при переходе на очередной этап лечения неизбежно возникает потеря времени. А известно, что даже непродолжительные периоды гипергликемии у пациентов повышают риск микро- и макрососудистых осложнений.
Также было показано, что пациенту, длительное время находившемуся на монотерапии в максимальных дозах, добавление другого класса ПССП оказывалось практически неэффективным (это утверждение не относится к лечению инсулином). Поэтому был сделан вывод, что более раннее использование комбинации субмаксимальных доз различных групп ПССП может значительно улучшить гликемический контроль без увеличения частоты побочных эффектов.
Итак, комбинированная терапия показана:
- при недостижении целевых показателей (HbA1c > 6,5% и гликемия натощак > 5,6 ммоль/л) через 3 месяца от начала лечения;
- всем больным, которые на момент установления диагноза уже имеют какие-либо осложнения СД, так как время дорого и необходимо как можно быстрее добиться компенсации СД;
- при изначально высоких цифрах гликемии и HbA1c > 9%;
- в случае поздней диагностики заболевания, когда уже имеется нарушение секреторного ответа бета-клетки в ответ на поступление углеводной пищи (уровень постпрандиальной гликемии через два часа после приема пищи > 8 ммоль/л).
Таким образом, для достижения основных целей лечения заболевания необходимо изменить ранее установленный стереотип лечения больных с СД 2-го типа и перейти к более агрессивной тактике лечения: раннему началу комбинированной терапии ПССП, у некоторых пациентов — практически с момента постановки диагноза.
Подобный подход к лечению уже давно используется в кардиологии: с целью коррекции артериальной гипертензии принято использовать сразу несколько групп гипотензивных препаратов, для одновременного воздействия на различные звенья патогенетического процесса.
Наиболее оптимальная комбинированная терапия — сочетание метформина с производными сульфонилмочевины. Эти препараты в сравнении с метформином имеют сравнимую и даже несколько большую эффективность по влиянию на постпрандиальную гликемию и HbA1с (снижение на 1,5–2% от исходного уровня). В то же время у этой группы ПССП есть и ряд преимуществ. Их действие начинается быстрее, чем у метформина. Эти препараты идеально воздействуют на синхронизацию инсулинового ответа. А также, с экономической точки зрения, это наиболее дешевая группа препаратов. В то же время производные сульфонилмочевины могут способствовать набору веса и чаще вызывают гипогликемию.
Альтернативным вариантом лечения, согласно алгоритму, является комбинация метформина с базальным инсулином, однако данный вариант терапии может вызывать гипогликемические состояния и требует более тщательного проведения самоконтроля (рис. 1).
Простота, эффективность и относительная дешевизна объясняют тот факт, что секретогены удачно дополняют метформин. Именно это сочетание имеет максимальный эффект на уровень HbA1c (дополнительное снижение HbA1c на 1,7% по сравнению с монотерапией метформином или производными сульфонилмочевины). Рациональность подобной комбинации объясняется возможностью одновременного воздействия на основные патогенетические механизны развития СД. Комбинированный препарат Глюкованс, содержащий в одной таблетке метформин и микронизированную форму глибенкламида, является представителем новой формы лекарственных препаратов.
Первоначальными предпосылками для создания комбинированных таблетированных препаратов были экономические интересы. Действительно, стоимость лечения пациента при приеме препарата с фиксированной комбинацией оказывается меньше, чем при приеме аналогичных медикаментов в виде отдельных лекарственных форм.
Однако оказалось, что создание комбинированных препаратов, в частности Глюкованса, улучшает не только комплаентность пациентов (приверженность к рекомендуемой врачом терапии), но и снижает общее число и интенсивность побочных эффектов, при неизменной эффективности.
Каковы основные достоинства Глюкованса и есть ли преимущества по сравнению с другим известным препаратом с фиксированной комбинацией — Глибометом (в его состав входят 400 мг метформина и 2,5 мг глибенкламида)?
Во-первых, следует подчеркнуть уникальность технологии производства Глюкованса: метформин образует растворимый матрикс, в котором равномерно распределены частицы микронизированного глибенкламида. Это позволяет глибенкламиду действовать быстрее, чем при использовании немикронизированной формы глибенкламида в виде монотерапии, что в конечном итоге обеспечивает оптимальную синхронизацию инсулинового ответа на прием пищи. Быстрое достижение пика концентрации глибенкламида позволяет принимать Глюкованс во время еды. Эта особенность приема препарата с пищей позволяет снижать интенсивность гастроинтестинальных эффектов, возникающих у некоторых пациентов при использовании метформина, также входящего в состав комбинированного препарата. Таким образом, сбалансированная комбинация метформина (500 мг) и глибенкламида (2,5 или 5 мг) в одной таблетке способствует обеспечению идентичной биодоступности метформина в свободной комбинации, при более раннем начале действия глибенкламида, что позволяет добиваться большей эффективности с меньшей частотой гипогликемий.
Во-вторых, несомненным преимуществом Глюкованса является наличие двух дозировок, что позволяет наиболее адекватно подобрать эффективное лечение. В целом, побочные эффекты при приеме препаратов с фиксированной комбинацией наблюдаются несколько реже, чем при использовании соответствующих компонентов в качестве монотерапии (используемых обычно в больших дозировках) или при их раздельном назначении.
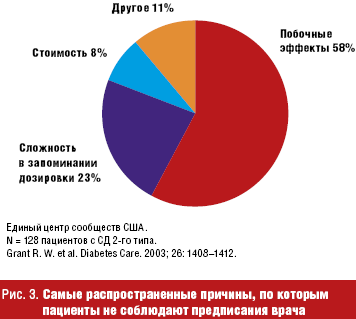
В-третьих, очень важным преимуществом всех комбинированных препаратов, включая Глюкованс, является более высокая комплаентность при приеме данного препарата. Помимо приема сахароснижающих препаратов, пациент с СД 2-го типа одновременно обычно получает гипотензивную и гиполипидемическую терапию. В исследованиях было показано, что назначение большого числа лекарственных препаратов снижает эффективность лечения из-за несоблюдения схемы лечения. При анализе наиболее распространенных причин, по которым пациенты не выполняют рекомендации врача, наиболее часто были названы: возникновение побочных эффектов (58%), на втором месте — сложность запоминания дозировок (23%) [20] (рис. 3). Перевод пациентов даже с монотерапии метформином или глибенкламидом на Глюкованс несколько повышает комплаентность, а снижение общего числа таблеток при переводе с комбинированной терапии двумя ПССП на препарат с фиксированной комбинацией улучшает качество лечения с 54% до 77%.
Более удобный режим приема Глюкованса позволяет проводить «тройную терапию». В 24-недельном рандомизированном исследовании изучалась сравнительная эффективность монотерапии Глюковансом 500 мг/2,5 мг по 2 таблетки 2 раза в день и терапии Глюковансом (в той же дозе) + росиглитазоном 8 мг в день. Средний уровень HbA1 снизился до 7,23% по сравнению с исходным 8% до лечения при проведении тройной терапии и не изменился при приеме Глюкованса в сочетании с плацебо. Необходимость подобной комбинации может возникнуть у пациентов с выраженной инсулинорезистентностью на фоне избыточного веса тела.
Доза препарата подбирается индивидуально для каждого пациента, в зависимости от уровня гликемии. Алгоритм титрации представлен ниже:
- В том случае, когда монотерапия метформином (Глюкофаж) в оптимальной дозе неэффективна (для большинства больных — обычно 2000–2500 мг/сут), назначают Глюкованс в дозе 1–2 таб/день во время еды (500/2,5 мг).
- Для достижения целевых показателей гликемии дозу препарата постепенно повышают каждые 2 недели (максимальная доза — 4 таблетки в дозировке 500/2,5 мг в день или 2 таблетки в дозировке 500/5 мг).
- В том случае, когда переводят с совместного примения метформина и глибенкламида на Глюкованс, начинают с дозы 1–2 таб/сут. При переходе с Глюкованса 500/2,5 мг на Глюкованс 500/5 мг, последний начинают применять с дозы, не превышающей ранее применявшейся дозы глибенкламида, а затем дозу постепенно повышают по мере необходимости.
Несомненно, инсулинорезистентность является одним из ведущих механизмов развития заболевания, и это справедливо на стадии профилактики СД и на самых ранних этапах заболевания. Месяцы от начала клинических проявлений заболевания и годы от момента его лабораторной диагностики приводят к все большему угнетению секреторного ответа со стороны бета-клеток. Переход к 3 этапу лечения больных СД 2-го типа — назначению либо базального инсулина, либо полного перевода на инсулинотерапию должен быть своевременным и обоснованным невозможностью достижения компенсации по достижению целевых показателей гликемии и уровня HbA1 (рис. 1).
Добавление базального инсулина (в средней дозе 0,2 ЕД на килограмм массы тела) к проводимой комбинированной терапии рекомендуют начать в виде однократной инъекции на ночь или в двух инъекциях (утром и на ночь), под ежедневным контролем гликемии натощак. Обычно доза повышается по 2 единицы каждые 3 дня до достижения целевых значений гликемии — 3,9–7,2 ммоль/л. В случае исходно более высокого уровня гликемии натощак возможно увеличение дозы на 4 ЕД каждые 3 дня. В случае возникновения гипогликемии натощак следует уменьшить вечернюю дозу инсулина на 2–4 ЕД. В случае повышенного уровня HbA1 > 7% пациент должен быть своевременно переведен на интенсифицированную терапию.
Литература
- UK Prospective Diabetes study Group. Effect of intensive blood glucose control with metformin on complications in overweight patients with T2 DM (UKPDS 34) // Lancet. 1998: 352: 854–865.
- Diabetes Control and Complications Trial Research Group: The effect of intensive diabetes treatment on the development and progression of long-term complications in insulin-dependent diabetes mellitus: the Diabetes Control and Complications Trial // N Engl J Med. 1993, 329: 978–986.
- The Action to Control Cardiovascular Risk in Diabetes Studt Group: Effectsof intensive glucose lovering in type 2 diabetes // N Engl J Med. 2008. 358: 2545–2559.
- The ADVANCE Collaborative Group: Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes // N Engl J Med. 2008, 2560–2572.
- Nathan D. M., Buse J. B., Davidson M. B., Heine R. J., Holman R. R., Sherwin R., Zinman B. Management of hyperglycemia in type 2 diabetes: A consensus algorithm for the initiation and adjustment of therapy // Diabetes Care. 2006; 29, 1963–1972.
- Nathan D. M. Finding new treatments for diabetes — how many, how fast… how good? // N Eng J Med. 2007. 356: 437–440.
- Medical Management of Hyperglycemia in Type 2 Diabetes: A consensus Algorithm for the Initiation and Adjustment of therapy // Diabetes Care. 2009; 32–1, 1–9.
- Дедов И. И., Шестакова М. В., Максимова М. А. Федеральная целевая программа «Сахарный диабет»: Методические рекомендации. М.: Медиа Сфера, 2002. 88 с.
- Сунцов Ю. И., Дедов И. И., Шестакова М. В. Скрининг осложнений сахарного диабета как метод оценки качества лечебной помощи больным. М.: Мин. здрав. и соц. развития РФ совместно с ФГУ ЭНЦ Росмедтехнологий, 2008. 63 с.
- Diabetes Prevention Program Research. Group: Impact of intensive lifestyle and metformin therapy on cardiovascular disease risk factors in the Diabetes Prevention Program // Diabetes Care. 2005; 28, 888–894.
- Dixon J. B., O’Brien P. E., Playfair J. et al. Adjustable gastric Banding and conventional therapy for type 2 diabetes: a randomized controlled trial // JAMA, 2008, 299: 316–323.
- DeFronzo R. A., Goodman A. M. Efficacy of metformin in patients with non-insulin-dependent diabetes mellitus. The Multicenter Metformin Study Group // N Engl J Med. 1995; 333: 541–549.
- Bailey C. J., Turner R. C. Metformin // N Engl J Med. 1996; 334: 574–579.
- Kirpichnikov D., Samy I., Sowers J. S. Metformin: an update. 2002: Annals of internal medicine. 137 (1): 25–33.
- UK Prospective Diabetes study Group. Effect of intensive blood glucose control with metformin on complications in overweight patients with T2 DM (UKPDS 34) // Lancet. 1998: 352: 854–865.
- Robinson A. C., Burke J., Robinson S., Johnston D. G., Elkeles R. S. The effects of metformin on glycemic control and serum lipids in insulin-treated NIDDM patients with suboptimal metabolic control // Diabetes Care. 1998;
21: 701–705. - Дедов И. И., Шестакова М. В. Сахарный диабет. Руководство для врачей. М. 2003: 163–167.
- S. Del Prato et. al. Improving glucose management // Int J Clin Practice. 2005; 59: 1345–1355.
- Campbell I. W. Need for intensive, early glycaemic control in patients with type 2 diabetes // Br J Cardiol. 2000; 7 (10): 625–631.
- Donahue S. R., Turner K. C., Patel S. Pharmacokinetics and pharmacodynamics of glyburide/metformin tablets (Glucovance) versus equivalent doses of glyburide and metformin in patients with type 2 diabetes // Clin. Pharmacokinet. 2002; 41 (15): 1301–1309.
М. Ф. Калашникова, кандидат медицинских наук, доцент
М. С. Новикова
ММА им. И. М. Сеченова, Москва
