Лечащий Врач #4, 2009
Роль хронического аллергического воспаления в патогенезе бронхиальной астмы и его рациональная фармакотерапия у пациентов с полипатией
 Бронхиальная астма известна с глубокой древности. Многие ученые и мыслители, в том числе и Гиппократ, утверждающий, что «осмотр тела — целое дело: он требует знания, слуха, обоняния, осязания, языка, рассуждения», задумывались над причинами возникновения, а также особенностями течения и возможностями терапии, если о таковой вообще можно было говорить тысячелетия назад. А размышлять на эту тему было действительно необходимо, т. к. уже тогда у огромного количества детей, подростков, взрослых и стариков периодически возникали приступы удушья и кашля с отделением скудной прозрачной мокроты.
Бронхиальная астма известна с глубокой древности. Многие ученые и мыслители, в том числе и Гиппократ, утверждающий, что «осмотр тела — целое дело: он требует знания, слуха, обоняния, осязания, языка, рассуждения», задумывались над причинами возникновения, а также особенностями течения и возможностями терапии, если о таковой вообще можно было говорить тысячелетия назад. А размышлять на эту тему было действительно необходимо, т. к. уже тогда у огромного количества детей, подростков, взрослых и стариков периодически возникали приступы удушья и кашля с отделением скудной прозрачной мокроты.
Именно Гиппократ ввел термин «астма», что в переводе с греческого означает «удушье». В его трудах в разделе «О внутренних страданиях» встречаются указания на то, что астма носит спастический характер, а одной из причин, вызывающих удушье, являются сырость и холод. Учение Гиппократа, стремившегося объяснить возникновение болезней, в том числе и бронхиальной астмы, определенными материальными факторами, было в дальнейшем продолжено в трудах многих врачей.
Так, в III веке до н. э. древний врачеватель Аретей сделал попытку разделить астму на две формы. Одна из них была близка к современному представлению о «рецидивирующей сердечной астме», возникающей у больного во время незначительной физической нагрузки. Другая форма одышки, по мнению Аретея, провоцировалась холодным и влажным воздухом, а проявлялась спастическим затруднением дыхания — именно она и была близка к представлению об истинной бронхиальной астме.
Уже тогда стало ясно, что изучаемый недуг довольно серьезен, а последующее наблюдение за больными позволило установить, что болезнь основательно изменяет качество их жизни далеко не в лучшую сторону и с трудом поддается лечению. К слову сказать, единственным методом терапии бронхиальной астмы в те времена являлись кровопускание и свежий воздух, а чтобы сделать несколько шагов к победе над этим недугом, должны были пройти века.
Однако причины возникновения болезни и ее обострения долгое время оставались неизвестными и неизученными.
Во II веке н. э. римский врач Гален пытался экспериментально обосновать причины возникновения затруднения дыхания, и хотя его эксперименты не увенчались успехом, сам факт исследования механизма нарушения дыхания при астме был явлением единичным и очень прогрессивным.
В эпоху Возрождения научные исследования в различных областях медицины стали весьма популярны. Итальянский врач Джероламо Кардано (1501–1576), диагностировав у английского епископа бронхиальную астму, предписал ему в качестве лечения диету, физические упражнения и замену пуховой перины, на которой спал епископ, подстилкой из обычной ткани. Больной выздоровел. Это была блестящая догадка врача того времени в области лечения бронхиальной астмы.
Подтверждая участие аллергенов в развитии бронхиальной астмы, бельгийский ученый ван Гельмонт (1577–1644) первым описал приступ удушья, возникающий в ответ на вдыхание домашней пыли и употребление в пищу рыбы. Он предположил, что местом, где развертывается болезненный процесс при астме, являются бронхи. Догадка, что астма возникает в результате сокращения мышц бронхов, почти столетием позже была высказана Джоном Хантером в 1750 году. Сегодня хорошо известно и широко доказано, что в патогенезе бронхообструкции играют роль гиперсекреция слизи, отек слизистой бронхов и бронхоспазм, а для уровня науки XVII века это были довольно смелые высказывания.
Таким образом, роль аллергии и хронического аллергического воспаления в патогенезе бронхиальной астмы была доказана уже несколько веков назад, а первыми целенаправленными шагами в ее лечении тогда стали элиминационные мероприятия и исключение аллергенов из продуктов питания.
Позднее, в 20-х годах прошлого столетия, ученые предложили одну из форм бронхиальной астмы называть атопической, тем самым подчеркивая ее основополагающий аллергический компонент.
Однако необходимо заметить, что не вся бронхиальная астма является зависимой от воздействия аллергенов. Так, в большинстве стран Европы и Америки еще с 1918 года бронхиальную астму разделяют на вызываемую внешними факторами (asthma extrinsic) и связанную с внутренними причинами (asthma intrinsic). По современным представлениям первая соответствует понятию неинфекционно-аллергической, или атопической, бронхиальной астмы, а вторая — инфекционно-зависимой, включающей случаи, связанные с острыми и хроническими инфекционными заболеваниями респираторного аппарата, эндокринными и психогенными факторами. Также в качестве отдельных вариантов выделяют так называемую аспириновую астму и астму физического усилия.
Но при таком разнообразии этиологических форм заболевания всех их объединяет одно — клиника, которую в 30-х годах XIX века блистательно описал выдающийся русский клиницист Г. И. Сокольский: «Человек, страдающий астмой, только что заснувший, просыпается с чувством стеснения в груди. Состояние сие не состоит в боли, но кажется, будто какая-то тяжесть положена ему на грудь, будто давят его и душат внешней силой… Человек вскакивает с постели, ищет свежего воздуха. На лице его побледневшем выражается тоска и опасение от задушения… Явления сии, то увеличиваясь, то уменьшаясь, продолжаются до 3 или 4 часов утра, после чего спазм утихает и больной может вздохнуть глубоко. С облегчением он откашливается и усталый засыпает…».
Возвращаясь к сегодняшней действительности, необходимо отметить, что в России бронхиальная астма диагностируется у 10% детей и у 5% взрослого населения, причем около 2/3 пациентов заболевают ей еще в детском возрасте [1]. Бронхиальная астма зарегистрирована у 1% взрослых жителей столицы, однако при более тщательных исследованиях этот показатель может возрасти до 8% [2].
Доля больных бронхиальной астмой составляет около 3% от всех вызовов бригад скорой медицинской помощи (СМП) в России, а примерно в 3/4 подобных случаев поводом для обращения за медицинской помощью служат жалобы на одышку или удушье. Только в Москве бронхиальная астма ежегодно является поводом для вызова СМП более чем к 60 тысячам пациентов, при этом 10–12% больных госпитализируются в стационары. Догоспитальная летальность больных с бронхообструкцией в Москве составляет 0,04% от общего количества вызовов [3].
Летальность от бронхиальной астмы также продолжает расти, а около 80% всех смертей связаны с факторами, которые потенциально можно было предотвратить [4].
Прежде всего, это:
-
неспособность врача правильно оценить состояние пациента и тяжесть развившегося обострения бронхиальной астмы;
-
неправильное поведение больного, заключающееся в неверной оценке своего состояния, и невыполнение рекомендаций врача;
-
неадекватное обучение больного (уровень доказательности А);
- недостаточное использование при лечении бронхиальной астмы ингаляционных глюкокортикостероидов (ГКС).
Острая бронхиальная обструкция в случае атопической бронхиальной астмы развивается при воздействии на бронхиальные стенки медиаторов аллергической реакции I типа (уровень доказательности А). Обсуждается возможная патогенетическая роль в реакции иммуноглобулинов G (субкласса lgG4).
Генез поздней реакции объясняют воспалением бронхиальной стенки с привлечением нейтрофилов и эозинофилов хемотаксическими факторами аллергической реакции I типа. Есть основания полагать, что именно поздняя реакция на аллерген значительно усиливает гиперреактивность бронхов на неспецифические раздражители. В ряде случаев именно она является основой развития астматического статуса [5].
Также выделяют ряд факторов риска развития бронхиальной астмы, подразделяемые на предрасполагающие и причинные, которые сенсибилизируют дыхательные пути и провоцируют начало заболевания, а также усугубляющие и триггерные, которые способствуют развитию очередного обострения болезни.
-
Важнейшим предрасполагающим фактором для развития бронхиальной астмы считают атопию — генетическую предрасположенность к аллергическим реакциям.
-
К причинным факторам относят ингаляционные (клещи домашней пыли, шерсть животных, пыльца растений), профессиональные (уровни доказательности В, С), лекарственные (Аспирин) и пищевые (консерванты, красители) аллергены.
-
В роли усугубляющих факторов могут выступать курение (уровни доказательности В, С), загрязнение воздуха, респираторная вирусная инфекция, паразитарные инфекции.
- Триггерами, или веществами, непосредственно вызывающими обострение, служат аллергены, респираторная вирусная инфекция, физическая нагрузка, резкие запахи, холодный воздух, изменение погоды, эмоциональные стрессы.
Как известно, диагноз бронхиальной астмы довольно часто ставится ошибочно больным с хроническим обструктивным бронхитом. Существует ряд признаков, позволяющих анамнестически, клинически и инструментально разграничить данные заболевания (табл. 1).
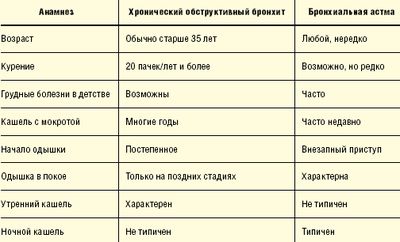
Необходимо запомнить, что при бронхиальной астме ограничение скорости воздушного потока часто обратимо полностью (как спонтанно, так и под влиянием лечения), в то время как при хронической обструктивной болезни легких (ХОБЛ) полной обратимости не бывает и болезнь прогрессирует, если не прекращено воздействие патогенных агентов.
Помощь в постановке диагноза оказывает выяснение семейного анамнеза и атопического фона. Диагноз бронхиальной астмы почти наверняка подтверждают повторные приступы ночного кашля у практически здоровых детей. У некоторых детей симптомы астмы провоцирует физическая нагрузка. Для постановки диагноза необходимы исследование функции внешнего дыхания (ФВД) с бронходилятатором, спирометрический тест с физической нагрузкой, а также аллергообследование с определением общего и специфического IgЕ, постановка кожных проб.
Одну из групп больных, где диагноз астмы врач или не ставит, или пропускает, составляют люди пожилого возраста. В пожилом возрасте затруднена не только диагностика астмы, но и оценка тяжести ее течения.
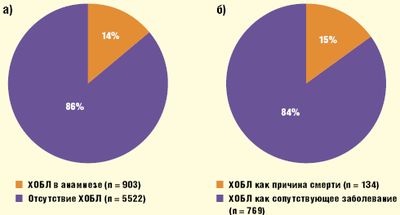
Мы проанализировали 6425 протоколов аутопсий пожилых больных (средний возраст — 68 ± 16 лет), умерших с 2002 по 2007 г. в одном из крупных многопрофильных стационаров Москвы, и обнаружили, что 903 из них (14%) страдали хронической бронхообструкцией. Причем причиной смерти 134 пациентов из этой группы (15%) стала именно она (Верткин А. Л., Скотников А. С., 2008) (рис. 1а, б).
Как упоминалось ранее, бронхиальную астму нередко неправильно диагностируют и, как следствие, назначают неадекватную терапию. Особенно трудно диагностировать астму у детей, пожилых людей, а также при воздействии профессиональных факторов риска, сезонной астме и при кашлевом варианте астмы. Чаще всего большие трудности представляет диагностика бронхиальной астмы у детей, так как эпизоды свистящих хрипов и кашель — наиболее частые симптомы при детских болезнях.
Патогномоничными признаками бронхиальной астмы, свидетельствующими в пользу наличия аллергического компонента в воспалении, являются эозинофилия крови (число эозинофилов 500–1000 мкл), причем характерно колебание числа эозинофилов — повышение ночью и в период контакта с аллергеном и уменьшение во время лечения ГКС. Присоединение же инфекции сопровождается снижением числа эозинофилов и увеличением числа нейтрофилов. СОЭ обычно в норме, а ее повышение свидетельствует о присоединении инфекции. Для диагностики бронхиальной астмы определение лейкоцитарной формулы не нужно, оно показано только при подозрении на вторичную инфекцию.
Немаловажен и общий анализ мокроты, который позволяет выявить некоторые элементы, специфичные для бронхиальной астмы, такие как:
-
спирали Куршмана — беловато-прозрачные штопорообразно извитые трубчатые образования, представляющие собой «слепки» бронхиол, обнаруживаемые, как правило, в момент спазма бронхов;
-
кристаллы Шарко–Лейдена — гладкие бесцветные кристаллы в форме октаэдров, которые состоят из белка, освобождающегося при распаде эозинофилов, представленных в большом количестве при аллергическом воспалении;
- большое количество эозинофилов (до 50–90% всех лейкоцитов).
Для успешного оказания помощи больным на догоспитальном этапе необходимо помнить, что пациенты с бронхиальной астмой, помимо бронхообструктивного синдрома, имеют огромный спектр сопутствующей патологии, состоящий из комбинации трех и более нозологий. Данная ситуация объединена в понятие «полипатия» (рис. 2а, б).
Так, у женщин ХОБЛ в сочетании с постинфарктным кардиосклерозом (ПИКС), желчекаменной болезнью (ЖКБ) и миомой матки встречается в 28% случаев, в комбинации с ПИКС и узловым зобом (УЗ) — в 16%, а в сочетании с ЖКБ и УЗ — в 11% случаев (рис. 2а).
Среди пациентов мужского пола ХОБЛ в сочетании с ПИКС и доброкачественной гиперплазией предстательной железы (ДГПЖ) встречается в 20% случаев, в комбинации с ПИКС и злокачественными новообразованиями различной локализации — в 12%, а в сочетании только с опухолями — в 8% случаев (Верткин А. Л., Скотников А. С.) (рис. 2б).
Поэтому одновременное назначение нескольких лекарственных препаратов с использованием теофиллинов, кромонов, антагонистов лейкотриеновых рецепторов и т. д. в данных случаях недопустимо. В сложившейся ситуации особую роль приобретают новые технологии неинвазивных, а именно аэрозольных, способов быстрой доставки селективных лекарственных средств в дыхательные пути, благодаря чему достигается высокая местная активность ингаляционных средств, позволяющая не только эффективно уменьшать проявления бронхоспазма, но и в значительной степени снижать частоту системных побочных эффектов.
Единственной группой лекарственных препаратов, уменьшающей аллергическое воспаление в бронхах, являются ГКС, в частности ингаляционные ГКС.
Чем же должен руководствоваться доктор, назначая лекарственную терапию? Чем определяются показания для госпитализации больных бронхиальной астмой? Ответом на эти вопросы может стать лишь алгоритм — некая последовательность действий медицинского работника с целью диагностики и купирования синдрома бронхообструкции, который должен включать в себя:
-
постановку диагноза;
-
определение степени тяжести обострения болезни;
-
выбор препарата, его дозы и формы введения;
-
оценку эффекта лечения;
- определение дальнейшей тактики ведения больного.
В руководстве по диагностике и лечению бронхиальной астмы основная роль в лечении отводится совместному применению ингаляционных ГКС и длиннодействующих бета2-агонистов. Ингаляционные кортикостероиды как средства базисной терапии бронхиальной астмы признаны во всем мире. Для хорошего контроля течения заболевания они требуют длительного применения. Их дозы определяются степенью тяжести астмы, полный клинический эффект применения стероидов проявляется после 2–3 недель планового применения [6].
Алгоритм неотложной фармакотерапии при обострении бронхиальной астмы представлен в табл. 2, а ежедневная базисная терапия заболевания — в табл. 3.
Согласно критериям эффективности лечения, ответ на терапию считается:
-
«хорошим», если состояние пациента стабильное, одышка и количество сухих хрипов в легких уменьшились, пиковая скорость выдоха (ПСВ) увеличилась на 60 л/мин (у детей — на 12–15% от исходного);
-
«неполным», если состояние пациента нестабильное, симптомы выражены в прежней степени, сохраняется плохая проводимость дыхания и нет прироста ПСВ;
- «плохим», если симптомы выражены в прежней степени или нарастают, а ПСВ ухудшается.
Немаловажен и способ доставки лекарственного препарата к рецепторам бронхов. В настоящее время все более широкое применение находит небулайзерная терапия. Слово «небулайзер» происходит от латинского слова «nebula», что означает «туман». Небулайзер — это устройство для преобразования жидкости в аэрозоль с особо мелкодисперсными частицами, способными проникать преимущественно в периферические бронхи. Цель небулайзерной терапии состоит в доставке терапевтической дозы препарата в аэрозольной форме непосредственно в бронхи больного и получении фармакодинамического ответа за короткий период времени (5–10 минут). Небулайзерная терапия, создавая высокие концентрации лекарственного вещества в легких, не требует координации ингаляции с актом вдоха, что имеет существенное преимущество перед дозированными аэрозольными ингаляторами.
Эффективность ингаляций зависит от дозы аэрозоля и определяется рядом факторов:
-
количеством продуцируемого аэрозоля;
-
характеристикой частиц;
-
соотношением вдоха и выдоха;
- анатомией и геометрией дыхательных путей.
Экспериментальные данные свидетельствуют о том, что оптимальными для попадания в дыхательные пути и, соответственно, рекомендуемыми к использованию являются аэрозоли с диаметром частиц 2–5 мкм. Более мелкие частицы (менее 0,8 мкм) попадают в альвеолы, где быстро всасываются или выдыхаются, не задерживаясь в дыхательных путях и не обеспечивая терапевтического эффекта. Таким образом достигается более высокий терапевтический индекс лекарственных веществ, определяющий эффективность и безопасность проводимого лечения.
Небулайзерная терапия обладает рядом преимуществ перед дозированными аэрозольными ингаляторами (уровень доказательности А):
-
отсутствие необходимости в координации дыхания с поступлением аэрозоля;
-
возможность использования высоких доз препарата и получение фармакодинамического ответа за короткий промежуток времени;
-
непрерывная подача лекарственного аэрозоля с мелкодисперсными частицами;
-
быстрое и значительное улучшение состояния вследствие эффективного поступления в бронхи лекарственного вещества;
- легкая техника ингаляций.
Препараты для небулайзерной терапии применяют в специальных контейнерах, небулах, а также растворах, выпускаемых в стеклянных флаконах. Это дает возможность легко, правильно и точно дозировать лекарственное средство.
Кроме того, говоря о хроническом аллергическом воспалении, нельзя не упомянуть о его профилактике. Абсолютное исключение или максимальное ограничение контакта с аллергенами на сегодняшний день в рамках современной экологии и особенностей условий труда людей зачастую невозможно. Поэтому глобальная инициатива по бронхиальной астме предлагает новую концепцию применения комбинированных препаратов (SMART — Symbicort Maintenance and Reliever Therapy), основанную на возможности использования комбинации адреномиметика и ГКС в одном ингаляторе как в качестве средства базисной терапии, так для купирования симптомов бронхиальной астмы в режиме «по требованию».
Общее число ингаляций препарата может быть достаточно большим, но не должно превышать восьми в сутки. Применение данной комбинации бронхолитиков по требованию, согласно концепции SMART, позволяет увеличить объем противовоспалительной терапии более чем в 4 раза в ответ на самые первые признаки обострения. По мнению экспертов GINA, SMART должен применяться в том случае, когда для достижения контроля над бронхообструкцией недостаточно применения лишь ингаляционных ГКС.
В настоящее время имеется богатая доказательная база [7–14] применения ингаляционных ГКС, которая широко освещена в современной литературе и поэтому не требует повторного детального разбора. С целью фармакотерапии бронхиальной астмы и профилактики очередного ее обострения именно ингаляционные ГКС, зарекомендовавшие себя как эффективные и безопасные лекарства, должны быть препаратами первой линии лечения, а небулайзерная терапия — предпочтительным способом доставки лекарственного вещества.
Литература
-
Авдеев С. Н., Чучалин А. Г. Роль бета2-агонистов при лечении больных с тяжелым обострением бронхиальной астмы // Терапевтический архив, 2000; 72 (12): 75–78.
-
Белевский А. С., Новиков Д. В., Хмелькова Н. Г. Стереотипы назначения противоастматического лечения // Клиническая медицина, 1998; 76 (7): 46–7.
-
Верткин А. Л., Зайратьянц О. В., Вовк Е. И. Окончательный диагноз. М.: Изд. ГЭОТАР, 2008.
-
Holgate S., Bisgaard H., Bjermer L. The Brussels Declaration: the need for change in asthma management // Eur. Respir. J., 2008, Dec.; 32 (6): 1433–1442.
-
Conolly K. C., Kemp J. P. Advances in the management of pediatric asthma: a review of recent FDA drug approvals and label updates // J. Asthma, 2005, Oct.; 42 (8): 615–22.
-
Global Initiative for Asthma Report 2006 and 2008 Update.
-
Ediger T. L., Danforth B. L., Toews M. L. Lysophosphatidic acid upregulates the epidermal growth factor receptor in human airway smooth muscle cells // Am. J. Physiol. Lung Cell Mol. Physiol., 2002, Jan.; 282 (1): L91–98.
-
Higenbottam T. W., Asif M., McCormack K. et al. Use of nitric oxide inhalation in COPD // Thorax., 2000, Nov.; 55 (11): 978.
-
Holgate S., Bisgaard H., Bjermer L. The Brussels Declaration: the need for change in asthma management // Eur. Respir. J., 2008, Dec.; 32 (6): 1433–1442.
-
Ilangovan P., Pedersen S., Godfrey S. et al. Treatment of severe steroid dependent preschool asthma with nebulised budesonide suspension // Arch. Dis. Child., 1993, Mar.; 68 (3): 356–359.
-
Jones P., Higenbottam T. Quantifying of severity of exacerbations in chronic obstructive pulmonary disease: adaptations to the definition to allow quantification //Proc.Am.Thorac.Soc.,2007,Dec.;4(8): 597–601.
-
Schmitt-Grohe S., Eickmeier O., Schubert R. et al. Anti-inflammatory effects of montelukast in mild cystic fibrosis // Ann. Allergy Asthma Immunol., 2002, Dec.; 89 (6): 599–605.
-
Scott, Skoner Short-term and long-term safety of budesonide inhalation suspension in infants and young children with persistent asthma // J. Allergy Clin. Immunol., 1999, Oct.; 104 (4 Pt. 2): 200–209.
-
Sharma S., Litonjua A. A., Tantisira K. G. et al. Childhood Asthma Management Program Research Group «Clinical predictors and outcomes of consistent bronchodilator response in the childhood asthma management program» // J. Allergy Clin. Immunol., 2008, Nov.; 122 (5): 921–928.e4. (Epub. 2008, Oct 10).
А. Л. Верткин, доктор медицинских наук, профессор А. С. Скотников МГМСУ, Москва
