Лечащий Врач #4, 2009
Применение симвастатина у больных подагрой и гиперхолестеринемией
Одним из основных показаний к проведению лекарственной терапии дислипидемий считается наличие гиперхолестеринемии, особенно в сочетании с некоторыми факторами риска развития атеросклероза и клинических его проявлений (ишемической болезни сердца (ИБС), сахарного диабета (СД), артериальной гипертензии (АГ), ожирения, отягощенного семейного анамнеза, почечной недостаточности) [1].
Все эти заболевания часто встречаются у больных подагрой, системного тофусного заболевания, характеризующегося отложением кристаллов моноурата натрия в различных тканях и развивающимся в связи с этим воспалением, у лиц с гиперурикемией (ГУ), обусловленной внешнесредовыми и/или генетическими факторами [2]. Более того, отличительной особенностью этих больных является наличие у большинства из них сразу нескольких факторов риска развития атеросклероза, включающих и нарушения липидного обмена [3, 4].
Исследования частоты обменных нарушений у более чем 200 больных подагрой мужчин, проведенные в НИИ ревматологии РАМН, показали, что при среднем возрасте больных около 50 лет у каждого шестого выявлялся СД, более чем у 80% — АГ, у 2/3 больных — метаболический синдром (МС) и инсулинорезистентность (ИР), у 55% — ожирение [3]. При этом средний сывороточный уровень холестерина (ХС) натощак у этих больных был существенно выше рекомендуемого АТР III (Adult Treatment Panel III) [1], не зависел от возраста и составлял в среднем 228 [158; 310] мг/дл [5]. Помимо высокого уровня ХС, отличительной чертой больных подагрой считается и высокий уровень триглицеридов (ТГ) [3, 4, 6]. В то же время адекватная липидснижающая терапия проводится лишь единичным больным подагрой. Например, анализ лекарственной терапии, проводимой больным подагрой, продемонстрировал, что даже при наличии высокого или очень высокого суммарного риска кардиоваскулярных заболеваний терапия статинами проводилась только в 53% случаях [7].
На первом этапе лечения дислипидемий рекомендуются немедикаментозные методы лечения, однако коррекция пищевого рациона не всегда приводит к снижению массы тела и нормализации уровня липидов, что обуславливает необходимость рассматривать вопрос о назначении лекарственной терапии. К показаниям, определяющим необходимость медикаментозного лечения дислипидемий у больных подагрой, можно отнести и молодой возраст большинства больных [5], что позволяет проводить терапию длительно, тем самым снижая риск развития инфарктов и смерти, связанных с атеросклерозом. К гиполипидемическим препаратам «первой линии» относятся статины — наиболее широко используемая группа препаратов. В основе гиполипидемического действия статинов лежит обратимая ингибиция активности 3-гидрокси-3-метилглютарил коэнзим А редуктазы (ГМГ-КоА-редуктазы), что приводит к нарушению биосинтеза ХС в печени, регуляции рецепторов ХС липопротеинов низкой плотности (ХС ЛПНП) и снижению сывороточного уровня ХС ЛПНП [8, 9]. Прием статинов приводит также к уменьшению уровней ТГ, аполипопротеинов B, C-II, C-III, E и незначительному увеличению уровня ХС липопротеинов высокой плотности (ХС ЛПВП) [10–12]. При этом симвастатин, обладающий высокой активностью, — один из наиболее хорошо изученных липидснижающих препаратов, назначение которого ассоциируется с достоверным уменьшением риска развития инфарктов миокарда и смерти, обусловленной осложнениями, связанными с атеросклерозом кардиоваскулярных заболеваний, в том числе при проведении вторичной профилактики [13].
Перспективы применения статинов в ревматологии не ограничиваются их липидснижающим действием [14, 15]. Так, помимо основного действия статинов, направленного на коррекцию дислипидемий, большое значение, особенно для больных ревматическими заболеваниями, могут иметь их плейотропные, в частности, противовоспалительные и иммуномодуляторные эффекты. Например, доказано, что применение статинов может приводить к улучшению показателей эндотелиальной функции (одного из наиболее ранних проявлений атеросклероза и выявляемой у большинства больных многими ревматологическими заболеваниями: подагрой, ревматоидным артритом (РА), системной красной волчанкой (СКВ)) [16–18], прежде всего, путем влияния на синтез провоспалительных цитокинов и молекул адгезии [19, 20].
Есть предположение, что терапия статинами может приводить к уменьшению ИР, состояния, во многом определяющего не только развитие и прогрессию обменных нарушений, приводящих к атеросклерозу, но влияющих на тяжесть течения подагры [3, 4], хотя эти данные противоречивы и требуют подтверждения [21].
Однако, несмотря на наличие прямых показаний к проведению липидснижающей терапии у большинства больных подагрой, назначение любого препарата таким больным следует проводить с особой осторожностью. Необходимо учитывать наличие у больных подагрой сразу нескольких коморбидных заболеваний, что предопределяет частый длительный параллельный прием ими препаратов различных групп и обуславливает необходимость тщательного мониторинга как эффективности, так и безопасности проводимой терапии.
С одной стороны, опыт применения статинов большой, однако использование их при ревматических заболеваниях, в том числе при подагре, не достаточно хорошо изучено и следует констатировать, что исследований, посвященных изучению различных клинических эффектов статинов у больных подагрой, не проводилось. Целью данного исследования было получение данных о влиянии симвастатина на показатели субклинического воспаления, обмена липидов, а также оценка безопасности его применения у больных подагрой.
Материал и методы
В проспективное открытое 4-месячное исследование были включены 35 больных подагрой и неконтролируемой диетой гиперхолестеринемией (28 мужчин и 4 женщины) в возрасте от 29 до 72 лет (в среднем 51,3 ± 10,7 года), обследованных в НИИ ревматологии РАМН с октября 2006 г. по октябрь 2007 г. Длительность заболевания в среднем составила 5 лет [3; 13]. У 5 больных (14%) определялись подкожные тофусы.
Все больные удовлетворяли классификационным критериям подагры Wallace S. [22]. В соответствии с рекомендациями по диагностике подагры экспертного комитета Европейской антиревматической лиги в каждом случае диагноз подагры был подтвержден обязательной верификацией кристаллов моноурата натрия в синовиальной жидкости или подкожных тофусах по данным поляризационной микроскопии [23]. Исходный уровень ХС у всех больных превышал 200 мг/дл. Течение подагры у всех больных было рецидивирующим, проведение лабораторных исследований производилось не ранее чем через 2 недели после купирования приступа артрита.
Пациенты с наличием противопоказаний к назначению симвастатина, таких как почечная и печеночная недостаточность, исходное повышение уровня трансаминаз, гиперчувствительность к любым ингибиторам ГМГ-КоА-редуктазы, а также принимающие более 2 условных единиц алкоголя (соответствует 100 г крепких спиртных напитков) в исследование не включались.
Лечение, проводимое до включения в исследование, было неизменным на протяжении не менее чем 2 месяцев. Доза аллопуринола, гипотензивных и сахароснижающих препаратов не изменялась в течение всего исследования. На момент включения в исследование аллопуринол принимали 17 больных (53%) в дозе 100–300 мг/сут. Ни один из больных нестероидные противовоспалительные препараты (НПВП) постоянно не принимал. У 6 больных, которым курсом назначались НПВП (нимесулид в суточной дозе 200 мг), продолжительность приема не превышала 5–7 дней.
Средняя масса тела больных на момент включения в исследование составила 88,5 ± 12,8 кг, индекс массы тела (ИМТ) — 28,9 ± 4,0 кг/м2, объем талии (ОТ) — 103,5 ± 10,0 см, ОТ/ОБ (объем бедер) — 1,00 ± 0,05. Симвастатин назначался в таблетках в дозе 10 мг однократно вечером, и через 2 недели, при хорошей переносимости, доза увеличивалась до 20 мг, также однократно вечером. После чего препарат применялся в указанной дозе до 12 недель, а затем отменялся на 4 недели. Обследование проводилось до, через 4 недели и 12 недель приема препарата и после его 4-недельной отмены.
Лабораторные исследования включали в себя определение сывороточного уровня мочевой кислоты (МК), глюкозы, липидного спектра (ХС, ХС ЛПВП, ТГ), трансаминаз (АлТ, АсТ), гамма-глутамилтранспептидазы (гамма-ГТП), креатинина и мочевины, креатинфосфокиназы (КФК) и проводились в утренние часы после 12-часового периода голодания с помощью методик, принятых в Учреждении НИИ ревматологии РАМН. ХС ЛПНП определяли по формуле Фридвальда (ХС ЛПНП = ХС — ХС ЛПВП — ТГ/5) [24]. Индекс атерогенности (ИА) рассчитывался по формуле: ИА = ХС ЛПНП/ХС ЛПВП. Уровень высокочувствительного С-реактивного белка (вч-СРБ) определялся высокочувствительным иммуноферментным методом. Оценка антропометрических параметров: рост, масса тела, ИМТ по формуле Кеттле, ОТ (см), ОБ (см), их соотношение (ОТ/ОБ).
Количественные данные представлены в виде средних значений плюс-минус стандартное отклонение (SD) в случае близкого к нормальному распределения признака. Остальные данные представлены в виде медианы и интерквартильного размаха (25-й и 75-й процентили). Статистическая обработка проводилась на компьютере с помощью пакета программ Statistica 6.0 (StatSoft, USA). Для определения различий в сравниваемых группах применяли критерии Вилкоксона. Исследование связей между некоторыми признаками проводилось с помощью корреляционного анализа Спирмена.
Результаты
Из 35 включенных в исследование больных один был исключен из исследования из-за неявки на динамическое обследование; один — из-за аллергической реакции в виде кожной сыпи, один — из-за кожного зуда, развившихся в первые 2 недели приема препарата. Одна пациентка вынуждена была прекратить прием симвастатина через 4 недели приема препарата из-за стойкой диспепсии (гастралгии, тошнота после приема препарата). Двум больным препарат был отменен спустя 4 недели его приема из-за более чем 3-кратного повышения уровня трансаминаз, ни один из них не принимал аллопуринола. Оставшиеся 29 больных не предъявляли каких-либо жалоб, связанных с приемом препарата.
Применение симвастатина в дозе 20 мг к концу 12 недель приема привело к значительному снижению уровней ХС (на 21,2%), ХС ЛПНП (на 28,3%) и ИА (на 28,9%). Снижение уровней указанных показателей происходило уже к 4-й неделе приема и существенно не менялось к 12-й неделе препарата. Прием симвастатина практически не влиял на уровень ХС ЛПВП, уровень ТГ снизился почти на 28%, но это снижение не было достоверным (табл. 1). Через 4 недели после отмены симвастатина все показатели липидного обмена вернулись к исходному уровню.
Целевой сывороточный уровень ХС (< 190 мг/дл) был достигнут у 10 больных (34%) через 12 недель приема симвастатина. Сывороточный уровень ХС ЛПНП < 115 мг/дл определялся у 7 больных (24%) через 12 недель приема препарата. После отмены симвастатина целевые показатели сывороточных уровней ХС и ХС ЛПНП не выявлялись ни у одного из обследованных больных.
Достоверное снижение среднего значения сывороточного уровня вч-СРБ (исходный уровень 2,55 [1,29; 4,31] мг/л) отмечалось уже через 4 недели приема симвастатина (1,66 [1,24; 3,65] мг/л), (p = 0,046) и сохранялось через 12 недель приема препарата (1,20 [0,80; 3,28] мг/л), (p = 0,044). После отмены препарата уровень вч-СРБ (1,74 [1,25; 2,76] мг/л) был ниже исходного, но это отличие не было достоверно (p = 0,18) (рис.).
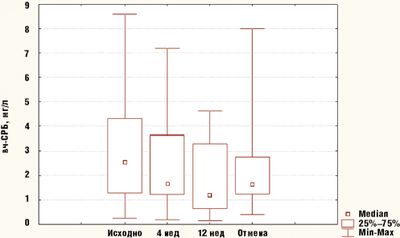
В среднем к концу 4-й недели приема симвастатина сывороточный уровень вч-СРБ снизился на 22%, а к концу 12-й недели приема препарата — на 26%. При этом снижение уровня вч-СРБ не коррелировало со снижением уровня ХС (p = 0,95). Клинически значимого изменения антропометрических показателей на протяжении исследования зафиксировано не было, они не коррелировали с сывороточными уровнями липидов.
Ни у одного пациента не было повышения сывороточного уровня КФК, который бы потребовал отмены симвастатина. Существенного снижения уровня клубочковой фильтрации и повышения сывороточного уровня креатинина и мочевины ни у одного пациента выявлено не было.
Сывороточный уровень МК на протяжении всего исследования оставался стабильным (табл. 2).
![]()
При сравнении сывороточных уровней трансаминаз, гамма-ГТП, КФК у больных, принимавших симвастатин, и больных, принимавших симвастатин параллельно с аллопуринолом, различий выявлено не было ни на одном из этапов исследования.
Обсуждение
Оптимизация терапии кардиоваскулярных заболеваний у ревматологических больных — одна из актуальнейших проблем современной ревматологии. Следует констатировать, однако, что не только не разработано схем и стандартов терапии и профилактики коморбидных заболеваний, связанных с атеросклерозом, в том числе нарушений обмена липидов ни для одного ревматического заболевания; но и исследования, посвященные анализу эффективности и безопасности такой терапии, весьма малочисленны.
Первым, вполне ожидаемым и прогнозируемым результатом работы было зарегистрированное нами снижение сывороточного уровня ХС и ХС ЛПНП, полностью сопоставимое с данными наиболее крупного проспективного исследования (4S) применения симвастатина у больных с высоким риском кардиоваскулярных осложнений. Следует подчеркнуть, что эти показатели при более чем 5-летнем приеме симвастатина в суточной дозе 20–40 мг коррелировали с 30% снижением общей смертности и снижением смертности, обусловленной кардиоваскулярными осложнениями на 42% [13]. И именно осложнения, связанные с атеросклерозом, представляют собой основную угрозу жизни у больных подагрой, являясь основной причиной их смерти [25, 26].
Наиболее же интересны результаты исследования противовоспалительных эффектов статинов. Эти уникальные свойства статинов могут иметь большое значение в терапии именно ревматических заболеваний, которые не только приводят к улучшению эндотелиальной функции и препятствуют развитию атеросклероза [27], но могут способствовать снижению воспалительной активности, например, при РА [28], приводить к значительному уменьшению формирования дигитальных язв у больных системной склеродермией [29].
Результаты нашего исследования продемонстрировали, что прием симвастатина приводил к существенному и стойкому снижению сывороточного уровня вч-СРБ, отражающего наличие хронического воспалительного процесса. Учитывая, что хроническое подострое воспаление характерно и для подагры и регистрируется даже в межприступный период заболевания, а уровень вч-СРБ при этом прямо коррелирует с некоторыми показателями, отражающими кардиоваскулярный риск, это может иметь большое клиническое значение для этих больных [30]. В то же время снижение уровня вч-СРБ не коррелировало со снижением уровней ХС и ХС ЛПНП, подтверждая данные о том, что противовоспалительный эффект статинов не связан с их липидснижающим действием [31]. Это особенно важно, учитывая, что лечение статинами ассоциируется со снижением риска сосудистых катастроф и летальных исходов у больных с исходной повышенной концентрацией СРБ [32]. Важно и то, что этот эффект был достигнут при применении препарата в относительно низкой дозе (20 мг/сут), в то время как при назначении невысоких доз ловастатина (20 мг/сут) больным РА снижение вч-СРБ было менее существенным [33].
Одной из основных проблем подбора адекватной терапии ревматических заболеваний является и проблема безопасности, особенно при применении сразу нескольких лекарственных средств. Так, адекватная липидснижающая терапии предполагают не только выбор тех препаратов, применение которых способно привести к достижению целевых уровней липидов, но и необходимость учитывать возможность негативного влияния на другие обменные процессы, особенно в условиях полиморбидности. Так, есть данные, что совместный прием статинов и колхицина, часто используемого для лечения и профилактики приступов подагрического артрита, может приводить к выраженной, вплоть до фатальной, миопатии [34–37]. Следует помнить, например, что применение никотиновой кислоты и ее производных противопоказано при подагре и СД. Несмотря на 20–40% снижение сывороточного уровня ТГ, показателя обмена липидов, повышенного у большинства больных подагрой и ассоциирующегося с риском развития подагры и напряженностью гиперурикемии [5, 38, 39], никотиновая кислота приводит к блокированию экскреции МК почками, а также способствует развитию гипергликемии [40]. И поэтому еще одним важным результатом нашего исследования было отсутствие влияния симвастатина на уровень МК, не было зарегистрировано случаев существенного повышения КФК и рабдомиолиза. Частота повышения печеночных ферментов была относительно низкой, однако у двух больных отмечалось клинически значимое повышение трансаминаз, что послужило причиной прекращения терапии симвастатином и подтверждает необходимость тщательного мониторинга. В то же время совместное применение симвастатина с аллопуринолом и в случаях проведения короткого курса терапии НПВП не сопровождалось ростом уровня печеночных ферментов.
Таким образом, результаты проведенного исследования продемонстрировали, помимо гиполипидемического действия и хорошей переносимости терапии симвастатином у больных подагрой, отсутствие влияния на уровень МК и выраженное противовоспалительное действие симвастатина.
Литература
-
Executive summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) // JAMA. 2001; 285 (19): 2486–2497.
-
Насонова В. А., Барскова В. Г. Ранние диагностика и лечение подагры — научно обоснованное требование улучшения трудового и жизненного прогноза больных // Научно-практическая ревматология. 2004; 1: 5–7.
-
Eliseev M. S., Barskova V. G., Nassonova V. A., Nassonov E. L. Insulin resistance syndrome in patients with gout and its influence on uric acid concentration and severity of arthritis. Abstracts. Ann. Rheum. Dis. 2006; 65 (Suppl II): 432.
-
Vazguez-Mellado J., Garsia C. G., Vazguez S. G. et al. Metabolic syndrome and ischemic heart disease in gout // J. Clin. Rheumatol. 2004; 10 (3): 105–109.
-
Насонова В. А., Елисеев М. С., Барскова В. Г. Влияние возраста на частоту и выраженность признаков метаболического синдрома у больных подагрой // Современная ревматология. 2007;1:31–36.
-
Takahashi S., Yamamoto T., Moriwaki Y. et al. Increased concentrations of serum Lp (a) lipoprotein patients with primary gout // Ann. Rheum. Dis. 1995; 54: 90–93.
-
Colvine K., Keer A. J., McLachlan A. et al. Cardiovascular disease risk factor assessment and management in gout: an analysis using guideline-based electronic clinical decision support // N. Z. Med. J. 2008; 121 (1285): 73–81.
-
Vaughan C. J., Gotto A. M., Basson C. T. The evolving role of statins in the management of atherosclerosis//J. Amer. Col. Cardiol. 2000; 35: 1–10.
-
Hamelin B. A., Turgeon J. Hydrophilicity/lipophilicity: relevance for the pharmacology and clinical effects of HMG-CoA reductase inhibitors // Trends Pharmacol. Sci. 1998; 19: 26–37.
-
Farnier M., Davignon J. Current and future treatment of hyperlipidemia: the role of statins // Am J Cardiol. 1998; 82: 3 J–10 J.
-
Sposito A. C., Santos R. D., Amancio R. F. et al. Atorvastatin enhances the plasma clearance of chylomicron-like emulsions in subjects with atherogenic dyslipidemia: relevance to the in vivo metabolism of triglyceride-rich lipoproteins // Atherosclerosis. 2003; 166 (2): 311–321.
-
Gaw A. HDL-C and triglyceride levels: relationship to coronary heart disease and treatment with statins // Cardiovasc. Drugs Ther. 2003; 17: 53–62.
-
Scandinavian Simvastatin Survival Study Group. Baseline serum cholesterol and treatment effect in the Scandinavian Simvastatin Survival Study (4S) // Lancet. 1995; 345: 1274–1275.
-
Насонов Е. Л. Перспективы применения статинов в ревматологии // РМЖ. 2003; 11 (23): 1273–1276.
-
Насонов Е. Л. Патогенетическое и клиническое обоснование применения статинов при системной красной волчанке и антифосфолипидном синдроме. 2004; 1: 82–88.
-
Барскова В. Г., Ильиных Е. В., Елисеев М. С., Зилов А. В., Насонов Е. Л. Кардиоваскулярный риск у больных подагрой // Ожирение и метаболизм. 2006; 3 (8): 40–44.
-
Vaudo G., Marchesi S., Gerli R. et al. Endothelial dysfunction in young patients with rheumatoid arthritis and low disease activity // Ann. Rheum. Dis. 2004; 63: 31–35.
-
Панафидина Т. А., Попкова Т. В., Алекберова З. С. и др. Значение факторов риска и С-реактивного белка в развитии атеросклероза у женщин с системной красной волчанкой // Клиническая медицина. 2006; 10: 49–54.
-
Musial J., Undas A., Gajewski P. et al. Anti-inflammatory effects of simvastatin in subjects with hypercholesterolemia // Int J Cardiol. 2001; 77: 247–253.
-
Mason J. C., Ahmed Z., Mankoff R. et al. Statin-induced expression of decay-accelerating factor protects vascular endothelium against complement-mediated injury // Circ. Res. 2002; 91: 696–703.
-
Szendroedi J., Anderwald C., Krssak M. et al. Effects of high-dose simvastatin therapy on glucose metabolism and ectopic lipid deposition in nonobese type 2 diabetic patients // Diabetes Care. 2009; 32: 209–214.
-
Wallace S. L., Robinson H., Masi A. T. et al. Preliminary criteria for the classification of the acute arthritis of gout // Arthritis Rheum. 1977; 20: 895–900.
-
Zhang W., Doherty M., Pascual-Gomez E. et al. EULAR evidence based recommendation for the diagnosis and management of gout // Ann Rheum Dis. 2005; 64 (Suppl. III): 501.
-
Friedewald W. T., Levy R. I., Fredrickson D. S. Estimation of the concentration of low density lipoprotein cholesterol in plasma, without the use of the preparative ultracentrifuge // Clin Chem. 1972; 18: 499–502.
-
Gutman A. B. Views on the pathgenesis and management of primary gout // J. Bone Joint. Surg. 1972; 54 A: 357–372.
-
Abbott R. D., Brand F. N., Kannel W. B., Castelli W. P. Gout and coronary heart disease: the Framingham Study // J. Clin. Epidemiol. 1988; 41: 237–242.
-
Tan K. C., Chow W. S., Tam S. C. at al. Atorvastatin lowers C-reactive protein and improves endothelium-dependent vasodilation in type 2 diabetes mellitus // J Clin Endocrinol Metab. 2002; 87: 563–568.
-
McCarey D. W., McInnes I. B., Madhok R. et al. Trial of Atorvastatin in Rheumatoid Arthritis (TARA): double-blind, randomised placebo-controlled trial // Lancet. 2004; 363: 2015–2021.
-
Abou-Raya A., Abou-Raya S., Helmii M. Statins potentially useful in therapy of systemic sclerosis-related Raynaud’s phenomenon and digital ulcers // J. Rheumatol. 2008; 35: 1801–1808.
-
Ильиных Е. В., Барскова В. Г., Александрова Е. Н. и др. С-реактивный белок при подагрическом артрите: связь с кардиоваскулярной патологией//Научно-практическая ревматология. 2005;6:33–37
-
Libby P., Ridker P. M., Maseri A. Inflammation and atherosclerosis // Circulation. 2002; 105: 1135–1143.
-
Ridker P. M., Rifai N., Pfeffer M. A. et al. for the Cholesterol and Reccurent Events (CARE) Investigators. Long-term effects of pravastatin on plasma concentration of C-reactive protein // Circulation. 1999; 100: 230–235.
-
Попкова Т. В., Алекберова З. С., Александрова Е. Н., Насонов Е. Л. Опыт применения ловастатина (Медостатин) у пациентов с системной красной волчанкой и ревматоидным артримом // РМЖ. 2005; 7 (231): 400–402.
-
Atasoyu E. M., Evrenkaya T. R., Solmazgul E. Possible colchicine rhabdomyolysis in a fluvastatin-treated patient // The Annals of Pharmacotherapy. 2005; 39: 1368–1369.
-
Francis L., Bonilla E., Soforo E. Fatal toxic myopathy attributed to propofol, methylprednisolone, and cyclosporine after prior exposure to colchicine and simvastatin // Clin. Rheumatol. 2008; 27: 129–131.
-
Justiniano M., Dold S., Espinoza L. R. Rapid onset of muscle weakness (rhabdomyolysis) associated with the combined use of simvastatin and colchicine // J. Clin. Rheumatol 2007; 13 (5): 266–268.
-
Alayti G., Cengis K., Canturk F. et al. Acute myopathy in a patient with concomitant use of pravastatin and colchicine // Ann Pharmacother. 2005; 39 (7–8): 1358–1361.
-
Chen S. Y., Chen C. L., Shen M. L. et al. Trends in the manifestations of gout in Taiwan // Rheumatology (Oxford). 2003; 42: 1529–1533.
-
Emmerson B. Hyperlipidemia, in hyperuricaemia and gout // Ann. Rheum. Dis. 1998; 57; 509–510.
-
Wyngaarden J. B., Kelley W. N. Gout and hyperuricemia. 1976; 574.
М. С. Елисеев, кандидат медицинских наук В. Г. Барскова, доктор медицинских наук Е. Н. Александрова, доктор медицинских наук Л. Н. Кашникова, кандидат медицинских наук Е. Л. Насонов, доктор медицинских наук, профессор, академик РАМН Учреждение РАН НИИ ревматологии РАМН, Москва
