Лечащий Врач #5, 2009
Патогенетические аспекты гнездной алопеции и способы их коррекции с использованием лазерной терапии
Научные данные последних десятилетий свидетельствуют о важности иммунных нарушений в патогенезе гнездной алопеции (ГА). Отмечена также связь ГА с некоторыми заболеваниями, в развитии которых особое значение имеют патологические изменения в иммунной системе: витилиго, аутоиммунный тиреоидит [1, 2, 6, 7].
Эффективность применения иммуносупрессивной терапии с использованием системных и топических глюкокортикостероидов подтверждает участие иммунных механизмов в патогенезе ГА [4, 6].
В настоящее время накоплен достаточный опыт изучения роли иммунологических изменений в патогенезе ГА. Данные научных исследований противоречивы, однако их результаты позволяют предполагать непосредственное участие неспецифического клеточного звена иммунитета в патогенезе ГА.
Большинство авторов считают природу ГА аутоиммунной. Согласно определению V. Praise, профессора дерматологии Калифорнийского медицинского университета, ГА — аутоиммунное заболевание, характеризующееся образованием воспалительного клеточного инфильтрата вокруг волосяных фолликулов (ВФ), состоящего из CD8+- и CD4+-лимфоцитов, макрофагов и клеток Лангерганса.
ГА имеет острую, подострую и хроническую стадии, для каждой из которых характерна своя специфическая иммуногистохимическая картина. Известно, что на ранней стадии повреждение детерминируется тучными клетками и макрофагами, затем появляются лимфоциты Th1, Th2, а на хронической стадии преобладает реакция Th1-лимфоцитов, которые формируют воспалительные инфильтраты вокруг ВФ [3, 4, 5]. S. Kawamura и соавт. в результате проведенных исследований полагают, что Т-клетки инфильтрата вступают во взаимодействие с перифолликулярными или фолликулярными антигенпрезентующими клетками, в результате чего продуцируется интерферон-гамма (ИФН-гамма), который лишает клетки кожного сосочка способности поддерживать анагенный рост волос [18]. Известно, что ИФН-гамма индуцирует антигены HLA-DR на кератиноцитах, экспрессия которых определяется на эпителиальных клетках фолликулов, что подтверждает участие иммунной системы в патогенезе ГА [10, 11, 12, 13, 14, 15, 16, 17].
Tobin и соавт. сообщили о выявлении антител к фолликулам пигментированных волос при иммуноблоттинге плазмы крови всех пациентов, страдавших ГА, по сравнению с 44% частоты этого явления в популяции здоровых лиц. В другом исследовании Tobin и соавт. было показано, что уровень антител к различным структурам волос, находящихся в фазе анагена, при ГА существенно выше, чем предполагалось ранее, по сравнению с контрольной группой (исследование проводилось путем непрямой иммунофлуоресценции). Была отмечена гетерогенность иммунного ответа антител на структуры ВФ у пациентов, страдающих ГА, что связано с выработкой разных антител к разным группам структур волоса. Аналогичные явления наблюдались в отношении таких структур волоса, как наружная оболочка корня, матрикс, внутренняя оболочка корня и корень волоса.
ВФ имеет собственную иммунную систему, отличную от систем окружающей его кожи. Клеточные компоненты иммунной системы ВФ состоят из межфолликулярных Т-лимфоцитов и клеток Лангерганса, которые расположены исключительно в дистальной части наружной оболочки корня, а также из перифолликулярных тучных клеток и макрофагов. Фолликулы волос человека могут выступать в качестве резервуаров клеток Лангерганса. Эпителий проксимальной части волос, находящихся в фазе анагена, участвует в иммунных реакциях, в то время как внутренняя оболочка корня волос не участвует. Именно этот иммунологический локус поражается при гнездной алопеции. Недавняя теория происхождения ГА, предложенная Paus и соавт., свидетельствует о нарушении регуляции MHC-антигенов и/или снижении регуляторных механизмов локальной иммуносупрессии (меланин-стимулирующего гормона, адренокортикотропина и трансформирующего фактора роста), что позволяет иммунной системе распознать антигены иммуноположительных ВФ и начать атаку, лежащую в основе развития ГА.
Имеются данные о позитивном влиянии на данные иммунопатологические процессы в дерме эксимерного лазера 308 нм (Пинсон И. Я, 2006; Ткаченко С. Б., 2007).
В связи с этим целью нашей работы стало изучение эффективности эксимерного лазера с длиной волны 308 нм при терапии ГА.
Все больные получали лечение методом фототерапии УФБ-лучами с использованием ксенон-хлоридного эксимерного лазера с длиной волны 308 нм. Главное преимущество данного вида фототерапии в том, что лазер монохроматичен, действует одной длиной волны 308 нм в цель на один выбранный хромофор. Лазер генерирует высокоинтенсивное излучение до 4000 мДж/см2, что является необходимым условием для эффекта гибели патологических клеток в перибульбарном инфильтрате.
Длина импульса составляет 30 наносекунд, что способствует процессу иммуномодуляции и отсутствию термических эффектов. Частота импульсов достигает 143 Гц. Система доставки излучения представлена оптоволоконным кабелем длиной 2 м и насадкой со сменными наконечниками. Площадь светового пятна — 3,2 см2.
В лазере XTRAC имеется четкая термическая дозировка 3 мДж/см2 за один импульс, учет количества импульсов, суммарное количество энергии за один сеанс и за весь курс лечения, что обеспечивает безопасность и контроль.
XTRAC имеет программное обеспечение, позволяющее производить облучение как единичных очагов поражения, так и больших поверхностей. Аппарат снабжен компьютерными программами, которые разрешают работать в трех режимах, разных скоростях и гарантируют равномерность распределения энергии без перекрытий и пропусков, четко дозируя суммарную энергию на каждом участке.
Лазерная допплеровская флоуметрия (ЛДФ) признана дерматологами и используется для изучения дерматозов (склеродермии, липоидного некробиоза, красного плоского лишая). Метод ЛДФ не применялся ранее для оценки состояния кожной микроциркуляции при ГА.
Для определения микроциркуляции в коже больных ГП и оценки эффективности лечения проводилось изучение микрогемодинамики в очагах поражения до и после лечения.
Для решения поставленной задачи нами был использован метод ЛДФ, который основывается на зондировании ткани лазерным излучением и последующей регистрации излучения, отраженного от подвижных и неподвижных компонентов ткани. Отраженное от статических (неподвижных) компонентов ткани лазерное излучение не изменяет своей частоты, а отраженное от подвижных частиц (эритроцитов) — имеет допплеровское смещение частоты относительно зондирующего сигнала. Переменная составляющая отраженного сигнала, пропорциональная мощности спектра допплеровского смещения, определяется концентрацией эритроцитов в зондируемом объеме и их скоростью. Регистрируемый при ЛДФ сигнал характеризует кровоток в микрососудах в объеме 1–1,5 мм3 ткани. Это значит, что ЛДФ дает интегральную информацию по очень большому количеству эритроцитов, около 3,4×104, одновременно находящихся в зондируемом объеме крови. Таким образом, ЛДФ предназначена для неинвазивного измерения скорости движения крови в капиллярах и диагностики состояния микроциркуляции в тканях и органах при различных патологических процессах. Для проведения ЛДФ использовался лазерный анализатор микроциркуляции крови компьютеризованный «ЛАКК-02». Расчеты производились на компьютере по программе записи и обработки параметров микроциркуляции крови. В ходе исследования регистрировали и рассчитывали следующие показатели ЛДФ сигнала: среднее значение показателя микроциркуляции (ПМ) и его среднеквадратическое отклонение (σ).
Под нашим наблюдением за период с 2005 по 2008 год находилось 67 пациентов с ГА в возрасте от 4 до 65 лет, в том числе 5 детей 8–14 лет. Отмечена давность заболевания: до 3 лет — у 18 больных, более 3 лет — у 49.
Лечение проводилось в виде монотерапии. Фотопроцедуры на очаги облысения назначались по методике двух- и трехразового облучения в неделю после определения минимальной фотоэритемной дозы (MФЭД).
Обработка очагов проводилась с помощью эксимерного лазера со следующими характеристиками: длина волны 308 нм, плотность энергии во время экспозиции 50–1200 мДж/см2, продолжительность импульса 0,5–20 с, диаметр светового пятна 23×23 мм. В зависимости от типа кожи (по Фитцпатрику) дозу УФБ увеличивали в 1,5–2 раза по сравнению с МФЭД пациента, но не более, что позволяло избегать побочных эффектов.
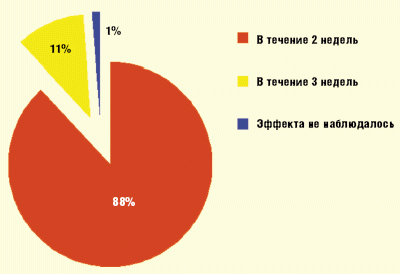
В результате проведенного лечения у 59 пациентов (88%) в течение первых двух недель терапии отмечалось сокращение зоны «расшатанных» волос, что свидетельствует об остановке прогрессирования заболевания. У 4 пациентов (11%) этот процесс растянулся на 3 недели, у одного пациента (1%) эффекта не наблюдалось (рис. 1). Рост волос отмечался через 3 недели терапии у 55 пациентов (82%), у 7 пациентов (10%) рост волос отмечался на четвертой неделе терапии. У пяти пациентов (7%) роста значительного количества волос не было (отмечался рост единичных депигментированных волос). Почти у всех 58 пациентов с положительной динамикой (86,5%) отсутствовали рецидивы заболевания в течение трех лет (времени наблюдения), у 4 пациентов рецидив возник через период от 2,5 до 3 лет, но очаги облысения имели значительно меньшие размеры.
В среднем для получения терапевтического эффекта требовалось от 10 до 25 процедур в течение от 5 недель до 1,5 месяцев с суммарной дозой УФБ 296–315 нм от 50 мДж/см2 до 1200 мДж/см2, при этом выявлялась обратная связь между дозой УФБ и количеством процедур (чем выше была разовая доза, тем меньшее количество сеансов проводилось).
В результате проведенного лечения в группе пациентов микроциркуляция возросла в 3,4 раза (рис. 2).
Таким образом, лечение ГА с помощью эксимерного лазера является современным высокоэффективным методом, преимуществом которого можно считать хорошую переносимость, снижение риска побочных эффектов, отсутствие облучения здоровых участков кожи, минимальный риск канцерогенеза благодаря локальному воздействию и относительно низкой суммарной дозе облучения, не требуется применение фотосенсебилизаторов. Метод особенно рекомендован при ограниченных формах ГА. В результате проведенного лечения в очагах выпадения волос усиливается микроциркуляция, что свидетельствует о нормализации процесса.
И. В. Верхогляд, кандидат медицинских наук
РМАПО, Москва
