Лечащий Врач #5, 2009
Иммунотерапия генитальной папилломавирусной инфекции
Генитальная папилломавирусная инфекция (ПВИ) является одной из самых частых инфекций, передаваемых половым путем (ИППП). Только в США ею поражено около 20 млн и ежегодно заражается 5,5 млн человек [16]. Чрезвычайная опасность и важная социальная значимость этой инфекции обусловлена ее этиологической ролью в развитии практически всех случаев рака шейки матки, около 50% других раков аногенитальной области, а также целого ряда разновидностей злокачественных новообразований верхних дыхательных путей и кожи [18, 23].
В России, где официально регистрируются лишь случаи аногенитальных (венерических) бородавок, интенсивный показатель заболеваемости ими, составивший в 2004–2005 гг. 32,9–32,1 случая на 100 тысяч населения, свидетельствует об эпидемическом характере распространенности этой категории ПВИ [5]. В то же время, даже с учетом 10-кратного роста регистрируемой за последние 10 лет заболеваемости ПВИ [7], эти цифры не отражают масштабов ее истинной распространенности. Во многом это связано со сложностью диагностики субклинических и латентных форм инфекции.
При половом заражении вирус папилломы человека (ВПЧ) чаще всего приводит к развитию аногенитальных бородавок, классической формой которых являются остроконечные кондиломы — доброкачественные мягкие папилломатозные разрастания, расположенные, как правило, в аногенитальной области и обычно обусловленные ВПЧ 6 и 11 и реже другими, в том числе высокоонкогенными, типами ВПЧ. В целом же не менее 35 типов ВПЧ (16, 18 и др.) вызывают дисплазию и рак половых органов (шейки матки, вульвы, влагалища, полового члена), гортани и заднего прохода [3].
Пик частоты ВПЧ-инфекции гениталий приходится на 18–25 лет — возраст наивысшей половой активности. После 30 лет ее распространенность снижается, но существенно возрастает частота дисплазий и рака шейки матки, причем пик частоты последнего приходится на 45 лет.
К числу важных в эпидемиологическом и клиническом отношении особенностей ПВИ-инфекции, наряду с ее нередким субклиническим течением, относится длительность инкубационного периода (от нескольких месяцев до нескольких лет), что также существенно затрудняет ее диагностику и лечение [11].
ВПЧ относятся к подгруппе А семейства паповавирусов (Papovaviridae). Вирионы не имеют оболочки, диаметр их равен 50–55 нм. Геном представлен двуспиральной кольцевидно скрученной ДНК, включает около 8000 основных пар и кодирует всего 8 открытых рамок считывания. В процессе репликационного цикла геном вируса экспрессирует от 8 до 10 белковых продуктов. Ранние белки (early), контролирующие репликацию вируса, транскрипцию и клеточную трансформацию, кодируются онкопротеинами Е6 и Е7. Поздние белки (late) L1 и L2 кодируют структурные белки вириона. Белок L1 формирует капсомеры. Белки Е1 и Е2 регулируют репликацию вирусной ДНК и экспрессию генов. Онкогены Е6 и Е7 всегда выявляются в опухолевых клетках, зараженных ВПЧ, в то время как другие фрагменты вирусного генома могут быть утеряны в процессе его длительной персистенции.
В инфицированных эпителиальных клетках на начальных стадиях вирусный генетический материал персистирует в эписомальной форме, при этом клетка способна продуцировать вирусные частицы. На более поздних стадиях геном вируса интегрирует в клеточный геном, и способность к репродукции вируса утрачивается. Интеграция вирусной ДНК в клеточную может индуцировать несколько важных событий. Во-первых, она часто сопровождается потерей вирусного материала, при этом обязательно обеспечивается сохранение генов Е6 и Е7; во-вторых, независимо от делеций вирусный геном в интегрированной форме не способен к полной репликации; в-третьих, индуцируется нестабильность клеточного генома. Так, показано, что в канцерогенез шейки матки вовлечены определенные участки хромосом, что указывает на множественность генетических нарушений в опухолевой клетке. При интеграции вирусного генома в клеточный не только сохраняется транскрипция вирусных генов, прежде всего Е6 и Е7, но и активируется транскрипция некоторых клеточных генов.
Обнаружениe существенных различий в спектре синтезируемых этой опухолью РНК указывает на разнообразие генетических механизмов, вовлеченных в процесс канцерогенеза, обусловленного ВПЧ. В частности, белки Е6 и Е7 могут инактивировать белки-супрессоры опухолевого роста р53 и рRb105 соответственно. Кроме того, указанные онкобелки влияют на некоторые белки-циклины и циклин-зависимые киназы, являющиеся регуляторами цикла деления клетки [15, 22].
В настоящее время доказано, что ВПЧ является онкогенным вирусом, связанным не только с цервикальными и аногенитальными раками, но и с плоскоклеточным раком гортани, предстательной железы, кожи [1] и др. (особенно на фоне иммуносупрессии).
Чаще всего в ткани генитальных опухолей обнаруживаются ВПЧ 6, 11, 16, 18, 31, 33, 35, 41, 42, причем у одного больного может быть несколько типов ВПЧ одновременно. ВПЧ инфицирует пролиферирующие эпителиальные клетки базального слоя эпителия через механические, бактериальные и другие микроповреждения.
Репликация ДНК ВПЧ происходит только в клетках базального слоя, поэтому методы лечения, направленные на удаление поверхностного слоя эпидермиса, неэффективны и сопровождаются рецидивом заболевания. Инфицированные клетки базального слоя служат постоянным источником инфицирования эпителиальных клеток, проходящих затем последовательные стадии дифференцировки с персистирующим, репликативно неактивным вирусом.
После инфицирования ВПЧ в клетках эпидермиса нарушается нормальный процесс дифференцировки, особенно это касается клеток шиповатого слоя, в котором наблюдается клональная экспансия инфицированных ВПЧ клеток базального слоя, прошедших только первичную стадию дифференцировки. Эта клональная экспансия связана с их трансформацией и последующей иммортализацией. Трансформация и иммортализация клеток эпидермиса контролируется генами ВПЧ, кодирующими ранние (early) белки Е6 и Е7. При этом наблюдается деформация внутренних слоев эпидермиса и утолщение кожи, а клетки шиповатого слоя при переходе в зернистый оказываются наиболее активными в синтезе ДНК. Эта фаза жизненного цикла ПВИ включает второй этап репликативной дессиминации вируса внутри эпидермиса, в результате чего значительно поражается зернистый слой эпидермиса, при отсутствии экспрессии поздних (late) генов L1 и L2. Последняя, как показано, наступает на конечной стадии дифференцировки в ороговевающем слое, где и наблюдается активная сборка зрелых вирусных частиц, их выделение из клетки и почкование прямо на поверхности кожи. Именно эти участки кожи инфекционно опасны в отношении контактного заражения.
Иммунный ответ хозяина играет важную роль в предотвращении клинической манифестации ВПЧ-инфекции. ВПЧ вызывает как гуморальный, так и клеточный типы иммунного ответа. Клеточный иммунитет, особенно Т-клеточная иммунная система, играет основную роль как в персистенции очагов ПВИ, так и в их спонтанном регрессе, который имеет место в 90% случаев и может наступить через 6–8 месяцев после начала заболевания.
Роль иммунных нарушений в патогенезе ВПЧ-инфекции подтверждается данными о более высокой частоте ВПЧ-ассоциированных заболеваний у реципиентов трансплантата внутренних органов [12] и ВИЧ-инфицированных [20], обнаружении нарушения Т-клеточного иммунитета у больных с генитальными бородавками, снижении количества клеток Лангерганса в очагах цервикальной интраэпителиальной неоплазии, а также большим количеством CD4+ и CD8+ Т-лимфоцитов в инфильтрате регрессирующих генитальных бородавок [21], предотвращении ВПЧ-инфицирования экспериментальных животных и развития у них опухолевого процесса после иммунизации неструктурными белками ВПЧ (Е6 и Е7) [14].
Важная роль клеточного звена иммунитета в патогенезе ВПЧ-инфекции также подтверждается данными о полной ремиссии ВПЧ-ассоциированных заболеваний после специфической стимуляции Т-клеточного иммунного ответа на гиперэкспрессию онкобелков Е6 и Е7 (гиперэкспрессия онкобелков Е6 и Е7 на клеточной поверхности возникает при интеграции ВПЧ в геном клетки) [8, 19].
В этой связи важно отметить, что онкобелки Е6 и Е7 довольно иммуногенны, хорошо распознаются Т-лимфоцитами и проявляют свой эффект через формирование комплексов со специфическими белками — р53 и Rb, которые обычно выполняют в клетке противоопухолевую функцию. У вирусов с высоким онкогенным потенциалом комплексы Е6-р53 и Е7-Rb более стабильны, а инфицированные вирусом клетки неотвратимо становятся раковыми.
Клинически выделяют 4 типа генитальных бородавок.
- Остроконечные кондиломы — наиболее частая разновидность генитальных бородавок. Это мягкие папилломатозные фиброэпителиальные разрастания, по внешнему виду напоминающие цветную капусту, часто с мацерированной поверхностью, поражающие, как правило, слизистые оболочки (головка полового члена, наружное отверстие уретры, внутренний листок крайней плоти, малые половые губы, вход во влагалище, шейка матки, анус и анальный канал), реже — ороговевший эпителий (пах, промежность, перианальная область). На слизистых оболочках они более плоские. При гистологическом исследовании роговой слой состоит из паракератотических клеток, зернистый слой отсутствует. Эпидермис в состоянии акантоза и резко выраженного папилломатоза с утолщением и удлинением ветвящихся эпителиальных выростов; характерна вакуолизация верхних слоев эпидермиса. Дерма резко отечная, сосуды ее расширены; отмечаются очаговые воспалительные инфильтраты. В ряде случаев остроконечные кондиломы могут трансформироваться в гигантскую кондилому Бушке–Левенштейна.
- Кератотические бородавки — папулы, имеющие роговой вид и часто напоминающие цветную капусту или себорейный кератоз, обычно располагающиеся на коже ствола полового члена, мошонки, половых губ, паховых складок.
- Папулезные бородавки — куполообразные папулы диаметром от 1 до 4 мм с гладкой поверхностью (менее роговой, чем кератотические), имеющие цвет сырого мяса и располагающиеся на коже, покрытой полностью ороговевшим эпителием.
- Плоские бородавки — пятнистые элементы или слегка приподнятые папулы, обычно невидимые невооруженным глазом, располагающиеся на фоне частично или полностью ороговевшего эпителия.
Без лечения генитальные бородавки могут спонтанно инволюцировать (в 90% случаев), длительно персистировать или увеличиваться в размере и количестве, трансформируясь в рак (10%). Рак in situ без лечения переходит в инвазивный рак в 36% случаях за 3,8–5,7 года [18]. С меньшей частотой спонтанной инволюции подвергаются более длительно существующие очаги поражений. Отсутствие спонтанной инволюции генитальных бородавок также может быть связано с повторным инфицированием новыми типами ВПЧ. Реинфекция же одним и тем же типом ВПЧ встречается не часто, возможно благодаря приобретенному иммунитету.
Прогноз генитальных бородавок зависит от типа обусловливающих их ВПЧ, сопутствующих заболеваний (включая ИППП). Если ВПЧ 16 обычно приводит к развитию плоскоклеточного рака, то ВПЧ 18 — к развитию аденокарценомы шейки матки — формы рака с очень плохим прогнозом. Плохим прогностическим фактором является и молодой возраст пациентки [10].
Для выявления ВПЧ-инфекции чаще всего применяются молекулярно-генетические методы: неамплификационные (дот-блот, саузерн-блот гибридизация, гибридизация in situ на фильтре и ткани) и амплификационные (ПЦР и HC-анализ (Hybrid Capture)). При сравнении эффективности методов цервикальной цитологии и ПЦР в обнаружении ВПЧ-инфекции установлено, что ПЦР-метод является более чувствительным, чем цитологический.
В то же время ценность ВПЧ-типирования в клинической практике все еще не совсем ясна. Во всяком случае, положительные результаты не являются определяющими в предсказании исхода этой инфекции. Это связано как с возможностью технических ошибок при выявлении ВПЧ высокого риска, так и с необходимостью тщательного наблюдения за лицами с обнаруженными у них ВПЧ среднего и высокого риска, поскольку клинические и гистологические признаки ВПЧ-инфекции развиваются через 1–8 месяцев после первоначальной экспозиции вируса и даже нелеченные элементы могут регрессировать спонтанно, длительно существовать как доброкачественные или прогрессировать в предраковые поражения и рак.
Для использования в скрининге и мониторинге терапии тестирования на ДНК ВПЧ и для уверенности в надежности результатов используемый тест должен отвечать ряду требований. Это выявление широкого спектра генотипов ВПЧ высокого онкогенного риска (не менее 10 высокораспространенных) и невыявление низкоонкогенных типов ВПЧ, снижающих специфичность исследования. Кроме того, важной задачей ВПЧ-теста является возможность определения вирусной нагрузки. При этом выявление вируса в количестве, не превышающем порогового, имеет малое клиническое значение, так как говорит о высокой вероятности спонтанного излечения. При этом как положительные должны учитываться только случаи вирусной нагрузки, превышающей порог. В то же время при послеоперационном мониторинге введение порога неоправданно, поскольку выявление вируса даже с низкой нагрузкой может быть маркером рецидива [9].
Несмотря на то, что генитальные бородавки редко персистируют, а тем более увеличиваются в размере и количестве и обычно регрессируют спонтанно, выраженный онкогенный потенциал целого ряда типов ВПЧ, особенно в условиях иммуносупрессии, ставит проблему лечения генитальных бородавок в разряд весьма актуальных проблем современной медицины.
Исходя из биологических особенностей ПВИ, помимо удаления генитальных бородавок большое внимание должно быть уделено лечению субклинической и латентно протекающих ВПЧ-инфекций. Кроме того, решающее значение для предотвращения рецидива и приостановления процесса канцерогенеза имеет элиминация ВПЧ.
В настоящее время эффективность различных методов лечения генитальных бородавок, даже с учетом проведения повторных курсов, составляет 60–80% [13]. Рецидивы в 25–50% случаев наступают в течение первых трех месяцев после лечения и чаще всего обусловлены реактивацией вируса.
Поскольку в большинстве случаев больные с генитальными бородавками страдают и другими ИППП, их половые партнеры должны быть также соответствующим образом обследованы, в том числе на ВПЧ и ВИЧ-инфекции. Лечение генитальных бородавок, как и других ИППП, следует проводить обоим половым партнерам, причем в период его проведения им следует воздерживаться от половой жизни. После окончания лечения необходима барьерная контрацепция в сроки до 6 месяцев.
При разработке стратегии лечения важно учитывать возраст больного, локализацию, количество элементов, площадь очагов поражения, частоту рецидивов, наличие сопутствующей соматической патологии (в том числе урогенитальных инфекций), переносимость метода лечения, а также клинический опыт врача.
Наиболее часто применяются следующие методы лечения остроконечных кондилом.
1. Физические методы:
- криодеструкция;
- электрокоагуляция;
- лазерная вапоризация.
2. Химическая цитодеструкция:
- подофиллотоксин;
- Подофиллин;
- трихлоруксусная кислота.
3. Антивирусная и иммуномодулирующая химиотерапия:
- Цидофовир;
- имиквимод;
- интерфероны (ИНФ) альфа-2 и гамма;
- блеомицин;
- фторурацил;
- ретиноиды.
4. Фотодинамическая терапия:
- с внутривенным применением фотосенсибилизатора;
- с местным применением фотосенсибилизатора.
В большинстве случаев бывает достаточно криодеструкции, электрокоагуляции, лечения лучами лазера или фотодинамической терапии (ФДТ).
При распространенном, рецидивном процессе более эффективна комбинация местного и общего лечения. При этом обычно вначале проводится деструктивное лечение. Затем, в связи с тем, что латентная стадия жизненного цикла ВПЧ протекает в клетках базального слоя эпидермиса и физическими методами очаг поражения трудно удалить полностью (ДНК ВПЧ могут быть на расстоянии до 1 см от видимых границ опухоли), сразу после регенерации эпидермиса, во избежание рецидива, осуществляется противовирусная терапия препаратами ИНФ или кремом имиквимод. В случае рецидива применяют антивирусные и иммунотропные препараты.
Все ИНФ эффективны в отношении ВПЧ. При остроконечных кондиломах их применяют (инъекции внутрь очага или системно) в качестве терапии резерва, особенно при отсутствии эффекта от общепринятой терапии. ИНФ — это цитокины первой фазы иммунного ответа, обладающие антивирусными, антипролиферативными и иммуностимулирующими свойствами благодаря способности усиливать цитотоксическую активность Т-лимфоцитов и стимулировать их способность уничтожать клетки с измененной антигенной структурой.
Как известно, большинство вирусов индуцирует синтез ИНФ (альфа и бета), обладающих выраженной противовирусной и иммуномодулирующей активностью. В клинической практике при лечении ВПЧ-ассоциированных заболеваний широко используется ИНФ альфа-2.
Внутриочаговые инъекции под основание генитальных бородавок проводят препаратами ИНФ альфа-2 в дозе 5 млн МЕ 3 раза в неделю в течение 3 недель. ИФН применяют также с целью предварительной терапии крупных очагов поражения для уменьшения их площади перед деструктивным методом, а также с целью профилактики рецидивов [17].
Необходимо отметить техническую трудность проведения местного обкалывания генитальных бородавок, выраженный гриппоподобный синдром при парентеральном введении ИНФ, а также выраженную болезненность при проведении таких манипуляций.
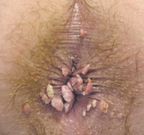 Подобных недостатков лишен препарат рекомбинантного ИНФ альфа-2 Виферон. В его состав входят мембраностабилизирующие препараты — антиоксиданты — витамины Е и С в терапевтически эффективных дозах. Это усиливает противовирусную и иммуномодулирующую активность препарата в 10–14 раз по сравнению с препаратом ИНФ альфа-2b Реафероном [2]. Применение его позволяет снизить суточную дозу ИНФ при однократном введении и пролонгировать его действие. Лекарственная форма препарата — ректальные суппозитории — также обеспечивает уменьшение побочных реакций, характерных для парентерального введения препаратов ИНФ, таких как повышение температуры, гриппоподобный синдром, и, кроме того, придает препарату новые фармакокинетические свойства: при сравнении титров ИНФ в сыворотке крови здоровых добровольцев при внутривенном, внутримышечном и ректальном с антиоксидантами введении рекомбинантного ИНФ альфа-2b отмечено, что при введении 1 млн МЕ ИНФ ректально титр ИНФ в сыворотке крови превышал таковой при внутривенном или внутримышечном введении 2 млн МЕ ИНФ [4]. Существенно, что даже при длительном применении Виферона (в течение 2 лет) не образуется антител, нейтрализующих антивирусную активность ИНФ альфа-2b [6].
Подобных недостатков лишен препарат рекомбинантного ИНФ альфа-2 Виферон. В его состав входят мембраностабилизирующие препараты — антиоксиданты — витамины Е и С в терапевтически эффективных дозах. Это усиливает противовирусную и иммуномодулирующую активность препарата в 10–14 раз по сравнению с препаратом ИНФ альфа-2b Реафероном [2]. Применение его позволяет снизить суточную дозу ИНФ при однократном введении и пролонгировать его действие. Лекарственная форма препарата — ректальные суппозитории — также обеспечивает уменьшение побочных реакций, характерных для парентерального введения препаратов ИНФ, таких как повышение температуры, гриппоподобный синдром, и, кроме того, придает препарату новые фармакокинетические свойства: при сравнении титров ИНФ в сыворотке крови здоровых добровольцев при внутривенном, внутримышечном и ректальном с антиоксидантами введении рекомбинантного ИНФ альфа-2b отмечено, что при введении 1 млн МЕ ИНФ ректально титр ИНФ в сыворотке крови превышал таковой при внутривенном или внутримышечном введении 2 млн МЕ ИНФ [4]. Существенно, что даже при длительном применении Виферона (в течение 2 лет) не образуется антител, нейтрализующих антивирусную активность ИНФ альфа-2b [6].
При лечении эндоуретральных кондилом используют ежедневные инстилляции ИФН альфа-2 в дозе 25 млн МЕ в течение 6 недель и с цитологическим контролем через 2 и 6 недель после окончания курса лечения, а затем — каждые 3 месяца в течение года. Рецидив служит показанием к проведению повторного курса лечения [17].
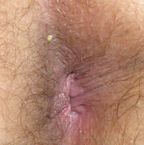 По нашему мнению, для лечения эндоуретральных кондилом наиболее оправдано использование геля Виферон. Основной компонент препарата — человеческий рекомбинантный ИНФ альфа-2 обладает выраженным противовирусным действием. Природный антиоксидант — витамин Е и его синергисты — бензойная и лимонная кислоты, метионин — способствуют стабилизации клеточных мембран, обладают ранозаживляющим действием. Гелевая основа обеспечивает пролонгацию воздействия препарата, а вспомогательные вещества — стабильность специфической активности и надлежащую микробиологическую чистоту препарата.
По нашему мнению, для лечения эндоуретральных кондилом наиболее оправдано использование геля Виферон. Основной компонент препарата — человеческий рекомбинантный ИНФ альфа-2 обладает выраженным противовирусным действием. Природный антиоксидант — витамин Е и его синергисты — бензойная и лимонная кислоты, метионин — способствуют стабилизации клеточных мембран, обладают ранозаживляющим действием. Гелевая основа обеспечивает пролонгацию воздействия препарата, а вспомогательные вещества — стабильность специфической активности и надлежащую микробиологическую чистоту препарата.
Под нашим наблюдением находилось 18 пациентов (12 мужчин и 6 женщин) с диагнозом «остроконечные кондиломы аногенитальной области». Возраст пациентов варьировал от 19 до 38 лет и в среднем составлял 24,7 года. Для идентификации типа ВПЧ в каждом случае проводилась ПЦР, необходимо отметить, что наиболее часто выявлялись ВПЧ 6, 11, 31 и 33 типов, при этом в группе женщин из 6 пациенток у 5 был выявлен ВПЧ 6 типа. Все пациенты ранее неоднократно проходили лечение по поводу остроконечных кондилом с применением различных методов деструкции: электрокоагуляция, криодеструкция, лазерная вапоризация и др. В среднем количество рецидивов составляло 2,8, при этом средний межрецидивный период составлял 2,1 месяца и ни в одном случае его продолжительность не превышала 4 месяцев.
Всем пациентам проводился 14-дневный курс терапии ректальными суппозиториями Виферон по 3 млн МЕ в сутки, местно применялся гель Виферон. На 15 день проводилась деструкция новообразований методом электрокоагуляции, после чего рекомендовалось продолжить применение ректальных суппозиториев Виферон по 1 млн МЕ в сутки в течение еще 15 дней. Ближайшие результаты лечения в каждом случае были хорошими (рис. 1, 2). В период наблюдения в течение не менее 8 месяцев рецидивов заболевания не было ни в одном случае. Особо необходимо отметить хорошую переносимость применявшихся препаратов, поскольку побочных эффектов или осложнений также не наблюдалось.
Полученные результаты позволяют рассматривать Виферон как эффективный препарат для иммунотерапии ВПЧ-ассоциированных генитальных неоплазий и рекомендовать его широкое внедрение в практику специалистов.
Литература
- Давыдов М., Демидов Л., Поляков В. Современное состояние и проблемы онкологии // Врач. 2007. № 13. С. 3–7.
- Деленян Н. В., Ариненко Е. Н., Мешкова Е. Н. и др. Виферон. Руководство для врачей / Под ред. В. В. Малиновской. М., 1997.
- Дмитриев Г. А., Биткина О. А. Папилломавирусная инфекция. М.: Медицинская книга. 2006.
- Джуминго П. А. ИНФообразование и продукция специфических антител в процессе комбинированной терапии реафероном и антиоксидантами у больных простым рецидивирующим герпесом / Дисс… канд. мед. наук. М., 1990.
- Евстигнеева Н. П. Папилломавирусная инфекция урогенитального тракта женщин: эпидемиология, факторы персистенции, оптимизация ранней диагностики и профилактики онкогенеза / Автореф. дис..докт. мед. наук. М., 2007.
- Ершов Ф. И. Система ИНФа в норме и при патологии. М., Медицина, 1996.
- Киселев В. И. Вирусы папилломы человека в развитии рака шейки матки. М.: Димитрейд График Групп, 2004.
- Киселев В. И., Киселев О. И. Вирусы папилломы человека в развитии рака шейки матки. С.-Пб, М., 2003.
- Куевда Д. А. Современная концепция диагностики папилломавирусной инфекции. Тез. докл. Межрегиональной научно-практической конференции «Дерматовенерология в период реформирования здравоохранения и реализации национальных проектов». Екатеринбург, 22–23 мая 2007. C. 112–113.
- Мазуренко Н. Н. Роль вирусов папилломы в канцерогенезе шейки матки // Современная онкология. 2003. № 1. С. 7–10.
- Allen A. L., Siegfried E. C. What’s new in human papillomavirus infection // Curr Opin Pediatr. 2000; 12: 365–369.
- Benton С., Shahidullah H., Hunter J. A. A. Human papillomavirus in the immunosuppressed // Papillomavirus Rep. 1992. Vol. P. 23–26.
- Berman B., Ramires C. C. Anogenital warts / Treatment of Skin Disease / Compehansive therapeutic strategies / Ed. M. G. Lebwohl et al. 2 nd ed. 2006. Mosbi. P. 47–49.
- Brandsma J. L. Animal models for HPV vaccine development // Papillomavirus Rep. 1994. Vol. 5. P. 105–111.
- Greenfield I., Cutill S. Antivirals / Human papillomavirus. Clinical and scientific advances / Ed. J. C. Sterling & S. K. Tyring-london: Arnold. 2001. P. 1120–1130.
- Kirnbauer R., Lenz P., Okun M. M. Human papilllomavirus In Dermatology / Ed. J. L. Bolognia et al. Edinburg-Mosby. 2002. P. 1217–1234.
- Koutsky L. A., Kiviar N. B. Genital human papilomavirus. In: Sexual Transmitted Diseases / Ed. K. K. Holmes et al. 3 rd ed. Mc. Growhill., New York, 1999. P. 347–360.
- Munoz N. Human papillomavirus and cancer: the epidemiological evidence // J. Clin. Virol. 2000. Vol. 19. P. 1–90.
- Munger K., Howley P. M. Human papillomavirus immortalization and transformation functions // Virus Res. 2002. Vol. 89. P. 213.
- Palefski J. M. Anal sguamous cell intraepithelial lesions: relation to HIV and human papillomavirus infection // J. Acquir. Immun. Defic. Syndr. 1999. Vol. 21 (Suppl.). Р. 42–48.
- Tagami H. Regression phenomenon of numerous Hat wars — An experiment on the nature of tumor immunity in man // Int. J. Dermatol. 1983. Vol. 22. P. 570–571.
- Wiley D. J., Douglas J., Beutner K. et al. External gеnital warts: diagnosis, treatment? And prevention // Clin. Inf. Dis. 2002. Vol. 35. P. 210–224.
- Zur Hauzen H. Papillomavirus infection- a major cause of human cancer // Byochem. Biophys. Acta. 1996. Vol. 1288. F. 55–78.
А. В. Молочков, доктор медицинских наук, профессор
МОНИКИ им. М. Ф. Владимирского, Москва
