Лечащий Врач #6, 2009
Иммунонаправленная терапия детей с хроническими заболеваниями органов пищеварения
В настоящее время практически невозможно разделить такие функции желудочно-кишечного тракта, как переваривание пищи и иммунная защита [7, 18, 19, 22]. Вместе с микрофлорой кишечника эти компоненты являются основой здоровья ребенка и гарантией его нормального развития [2, 4, 24].
Пристеночный слой слизи в кишечнике содержит большое количество секреторного IgA. Этот комплекс защищает слизистую оболочку от дегидратации макромолекул, физической и химической агрессии, а также от воздействий микроорганизмов, бактериальных токсинов и паразитов [6, 9, 15]. Это первое звено в каскаде реакций организма на повреждающие воздействия [25, 26].
Известно, что поджелудочная железа играет ведущую роль в осуществлении и регуляции сложных процессов переваривания [1, 3, 5, 12]. Принципиально важно, что содержимое желудочно-кишечного тракта, смешанное с пищеварительными соками, формирует поступление в организм не только нутриентов и регулирующих пептидов, но и поток антигенов [10, 14, 23]. По-видимому, это обусловливает хронизацию воспалительных процессов верхних отделов пищеварительного тракта и проявление вторичного иммунодефицита в виде инфекционного или аллергического синдромов [11, 13].
В последнее время работами некоторых исследователей доказано, что широко распространенное среди детей хроническое инфицирование вирусами из группы герпеса (вирус простого герпеса (ВПГ), цитомегаловирус (ЦМВ)) и внутриклеточной флорой (хламидии) на фоне транзиторного снижения иммунитета затрудняет своевременное становление ферментной обеспеченности пищеварительных процессов и иммунной защиты слизистых оболочек ребенка.
Вовлеченность поджелудочной железы в патогенез хронических воспалительных процессов верхних отделов пищеварительного тракта доказана многими исследованиями. Установлено, что нарушение морфофункционального состояния поджелудочной железы в виде реактивного панкреатита отмечается у каждого третьего ребенка с функциональными нарушениями пищеварительного тракта, у половины детей с билиарной дисфункцией и у всех детей с хроническим гастродуоденитом.
Совокупность реактивных нарушений ферментативной, моторной и абсорбционной функции желудочно-кишечного тракта ведет к нарушению переваривания нутриентов в просвете кишки, синдрому избыточного роста бактерий, способствует развитию дисбиоза кишечника с комплексом сопутствующих нарушений и усугублением иммунологической недостаточности (рис.). На этом фоне возможно возникновение нейроэндокринных расстройств, нарушение деятельности калликреин-кининовой системы, синтеза катехоламинов и защитных антител, гиперпродукция IgE. Перегрузка иммунной системы кишечника в результате всех этих процессов вызывает локальный недостаток IgA, что, в свою очередь, может привести к развитию заболеваний кишечника, дыхательных путей, атопии [17].
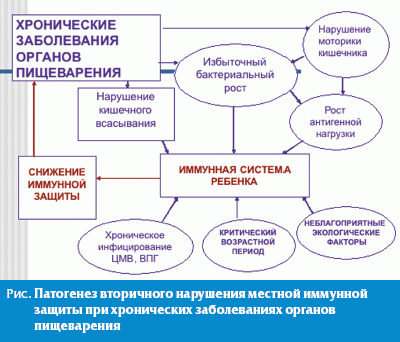
Возможно, совокупность этих факторов оказывает влияние на формирование патоморфоза хронических заболеваний органов пищеварения, который проявляется, в частности, вовлечением в патологический процесс многих органов и систем, высокой частотой аллергического синдрома и сопутствующими иммунными нарушениями.
В связи с этим в настоящее время все большее внимание исследователей привлекают средства, нормализующие нарушения функций регуляторных биологических систем, в первую очередь, иммунной, которые способны скорректировать проявления болезни еще на функциональном уровне и не допустить развитие сочетанной органической патологии.
Учитывая необходимость неагрессивной и многонаправленной коррекции иммунного статуса у детей с хроническими заболеваниями верхних отделов пищеварительного тракта, наше внимание привлек оригинальный отечественный иммуномодулирующий препарат Кипферон® суппозитории для вагинального или ректального введения. Кипферон® представляет собой композицию из комплексного иммуноглобулинового препарата (КИП), содержащего иммуноглобулины классов IgG, IgA, IgM и человеческого рекомбинантного интерферона альфа-2. Воздействие компонентов препарата обуславливает возникновение мощного терапевтического эффекта со стимуляцией местного и общего иммунитета, эффективно устраняет очаги воспаления и восстанавливает нормальную микрофлору [8, 14, 21].
Высокая эффективность, безопасность, а также сочетаемость Кипферона® с любыми лекарственными средствами была многократно доказана в исследованиях, посвященных острой инфекционной патологии [9, 20]. Важными характеристиками этого иммуноориентированного препарата является отсутствие риска активной специфической стимуляции иммунной системы ребенка [16].
В педиатрическом отделении Московского областного научно-исследовательского клинического института им. М. Ф. Владимирского (МОНИКИ) проведена работа по оценке эффективности применения препарата Кипферон® в лечении детей с хроническими заболеваниями верхних отделов пищеварительного тракта.
Под нашим наблюдением находилось 47 детей в возрасте от 3 до 14 лет. Методом слепой выборки было сформировано две группы. В основную группу вошли 24 ребенка с хроническими заболеваниями желудочно-кишечного тракта. Группу сравнения составили 23 ребенка. Дети из обеих групп были сопоставимы по возрасту и структуре заболеваний. Всем пациентам была назначена традиционная терапия: диета, антациды, ферментная терапия, спазмолитики, витамины и микроэлементы, про- и пребиотики.
Дети основной группы, дополнительно к стандартной схеме лечения, получали Кипферон® в течение 10 дней. Пациенты до 12 лет — по 1 свече 2 раза в сутки, старше 12 — 3 свечи в сутки, per rectum. Препарат назначался при наличии информированного согласия родителей, зафиксированного в истории болезни.
Обследование детей из обеих групп проводилось до и после курса лечения согласно протоколу. Частота встречаемости сочетанного поражения органов пищеварения и признаки вторичного иммунодефицита в обеих группах сравнивалась с группой здоровых детей. По данным амбулаторных карт проводилась оценка анамнеза, предъявляемых жалоб, наличие инфицирования цитомегаловирусом, вирусом простого герпеса и хламидиями, выраженность инфекционного синдрома, состояние иммунной защиты.
Клиническая характеристика обследуемых групп
Более чем у половины наблюдаемых детей был зарегистрирован отягощенный перинатальный анамнез: гипоксически-ишемическое поражение ЦНС в родах, стремительные роды. Частота перинатального инфицирования (наличие IgG к ЦМВ, ВПГ I–II типов и хламидии) составила более 40%.
Около трети обследованных за последние три месяца перенесли более трех эпизодов острой респираторной инфекции, причем у каждого третьего течение респираторной инфекции осложнялось (отит, бронхит, обструктивный синдром). При осмотре у всех часто болеющих детей отмечалась полилимфаденопатия. Признаки вегетососудистой дистонии были выявлены у 20% детей.
Частота клинических признаков транзиторного иммунодефицита была достоверно выше в группе детей с патологией органов желудочно-кишечного тракта по сравнению со здоровыми детьми.
У четверти детей отмечались жалобы на периодические боли в животе, достоверно не связанные с приемом пищи. Почти во всех случаях они сочетались с жалобами на тошноту, снижение аппетита, чувство быстрого насыщения, изжогу, отрыжку, метеоризм.
Анализ полученных данных показал, что при хронической патологии органов пищеварения у детей достоверно чаще встречаются маркеры нарушения функций эндокринной и нервной систем: вегетососудистая дистония и эндемический зоб.
Лабораторное исследование включало клинический и биохимический анализ крови, копрограмму. Иммунологическое обследование состояло из определения уровня иммуноглобулинов, циркулирующих иммунных комплексов, показателей фагоцитоза и субпопуляций Т-лимфоцитов. Было проведено микробиологическое исследование кала на флору. Всем детям проводилось ультразвуковое исследование органов брюшной полости. Функциональные возможности поджелудочной железы определялись с помощью методики расчета постпрандиального коэффициента, разработанной в педиатрической клинике МОНИКИ (патентное изобретение «Способ диагностики панкреатита» № 2163464 от 27.02.2001, Г. В. Римарчук с соавт.). Постпрандиальный коэффициент представляет собой соотношение суммы размеров поджелудочной железы после пищевой нагрузки к сумме таких же показателей натощак. Прирост суммы линейных размеров поджелудочной железы через один час после пищевой нагрузки менее 5% соответствует хроническому панкреатиту, показатели коэффициента от 6% до 15% характеризуют реактивный панкреатит, коэффициент выше 15% является нормальной реакцией поджелудочной железы. Постпрандиальная оценка проводилась после приема стандартного завтрака.
При первичном лабораторном исследовании в копрограмме у всех детей с хроническим поражением органов пищеварения была зарегистрирована амилорея, нейтральный жир в небольшом количестве, наличие дрожжевых грибов рода Сandida, большое количество слизи, лейкоцитов.
В биохимическом анализе крови в 12% наблюдений отмечалось значительное снижение уровня сывороточного железа, что косвенно свидетельствовало о нарушении кишечного всасывания. У каждого третьего ребенка гликемия была больше 5,5 ммоль/л, что было расценено как признак нарушения инкреторной деятельности поджелудочной железы.
Иммунологическое исследование выявило у 18% детей снижение показателя IgA (при норме 0,8–3,7 г/л показатель не достигал 0,75 г/л), у 6% отмечалось снижение количества IgG. Отмечалась тенденция к снижению количества В-лимфоцитов и повышению общего IgE.
При ультразвуковом исследовании щитовидной железы практически у каждого второго ребенка (41%) было отмечено ее увеличение.
Показатели постпрандиального коэффициента при ультразвуковом исследовании поджелудочной железы у всех детей соответствовали реактивному панкреатиту.
У каждого третьего наблюдаемого (33%) при микробиологическом исследовании выявлены нарушения микробиоценоза: присутствие кишечной палочки с измененными ферментативными свойствами, энтерококков, грибов рода Сandida, отсутствие бифидо- и лактобактерий.
Динамика клинических симптомов на фоне приема Кипферона®
Исчезновение диспептических расстройств и жалоб на боли в животе отмечалось у большинства детей как на фоне применения традиционного лечения, так и у получавших Кипферон®. Следует отметить, что в основной группе число детей с исчезновением диспептических явлений стало значимым (p < 0,001) (таблица).
Средняя прибавка массы тела после курса лечения Кипфероном® превысила аналогичный показатель в группе сравнения вдвое. Нормализация постпрандиального коэффициента у детей основной группы регистрировалась значимо чаще (p < 0,001) (таблица). Увеличение объема поджелудочной железы после лечения Кипфероном® диагностировано за счет размера головки. Уменьшение признаков реактивного воспаления характеризовалось уменьшением отека, нормализацией размера панкреатического протока. В группе сравнения признаки реактивного панкреатита сохранялись.
Разная реакция отделов поджелудочной железы обусловлена, по-видимому, особенностями эмбрионального развития поджелудочной железы с формированием отдельной иннервации, кровоснабжения и путей лимфооттока.
Таким образом, у всех обследованных детей с хроническими воспалительными заболеваниями верхних отделов желудочно-кишечного тракта отмечены нарушения структурно-функционального состояния поджелудочной железы. Дисферментия, сопутствующая патологии поджелудочной железы, дисбиоз кишечника, нарушения кишечного всасывания и моторики, отраженные в клинической картине, являются факторами, которые отрицательно влияют на систему местного иммунитета. Это приводит к формированию патологического замкнутого круга, преодоление которого требует применения принципиально новых препаратов.
На фоне Кипферона® существенно улучшился процесс пищеварения у детей основной группы. Положительные сдвиги в копрограмме характеризовались уменьшением стеатореи и амилореи. На фоне комплексного лечения у детей основной группы исчезли условно-патогенные микроорганизмы, грибы рода Candida, что, по-видимому, внесло определенный вклад в нормализацию физиологических процессов пищеварения (p < 0,001) (таблица).
Учитывая, что состав пристеночного слоя слизи, содержащего иммуноглобулин А и кишечную микрофлору, регулирует поступление антигенов в организм ребенка и определяет местную иммунную защиту, представляется целесообразным включение комбинированного иммунобиологического препарата Кипферон® в стандарт базисной терапии хронических воспалительных заболеваний верхних отделов желудочно-кишечного тракта.
По вопросам литературы обращайтесь в редакцию.
Г. В. Римарчук, доктор медицинских наук, профессор
Л. И. Васечкина, кандидат медицинских наук
Т. К. Тюрина, кандидат медицинских наук
В. В. Кривоусова
МОНИКИ им. М. Ф. Владимирского, Москва
Таблица. Динамика клинических симптомов на фоне приема Кипферона®
