Лечащий Врач #08, 2009
Современный взгляд на проблему диагностики, прогноза и лечения алкогольного гепатита
Алкогольная болезнь печени (АБП) — это заболевание, характеризующееся значительным распространением в популяции, имеющее важное социальное значение, вследствие значительного числа трудопотерь, приводящее к циррозу печени (ЦП) и гепатоцеллюлярной карциноме.
Нередко течение этой болезни может заканчиваться фатальным исходом. Например, в такой стране, как Шотландия, летальность от АБП превышает сердечно-сосудистую смертность. Кроме этого, отмечен рост частоты алкогольных поражений печени, в том числе и цирроза, в таких странах, как Япония, Китай, Индия, которые традиционно отличались низким потреблением алкоголя [8, 9].
В России подробное изучение этого вопроса является проблематичным, прежде всего, вследствие сложностей учета и искусственного занижения истинной заболеваемости всех болезней алкогольной этиологии. Оценка косвенных данных свидетельствует, что среди всей выборки терапевтических пациентов, поступающих на стационарное лечение, алкогольный фактор является основной или сопутствующей причиной не менее чем у 40% больных [12, 13, 14].
Среди причин ЦП алкоголь рассматривают как один из основных этиологических факторов во всем мире. Так, более 80% случаев ЦП у больных в госпиталях США, а также у пациентов в Российской Федерации обусловлены чрезмерным потреблением спиртных напитков [5, 6, 7]. При этом только за период 2000–2005 годов частота алкогольной этиологии в общей структуре заболеваемости ЦП возросла почти на 16%, тогда как вследствие инфекции гепатитом С только на 10% [2, 4].
В рамках нозологии АБП выделяют три основные формы — алкогольный жировой гепатоз (ЖГ), алкогольный гепатит (АГ) и алкогольный ЦП. Естественное течение АБП (К70) — это процесс, описываемый исключительно с морфологической точки зрения как прогрессирование от ЖГ (К70.0) через фиброз (К70.2) к ЦП (К70.3) и дальше к финальной стадии заболевания — гепатоцеллюлярной карциноме (С22.0).
В отношении гепатита до настоящего момента клинические и классификационные критерии не определены. Так, естественное течение АГ имеет двоякую оценку. Его можно рассматривать как стадию между алкогольным стеатозом и алкогольным фиброзом или как событие, наслаивающееся на любой стадии АБП. Поэтому рядом авторов данный этап заболевания описывается в виде двух форм: острого АГ (ОАГ) и хронического или алкогольного стеатогепатита (АСГ) [4, 11, 16, 17, 18].
АСГ — это морфологический диагноз стеатоза и АГ с наличием или отсутствием лабораторных эквивалентов поражения печени. В тех случаях, когда при этой форме заболевания стадия фиброзных изменений в печени не превышает F2, клинические проявления, сопряженные с фиброзными процессами, отсутствуют. Картина хронического заболевания печени, как правило, появляется при фиброзе не менее F3 (по METAVIR).
Понятие хронического АСГ в целом подчеркивает регулярность присутствия этиологического фактора, подобно хроническим вирусным гепатитам. Считается, что полная абстиненция может приводить к исчезновению морфологических элементов АГ в течение одного года в 90% случаев, хотя на практике данное положение не является абсолютно доказанным.
ОАГ — это договорное понятие, которое, несмотря на наличие определенных критериев, было предложено в противовес хроническому.
Кроме указанных форм отдельно выделяются:
-
острая алкогольная интоксикация (от F10.0 — неосложненной до F10.7 — с патологическим опьянением);
-
отравление алкоголем-этанолом (Т51.0);
-
прием алкоголя в повреждающих дозах (F10.1);
-
алкогольная зависимость (F10.2).
Выделение АГ в самостоятельную нозологическую форму обусловлено прежде всего тем, что — в своих тяжелых формах — заболевание имеет высокую летальность, в особенности тогда, когда парциальность нарушений распространяется на белково-синтетическую функцию печени с выпадением синтеза некоторых белков, лабораторным эквивалентом чего является снижение протромбинового времени (ПВ). В действительности страдает не только синтез протромбина, но и других быстро обновляемых белков, просто данный показатель легкодоступен и удобен для практического использования. В целом диагностика у пациентов риска высокой летальности является высокоприоритетной в научных и прикладных аспектах АГ.
В клиническом течении АГ выделяют три пика летальности. Это ранняя летальность — в течение первого месяца, промежуточная летальность — 1–6 месяцы и отдаленная летальность — 6–12 и более месяцев.
При этом до настоящего времени продолжают изучаться вопросы безопасных доз алкоголя, особенности патогенеза, а также подходы к терапии АГ.
Безопасное количество алкоголя
Количество употребляемого алкоголя, принятое считать безопасным, вызывает множество споров. По рекомендациям ВОЗ безопасным считается прием 21 единицы алкоголя в неделю для мужчин и 14 — для женщин. Единица или порция алкоголя равна 30 граммам 40% напитка (водка), 100 граммам 9–11% (сухое вино) и 200 граммам 3–5% (пиво) [15]. Употребление указанной дозы в течение 5 лет, а тем более ее превышение сопряжено с развитием алкогольного ЦП с вероятностью 50%. Если имеет место систематическое смешивание различных по крепости алкогольных напитков (алкогольные коктейли) в рамках одних суток, то условный риск ЦП возрастает еще на 20%. В тех случаях, когда крепкие алкогольные напитки сочетают с пивом, дополнительный риск увеличивается еще на 30%.
Существует, однако, и альтернативная информация. Так, в случае, когда сухое натуральное вино составляет более 30% от всего употребляемого в год алкоголя, в рамках, не превышающих допустимые дозы, условный риск ЦП с 50% снижается до 14%. Если сухое вино составляет более 50% употребляемого в год алкоголя, риск ЦП не превышает 5% [1, 16].
Патогенез АГ
По фармакологическим свойствам этанол обладает способностью взаимодействовать со многими компонентами клеток, изменяя работу медиаторных систем и текучесть мембран гепатоцитов. При этом он не является прямым повреждающим агентом в отношении печени, обладая, однако, дозозависимым свойством угнетать деятельность центральной нервной системы, вплоть до развития комы. Агрессивным действием на печень обладают продукты его метаболизма [17, 21, 22, 23].
Механизмы развития АБП и в частности АГ до конца не изучены, однако установлено, что важную роль играют избыточное накопление жира в печени, окислительный стресс и иммуноопосредованное повреждение печени. Патогенез заболевания условно разделяют на две стадии, или, как их называют в литературе, — толчка [21, 22, 24].
I толчок формирования АГ
Алкоголь всасывается в желудочно-кишечном тракте, где происходит его встреча с желудочной алкогольдегидрогеназой (АДГ), далее в гепатоцитах, при активном расходе естественного антиоксиданта глютатиона, он окисляется до ацетальдегида (ААД) при помощи печеночной АДГ. ААД там же метаболизируется до ацетата при участии следующего фермента цепи — ацетальдегиддегидрогеназы (АЦДГ). Ацетат представляет собой жирную кислоту (ЖК), являющуюся предшественником триглицеридов (ТГ). Следует учитывать, что система АДГ-АЦДГ генетически детерминирована на метаболизм строго определенного количества алкоголя, прежде всего за счет ограничения прироста активности АЦДГ. Поэтому в случаях его регулярного поступления в организм в большем количестве активизируются другие, альтернативные пути метаболизма этанола. Вначале эти реакции окисления связаны с образованием никотинамидных коферментов (НАДН и НАД) и повреждением восстановительного потенциала клетки. В целом все это приводит к тому, что ЖК избыточно накапливаются в гепатоцитах с формированием первого этапа заболевания — ЖГ [18, 25].
Данный факт усугубляется тем, что регулярное поступление ААД приводит к нарушению синтеза апо-липопротеидов (Апо-ЛП) класса В, синтезируемых в печени, и витаминов группы В, особенно В12. Витамин В12, в свою очередь, является коферментом ферментной системы, отвечающей за сборку ТГ и Апо-ЛП транспортной формы ЖК — липопротеидов очень низкой плотности (ЛПОНП).
Следует также учитывать факт кишечного дисбиоза, который встречается более чем у 70% населения России. Данное состояние кишечника на первом этапе заболевания сопряжено с нарушенным синтезом Апо-ЛП классов А и С, что в ряде случаев, как независимый фактор, может приводить к формированию ЖГ [26, 27, 28].
II толчок формирования АГ
Развитие второй стадии заболевания сопряжено с активацией альтернативных путей метаболизма этанола и в первую очередь микросомальной системы его окисления (МСО) цитохрома Р-450, в особенности его изофермента CYP 2E1. Указанная система в норме также участвует в обмене примерно 10–15% поступающего алкоголя, однако в организме заложена резервная способность к активации этой системы в несколько раз. В результате работы CYP 2E1 этанол метаболизируется с образованием реактивных форм кислорода (супероксид-анион радикал, Н2О2, синглетный кислород, гидроксил-радикал, алкоксил-радикал, пероксил-радикал, нитроксил-радикал). Появление избыточного количества реактивных фракций кислорода приводит к большому расходу и истощению антиоксидантных систем печени, включающих глютатион, каталазу, супероксиддисмутазу, глутатионпероксидазу [25, 29].
В дальнейшем супероксиды взаимодействуют с липидами, инициируя процессы их перекисного окисления (ПОЛ). Следствием чего является синтез свободных радикалов (молекул водорода и кислорода с неспаренным электроном), усугубляющих оксидативный стресс, что морфологически соответствует проявлениям гепатита [18, 25].
Активация МСО обусловлена генетически запрограммированной реакцией на окисление избыточного жира в организме. Отсутствие при этом локализованной мишени провоцирует повреждение различных жировых компонент клеток, в том числе фосфолипидного слоя мембран. Недостаток свободного пула фосфолипидов, при повышенном расходе и окислении, приводит к формированию их дефицита [18, 25, 29].
Причинами вовлечения МСО в обмен алкоголя являются продолжающееся поступление большего, чем может метаболизировать система АГД-АЦДГ, количества этанола, избыточное накопление ЖК в гепатоцитах, наличие антигенной и токсической атаки печени, присутствующей на фоне кишечного дисбиоза. В качестве элементов гепатотоксичности рассматриваются кишечный эндотоксин, всасывание которого значительно повышается на фоне приема алкоголя, фактор некроза опухоли-альфа (ФНО-альфа) и продукты метаболизма ААД кишечной микрофлорой [18, 25, 30].
Приходится также учитывать способность ААД блокировать систему переносчиков на синусоидальной и каналикулярной мембранах гепатоцита с нарушением механизмов внутригепатоцитарного транспорта по эндоплазматической сети микротрубочек и формированием вначале внутриклеточного, а в дальнейшем и долькового вариантов холестаза [1, 15]. Холестаз сам по себе является независимым фактором прогрессирования АГ и ускоренного формирования фиброза в ткани печени [31, 32].
Дополнительным фактором, усугубляющим нарушения функции печени при АБП, является избыточное отложение железа в гепатоцитах. Это может быть обусловлено дефицитом фолиевой кислоты, увеличивающим абсорбцию железа. Также окислительный стресс приводит к повышению содержания свободного железа в гепатоците [3, 19].
Дальнейший метаболизм ААД происходит в виде его ковалентного связывания с белками с формированием антигенных субстанций. У людей и животных, подвергающихся длительному воздействию этанола, регистрируется постоянная циркуляция антител к подобным субстанциям с формированием аутоиммунного ответа. Модифицированные ААД белки выступают в качестве неоантигенов, провоцируя гуморальный и клеточный иммунный ответ, что приводит к аутоиммунному повреждению печени и системным реакциям [24, 33].
Повышение экспрессии провоспалительных цитокинов — ФНО-альфа, трансформирующего фактора роста-бета, интерлейкинов-1 и 6 (ИЛ) и снижение экспрессии таких противовоспалительных цитокинов, как ИЛ-4, при АГ стимулирует звездчатые клетки печени, которые продуцируют коллаген, способствуя развитию печеночного фиброза и цирроза [1, 24, 33].
Кроме собственно биохимических и иммунологических аспектов патогенеза АГ, при развитии поражения печени имеют значение ее анатомические особенности. Так как пиковое действие АДГ регистрируется в третьей зоне ацинуса, то и концентрация ААД максимально повышена в этой области. Учитывая, что третья зона является наиболее чувствительной к гипоксии, чаще всего наблюдаются повреждения именно данной локализации [3, 5].
Поэтому в целом, в условиях клинической практики, для определения показаний к дифференцированной терапии, развитие иммунных реакций и прогрессирование фиброгенеза печеночной ткани вследствие всего комплекса причин следует рассматривать как III этап прогрессирования АГ.
Сложности диагностики АГ
Диагноз АБП в большинстве случаев основывается на клинических проявлениях, анамнезе, биохимических показателях (гаммаглютамилтранспептидаза (ГГТП), IgA, коэффициент Де Ритиса, билирубин, Фибромакс-тест), данных пункционной гепатобиопсии, при ее возможном проведении. Среди высокоспецифичных, в отношении алкогольной этиологии поражения печени, лабораторных показателей рассматривают углеводдефицитный (десиализированный) трансферрин сыворотки крови (чувствительность — 70–90%) и ацетальдегидмодифицированный гемоглобин (чувствительность — 70–80%), которые, однако, пока недоступны в повседневной клинической практике в нашей стране [1, 3, 16, 17].
АГ, как клинический диагноз, имеет одинаковую точность с биопсией, основывается на вновь появившейся желтухе (или ухудшении общего состояния без желтухи, но с вновь появившейся или прогрессирующей гипербилирубинемией) на фоне более или менее длительного алкогольного эксцесса, нетоксического, но повреждающего печень на любой стадии АБП, а равно как и у «здорового» до данного эксцесса пациента. Оценка алкогольного эксцесса (по длительности, общей дозе, средней дозе в сутки и в неделю) определяется индивидуально в зависимости от стадии заболевания.
Ведущая мировая школа по изучению АБП в Глазго выделяет обязательные и дополнительные диагностические критерии АГ. В качестве обязательных рассматриваются:
-
недавний алкогольный эксцесс;
-
уровень общего билирубина более 80 г/л;
-
активность AсАT более 500 ммольл/л (при AсАT/AлАT > 1,5);
-
исключение других заболеваний печени.
В рамках дополнительных критериев возможно наличие различных клинико-лабораторных признаков хронических заболеваний печени или печеночной декомпенсации, таких, например, как гепатомегалия ± лихорадка ± нейтрофилез, с наличием или отсутствием лейкоцитоза и т. д.
Кроме того, практический интерес представляет соотношение между клиникой и гистологической картиной АГ. Так, только 2/3 больных с клиническими проявлениями АГ имеют морфологические признаки этого заболевания, и, наоборот, 85% пациентов с гистологическими критериями алкогольного поражения печени имеют клинические проявления АГ, которые при этом значительно различаются (табл. 1).
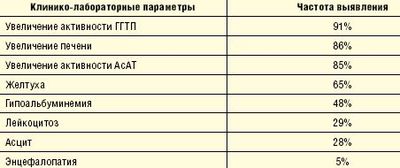
Сенсeтивность лабораторной диагностики АГ зависит от сочетания и выраженности таких признаков, как величина коэффициента Мэддрей (mDF), уровень билирубина, активность АсАТ, АлАТ, уровень ПТ, наличие печеночной энцефалопатии (ПЭ):
-
97% — если mDF ≥ 32 + AсАT ≥ 1,5;
-
80% — если mDF = 32–55;
-
85% — если mDF ≥ 32 + ПЭ;
-
95% — если билирубин ≥ 85 + энцефалопатия;
-
95% — если билирубин ≥ 85 + AлАТ ≤ 30;
-
98% — если билирубин ≥ 100;
-
100% — если билирубин ≥ 80 + ПТ > 2 секунд.
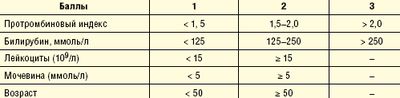
При этом mDF является расчетным показателем (табл. 2).
![]()
Таким образом, по мнению авторов, АГ — это поражение печени, возникающее на любом этапе АБП, при длительном (от 3 дней до 12 недель), частом (возможно ежедневном) употреблении нетоксических (для данного пациента), но оказывающих повреждающее на печень действие доз этанола, как правило, при фоновой зависимости/пристрастии к нему, характеризующееся высокой ранней, промежуточной и поздней летальностью при обязательном наличии двух печеночных синдромов на момент постановки диагноза: желтухи и гипопротромбинемии.
В своем течении АГ может протекать молниеносно, остро, подостро, хронически, на фоне полной алкогольной абстиненции или продолжающего потребления алкоголя.
Правила формулировки диагноза в принципе могут соответствовать принятым критериям при вирусных гепатитах, с возможным добавлением степени стеатоза, например: гепатит алкогольной этиологии, а далее:
-
умеренная активность (10 баллов по МETAVIR или А2 по Фибро-тесту);
-
умеренный фиброз (2 балла по МETAVIR или F2 по Фибро-тесту);
-
умеренный стеатоз (по данным УЗИ или по Брулит или S2 по Фибромакс-тесту).
Прогноз АГ
М. Мэддреем был разработан вариант дискриминантного анализа для прогноза больных АГ. Эта функция была предложена и используется в первую очередь в клинических исследованиях эффективности глюкокортикоидной терапии (ГКС) для разделения больных на группы. При определении mDF, значения ПТ и уровня билирубина независимы друг от друга и тесно коррелируют с ранней летальностью, являясь ключевыми переменными в расчете mDF. Сочетание величины mDF более 32 с ПЭ повышает вероятность летального исхода более 50%. Однако вариабельность измерения ПТ в различных медицинских центрах и высокая смертность у больных с числом менее 32 заставляет искать другие альтернативные методы оценки выживаемости больных АГ.
ChildMayo Endstage Liver Disease (MELD) как шкала была предложена для больных, подвергшихся декомпрессионной терапии по поводу портальной гипертензии. Ее отличие в том, что она является результатом ретроспективного анализа данных с отсутствием субъективных методов оценки функции печени. MELD рассчитывается на основе показателей ПТ, креатинина и билирубина. Все эти факторы были установлены в исследовании Мэддрея, но, в отличие от mDF, MELD позволяет проводить постоянную оценку функции печени и включает такой показатель, как уровень креатинина — маркер гепаторенального синдрома (ГРС). Шкала MELD была адаптирована для оценки выживаемости у больных с тяжелыми хроническими заболеваниями печени, а три ретроспективных исследования доказали ее адекватность числу Мэддрея в оценке выживаемости у больных с алкогольным поражением. Одно из исследований продемонстрировало, что она более информативна в оценке выживаемости у пациентов с АГ в первую неделю госпитализации. Полученный результат может отражать тот факт, что у больных с высокой вероятностью летального исхода в первые недели госпитализации чаще всего происходит ухудшение состояния. Учитывая низкую специфичность mDF и трудности в выборе оптимальной точки отсчета при использовании MELD, Forrest с соавт. предложили другую шкалу оценки выживаемости — Glasgow alcoholic hepatitis score (GAHS) (табл. 3).
Используя ретроспективный анализ данных обследования больных АБП, путем пошаговой логистической регрессии были установлены факторы, связанные с летальным исходом. При сравнении GAHS с mDF было установлено, что первая шкала более точно позволяет оценить риск летального исхода на 28 и 84 день заболевания, она также эквивалентна MELD в оценке риска летальности на 28 день.
Системы оценки риска летального исхода у больных АГ продолжают развиваться. Для практического врача высокая чувствительность подобного рода систем необходима в связи с тем, что их основной задачей является выбор того метода лечения, который был бы наиболее оптимальным у конкретного пациента.
Терапия АГ
Лечение АГ основывается на традиционных принципах, с учетом зависимости от этиологического фактора, наличия фоновых заболеваний и факторов риска.
Основными составляющими терапии являются: режим и устранение провоцирующих факторов, в первую очередь алкоголя, сбалансированная диета, отмена потенциально гепатотоксичных препаратов, коррекция метаболических нарушений, в особенности гиперлипидемии и гипергликемии [2, 3, 17, 21, 34].
В отношении отмены алкоголя перспективными для лечения следует рассматривать пациентов со строгой абстиненцией, ибо в противном случае нельзя исключить продолжение потребления и вероятность взаимодействия лекарственных препаратов с этанолом.
Сбалансированная диета при АГ, кроме исключения тугоплавких жиров и легкоусваиваемых углеводов, предполагает ее насыщение белком, в дозе не менее 1–1,5 грамма на килограмм идеальной массы тела. Кроме того, рекомендуются липотропные продукты, способствующие желчеоттоку (овсяная и гречневая крупы, изделия из творога, нежирные сорта рыбы), а также продукты, содержащие естественные пребиотики и витамины. Также важен суточный калораж пищи. В тех случаях, когда аппетит у пациента снижен и суточный калораж не превышает 1500–2000 кКал, вероятность летального исхода достоверно повышается [35, 36]. Поэтому, особенно в тяжелых случаях, вариантом базисного лечения следует рассматривать энтеральное и парентеральное питание в сочетании с безопасными полиферментными препаратами.
В плане отмены гепатотоксичных лекарств следует обращать внимание, прежде всего, на нестероидные противовоспалительные средства, а также на медленно метаболизирующиеся в печени вещества. Наиболее актуальными из последних являются фармакологические агенты психотропного, антидепрессивного действия, слабительные и целый ряд других средств.
В целом лечение АГ остается одной из важных и нерешенных проблем современной медицины. Бесспорно доказанной по эффективности на сегодняшний день является необходимость отказа от алкоголя, применение же тех или иных препаратов вызывает споры и дискуссии [20, 22, 32].
С учетом патогенеза АГ направлениями терапии являются воздействие на гипериммунный ответ, уровень цитокинов, оксидативный стресс и восстановление глютатиона.
Для коррекции гипериммунного ответа препаратами выбора являются ГКС, хотя их назначение при АГ до сих пор обсуждается. Применение ГКС при АГ обусловлено их блокирующим действием на цитотоксические и воспалительные механизмы развития заболевания. ГКС уменьшают уровень циркулирующих воспалительных цитокинов, таких как TNF-альфа, и приводят к гистологическому улучшению за короткий период [6, 10, 32].
На сегодняшний день проанализировано 12 рандомизированных исследований по изучению эффективности ГКС. В пяти из них было продемонстрировано уменьшение смертности больных АГ, а в семи — таких данных получено не было. Выявленные разночтения были связаны с наличием различных критериев включения, тяжести заболевания, режимов назначения и доз ГКС. В большинстве исследований исключение пациентов производилось из-за развившихся осложнений — желудочно-кишечного кровотечения, инфекций и панкреатита. При этом в двух из них были хорошо продуманные одинаковые критерии включения и схемы терапии ГКС. Их результаты продемонстрировали значительное повышение госпитальной выживаемости на 30 день у больных тяжелым АГ (коэффициент Мэддрей более 32). Метаанализ проведенных научных изысканий подтвердил, что назначение ГКС пациентам с тяжелым АГ снижает смертность, независимо от наличия ПЭ [10, 27, 29].
То есть применение ГКС целесообразно у больных АГ со значением коэффициента Мэддрей более 32, при отсутствии желудочно-кишечного кровотечения и инфекционных осложнений. Критерием эффективности лечения ГКС является динамика снижения билирубина на 25–50% и более после первой недели, что позволяет избежать нежелательных осложнений и изменить терапию при ее неэффективности. Преднизолон рекомендуется использовать в минимально-эффективной индивидуальной дозе — 40–60 мг ежедневно на протяжении 30 дней и более. Если на 7 день лечения у больного не происходит снижение уровня билирубина, рекомендуется прекратить прием ГКС и добавить к лечению пентоксифиллин [10, 27, 29].
Антицитокиновая терапия рассматривается с учетом значимого повышения при АГ цитокинов и в особенности TNF-альфа. В этой связи при тяжелом гепатите к применению рекомендуется пентоксифиллин, который, являясь неселективным ингибитором фосфодиэстеразы, угнетает синтез цитокинов, увеличивая внутриклеточное содержание цАМФ, снижает активность нейтрофилов, подавляет пролиферацию моноцитов и лимфоцитов. Назначение пентоксифиллина по 400 мг три раза в сутки больным тяжелым АГ (коэффициент Мэддрей более 32) в течение 28 дней было связано с достоверным уменьшением летальности и снижением проявлений ГРС по сравнению с группой плацебо. Независимыми предикторами выживаемости в этом исследовании были установлены возраст, уровень креатинина и лечение пентоксифиллином [10, 25].
Кроме того, для терапии оксидативного стресса при атаке АГ используются урсодеоксихолевая кислота, Метадоксил, эссенциальные фосфолипиды (ЭФЛ), адеметионин и другие гепатопротекторы [3, 6, 7, 10, 19].
Урсодеоксихолевая кислота
Обоснованность ее применения у больных АГ продиктована присутствием у данного лекарственного средства доказанного антихолестатического эффекта, необходимость которого определяется наличием у больных АГ желтухи и/или гипербилирубинемии.
Наш собственный опыт лечения АГ получен на основе использования препарата Урсосан. Эффективность этого лекарственного средства связана с его способностью подавлять активность провоспалительных цитокинов и оказывать антихолестатическое действие, обусловленное стимуляцией экзоцитоза путем активации кальцийзависимой альфа-протеинкиназы и снижением концентрации токсичных для печеночной клетки желчных кислот (холевой, литохолевой, дезоксихолевой) [18, 31, 32, 43].
Помимо этого, получены данные о выраженном иммуномодулирующем эффекте Урсосана, снижении уровня ПОЛ и усилении антиоксидантной защиты у больных АГ. Иммуномодулирующая активность препарата связана с уменьшением количества аберрантных антигенов главного комплекса гистосовместимости и возможностью подавления «атаки» иммунокомпетентных Ig и цитотоксичных Т-лимфоцитов на гепатоциты [32, 40].
Среди механизмов действия Урсосана наиболее значимым для больных АГ является его способность встраиваться в мембрану гепатоцита, вызывая стабилизацию ее структуры. Результаты ряда контролируемых исследований указывают на гепатопротективное действие препарата, когда на фоне терапии регистрировалось значительное улучшение лабораторных и морфологических показателей. Урсосан абсолютно сочетается, не взаимодействуя, с другими лекарственными средствами и этанолом, что особенно важно у пациентов, имеющих сопутствующие заболевания и продолжающих употреблять алкоголь [31, 40, 41, 42].
Применение Урсосана имеет особенности в зависимости от этапа АГ. Строго говоря, четкие схемы приема препарата продолжают отрабатываться, но, основываясь на собственном опыте и результатах других исследователей, может быть рассмотрено несколько вариантов.
Так, у больных ЖГ достаточно однократного, через час после ужина, приема препарата в суточной дозе 10 мг/кг, общей длительностью до трех месяцев.
На II этапе заболевания, особенно при наличии признаков внутрипеченочного холестаза, рекомендуется трехкратный прием за 30 минут до еды, в суточной дозе 15 мг/кг. Длительность приема регулируется динамикой нарушений желчеоттока, составляя не менее 6 месяцев.
III этап, сопряженный с аутоиммунными и фиброзными изменениями в печени, требует длительного (6–12 и более месяцев) приема препарата. При этом вначале (3–6 месяцев) это, как правило, трехкратный прием суточной дозы 15 мг/кг, а в дальнейшем возможен переход на поддерживающую дозу 10 мг/кг, с однократным приемом.
Метадоксил
Препарат Метадоксил можно отнести к относительно новым для гепатологии терапевтическим средствам. Данное лекарство формируется в результате образования соли из двух составляющих: пирролидоновой карбоновой кислоты и пиридоксола [44, 45, 46].
Полученные результаты экспериментальных исследований на крысах свидетельствуют о том, что данное лекарственное средство повышает активность АЦДГ и предотвращает снижение активности АДГ при хроническом поступлении этанола. Кроме того, Метадоксил тормозит нарастание содержания сложных эфиров жирных кислот в печени крыс, находящихся под воздействием этанола, восстанавливая баланс между насыщенными и ненасыщенными жирами, то есть предотвращает образование жировой инфильтрации печени. Прием Метадоксила за один час до употребления этанола обеспечивает защиту против истощения запасов глютатиона и окислительно-восстановительной нагрузки в тканях печени [44].
Кроме того, Метадоксил снижает ущерб от ПОЛ, тормозит образование коллагеновых отложений и выделение TNF-альфа в гепатоцитах и звездчатых клетках печени [46, 47].
В исследовании эффективности препарата на здоровых добровольцах при острой алкогольной интоксикации было установлено, что Метадоксил укорачивал период полувыведения этанола с 7 до 4 часов. На фоне его приема быстрее регрессировали симптомы похмелья, ускорялась биотрансформация алкоголя и ААД в менее токсичные кетоны, что сочеталось с улучшением лабораторных показателей (ГГТП, АлАТ, АсАТ, билирубина).
В плане дозирования, лечение начинают с внутривенного, однократного в сутки введения 600–1200 мг препарата, длительностью до 4 недель, с последующим переходом на пероральный прием 1000–1500 мг/сут, продолжительностью до 3 месяцев.
ЭФЛ
ЭФЛ представляют собой очищенную смесь полиненасыщенных фосфолипидов (преимущественно — фосфатидилхолина), которые получают из бобов сои. Использование ЭФЛ восстанавливает дефицит пула фосфолипидов в организме, которые идут в качестве строительного материала для клеточных мембран, поддерживая их текучесть, а также являются мишенью для продуктов ПОЛ, уменьшая проявления окислительного стресса [1, 11, 48].
Кроме того, в экспериментах на бабуинах была показана способность полиненасыщенных фосфолипидов предотвращать развитие фиброза и ЦП. Данный эффект был связан как с мембранно-протективным механизмом, способностью ЭФЛ встраиваться в звездчатые клетки, уменьшая их способность к коллагенообразованию, так и в повышении активности фермента коллагеназы, замедляющей синтез коллагена [1, 15].
Адеметионин играет важную роль в метаболизме нуклеиновых кислот, функции клеточных мембран, является предшественником глутатиона. В опытах на животных назначение адеметионина было связано с повышением уровня глутатиона как при алкогольном поражении, так и при заболеваниях, вызванных другими гепатотоксинами. Анализ проведенных исследований продемонстрировал положительное влияние адеметионина на смертность у больных алкогольным ЦП, однако ни одно исследование не включало больных АГ.
В целом гепатопротекторы, как самостоятельный фармакологический класс, выделяются преимущественно в России. В большинстве западных стран после проведения контролируемых исследований с оценкой летальности многие из них были исключены из активного использования специалистами. В этой связи существует настоятельная необходимость определения позиции врачей, участвующих в лечении данной группы пациентов, в оценке показаний к их применению.
В большинстве случаев данная группа лекарственных веществ используется при наличии ЖГ, небольшой активности гепатита (отсутствии значительного, менее 5 норм, повышения трансаминаз), невысоком коэффициенте Мэддрей (менее 32), отсутствии показаний и наличии противопоказаний к применению ГКС.
Приводимые ниже подходы в лечении пациентов с АГ основаны на собственном опыте, опыте коллег и формальной терапевтической логике, которые используются вкупе при отсутствии конкретных ответов и рекомендаций, базирующихся на результатах контролируемых исследований.
Формирование терапевтического подхода, включающего гепатопротекторы, как правило, основывается на двух принципах. Первый — это определение патогенетической потребности в лекарственном средстве с отвечающим механизмом действия и второй — выбор конкретного препарата, у которого данный эффект максимален. При этом необходимо также учитывать вопросы безопасности и исключения полипрагмазии у указанной категории пациентов [1, 2, 4, 19, 32, 34].
При рассмотрении патогенеза АГ мы конкретизировали основные повреждающие механизмы, на купирование которых направлены гепатопротекторы. Следует отметить, что специалистами уже проводилось сравнение препаратов этой группы (табл. 4) [37, 49].
Как следует из табл. 4, с учетом полуколичественной оценки эффективности гепатопротекторов и их различий, эти препараты также могут быть назначены в зависимости от этапа патологического процесса.
На I этапе наиболее перспективными являются средства, способствующие обратному развитию ЖГ, — урсодеоксихолевая кислота (Урсосан), Метадоксил. Как препараты резерва здесь могут рассматриваться ЭФЛ. Все указанные лекарственные вещества возможно использовать в виде перорального приема. Дополнительно к гепатопротекторам рекомендуется добавление препаратов пребиотического плана [38, 39].
На II этапе средствами выбора являются препараты, обладающие способностью блокировать действие ААД, ПОЛ, восстанавливать запасы глютатиона, мембраны гепатоцитов и желчеотток, разрешая холестаз. При этом к группе первой линии, дополнительно к Метадоксилу, урсодеоксихолевой кислоте (Урсосан), может быть отнесен адеметионин. В отношении использования ЭФЛ существует несколько мнений, не позволяющих, однако, полностью исключить вероятность усугубления холестаза, что предполагает воздержание от их активного использования. На данном этапе АГ терапию целесообразно начинать с парентерального приема лекарственных веществ.
На III этапе первоочередным средством продолжает оставаться урсодеоксихолевая кислота (Урсосан), у которой единственно доказано иммуномодулирующее действие. Возможно также применение ЭФЛ и/или производных Силимарина. Следует отметить, что антифибротическое действие всех указанных лекарственных средств является опосредованным и подтверждено только в экспериментальном плане, преимущественно на животных.
Ограничение использования производных Силимарина на ранних этапах АГ связано с имеющимися данными о метаболизме этих лекарственных веществ, сопряженном с избыточным расходом эндогенного глютатиона.
В целом в качестве рабочей схемы лечения тяжелого АГ (коэффициент Мэддрей более 32) предлагается:
-
преднизолон (при отсутствии противопоказаний) внутрь по 40–60 мг/сут, при снижении на 7 день терапии уровня билирубина на 25% и более продолжение терапии до 30 суток, при отсутствии указанной динамики снижения билирубина отмена ГКС и назначение пентоксифиллина по 1200 мг/сут;
-
Метадоксил 600–1200 мг/сут, внутривенно;
-
адеметионин 800–1200 мг/сут, внутривенно;
-
дезинтоксикационная терапия и поливитаминные комплексы;
-
Урсосан внутрь 15 мг/кг/сут.
При более легком течении АГ (коэффициент Мэддрей менее 32) может быть предложена рабочая схема гепатопротективной терапии (табл. 5).
Таким образом, терапия и прогноз АГ на разных этапах имеют различную направленность. Так, при ЖГ основная терапевтическая задача состоит в профилактике АГ и разрешении стеатоза в печени. Главным направлением лечения является строгая абстиненция и режимно-диетические мероприятия.
На этапе АГ наибольшее значение в плане прогноза имеет выживаемость больных. Причем наличие трех пиков летальности в различные сроки должно отражаться в виде дифференциации терапии заболевания.
На III этапе основная приоритетность лечения состоит в предотвращении развития ЦП. Наиболее важным здесь является использование лекарственных средств с антифибротическим и иммуномодулирующим действием.
Следует отметить, что предложенные подходы комплексного лечения, как и схемы, не лишены недостатков, требуют дальнейшего обсуждения, экспериментальной и практической оценки. Однако, по мнению авторов, они имеет патогенетическую обоснованность и позволяет специалисту самостоятельно определиться с выбором, дозой и длительностью приема соответствующего терапевтического средства.
Литература
-
Буеверов А. О., Маевская М. В., Ивашкин В. Т. Алкогольная болезнь печени // Рус. мед. журн. 2001. Т. 3, № 2. C. 61–64.
-
Сухарева Г. В. Алкогольная болезнь печени //Сonsilium-medicum. Гастроэнтерология. 2003. Т. 5, № 3. С. 26–27.
-
Шерлок Ш., Дули Дж. Заболевания печени и желчных путей: Практич. рук.: Пер. с англ. /Под ред. З. Г. Апросиной, Н. А. Мухина. М.: Гэотар Медицина, 1999. 864 с.
-
Хазанов А. И. Алкогольная болезнь печени // Рос. мед. вести. 2002. № 1. С. 18–23.
-
Блюгер А. Ф., Крупникова Э. З. Хронические диффузные заболевания печени. Л.: Медицина, 1975. 134 с.
-
Collover S., Docrenberg D., Grant B. Trends in Mortality from cirrosis and alcoholism // United States 1945–1983. JAMA. 1986. Vol. 256. Р. 3337–3338.
-
Cumarn W. G., Telkman L. T. Alcoholic fatty liver // Clin. Biochem. 2000. Vol. 4. Р. 879–881.
-
Калинин А. В. Настоящее и будущее клинической гепатологии // Клин. перспективы гастроэнтерол., гепатол. М., 2001. С. 8–14.
-
Огурцов П. П., Покровский А. Б., Успенский А. Е. Эпидемиология алкоголизма // Материалы Всерос. форума «Алкоголь и здоровье населения России 1900–2000». М., 1998. 167–73.
-
Пауков В. С., Беляева Н. Ю., Воронина Т. М. Алкоголизм и алкогольная болезнь // Тер. архив. 2001. С. 65–67.
-
Медведев В. Н., Кораблин Н. И. Алкогольная болезнь печени: диагностика и лечение острого и хронического алкогольного гепатита // Сonsilium-medicum. 2002. Т. 4, № 7. С. 28–34.
-
Иванец Н. Н., Кошкина Е. А. Медико-социальные последствия злоупотребления алкоголем в России // Алкогольная болезнь. Реферативный сборник ВИНИТИ. М., 2000. № 1. С. 3–8.
-
Кошкина Е. А. Эпидемиология алкоголизма в России на современном этапе // Сonsilium-medicum. 2001. Т. 3, № 3. С. 89–92.
-
Маевская М. В. Алкогольная болезнь печени // Consilium medicum. 2001. № 6. С. 256– 258.
-
Маевская М. В. Алкогольная болезнь печени // Клинические перспективы гастроэнтерологии, гепатологии. 2001. № 1. С. 34–36.
-
Окороков А. Н. Диагностика болезней внутренних органов: Т. 1. Диагностика болезней органов пищеварения. М.: Мед. лит., 2000. 560 с.
-
Ильченко Л. Ю. Алкогольный гепатит: клинические особенности, диагностика и лечение // Лечащий Врач. 2007. № 6. С. 14–19.
-
Буеверов А. О. Алкогольная болезнь печени //Сonsilium-medicum. 2002. Т. 4, № 9. С. 23–25.
-
Григорьев П. Я., Яковенко А. В. Клиническая гастоэнтерология. М.: Медицинское информационное агентство, 1998. 647 с.
-
Сюткин В. Е., Шипов О. Ю., Петухова С. В., Иванников И. О. Оптимизация диагностики активного алкогольного гепатита у больных алкогольным циррозом печени // Экспериментальная и клиническая гастроэнтерология. 2003. № 1. С. 133–134.
-
John H. Bloor. Заболевания печени, связанные с приемом алкоголя, алкогольный синдром отмены // Секреты гастроэнтерологии: Пер. с англ. М.: ЗАО «Издательство Бином», 1999. С. 247–68.
-
Афанасьев В. В., Рубитель Л. Т., Афанасьев Л. Т. Острая интоксикация этиловым алкоголем. СПб: Интермедика, 2002. 96 с.
-
Шукит М. Алкоголизм // Внутренние болезни по Тинсли Р. Харрисону: Пер. с англ. — М.: Практика — Мак-Гроу-Хилл (совместное издание), 2002. С. 3039–3045.
-
Никитин И. Г., Байкова И. Е, Гогова Л. М., Сторожаков Г. И. Иммунные механизмы прогрессирования алкогольной болезни печени //Гепатологический форум. 2005. № 4. С. 8–11.
-
Буеверов А. О. Оксидативный стресс и его роль в повреждении печени // Рос. журн. гастроэнтерол., гепат., колопрокт. 2002. № 4. С. 21–25.
-
Акимкин В. Г., Заболотнова Г. И., Антонова Г. К. и др. Микроэкологические нарушения флоры толстого кишечника у больных гастроэнтерологического профиля // Дисбактериозы и эубиотики. М., 1996. С. 1.
-
Митрохин С. Д. Дисбактериоз: современный взгляд на проблему // Consilium medicum. 2000. Т. 2, № 5. С. 144–145.
-
Хавкин А. И. Микробиоценоз кишечника и иммунитет // Рос. мед. журн. 2003. Т. 11, № 3, с. 26–28.
-
Pessayre D. Liver failure and mitochondrial disease. W. F. Balisteri, K. Lindsay, S. Stucker, editors. AASLD 1999 Postgraduate Course. Dallas, 1999. P. 147–157.
-
Астахин А. В., Левитан Б. Н., Дудина О. С. Концентрация фактора некроза опухоли-a при хронических гепатитах // Экспериментальная и клиническая гастроэнтерология. 2003. № 1. С. 122.
-
Подымова С. Д. Внутрипеченочный холестаз: патогенез и лечение с современных позиций // Consilium medicum. 2004. Т. 6, № 2.
-
Надинская М. Ю. Заболевания печени, протекающие с синдромом внутрипеченочного холестаза // Consilium medicum. 2002. Т. 4, № 6.
-
W. Messingham K. A., Faunce D., Kovacs E. J. Alcohol injury and cellular immunity // Alcohol. 2002. № 28. P. 137–149.
-
Хазанов А. И. Алкогольный и неалкогольный стеатогепатит: основные характеристики и принципы лечения // Рос. мед. вести. 2004. № 3. С. 4–12.
-
Блюгер А. Ф., Новицкий И. Н. Практическая гепатология. Рига: Звайне, 1984. 256 с.
-
Логинов А. С., Блок Ю. Е. Хронические гепатиты и циррозы печени. М.: Медицина, 1986. 256 с.
-
Григорьев П. Я., Яковенко Э. П. Клиническая гастроэнтерология. М.: Медицинское информационное агентство. 2004.
-
Теоретическое и практическое обоснование клинического применения препарата Эубикор при заболеваниях органов пищеварения (методическое пособие). СПб, 2002. 28 с.
-
Гриневич В. Б., Успенский Ю. П., Добрынин В. М. и др. Клинические аспекты диагностики и лечения дисбиоза кишечника в общетерапевтической практике. Учебно-методическое пособие. СПб., 2003. 36 с.
-
Надинская М. Ю. Исследование применения урсодеоксихолевой кислоты в гепатологии с позиции медицины, основанной на научных доказательствах // Consilium medicum. Гастроэнтерология. 2003. Т. 5, № 6.
-
Буеверов А. О. Возможности клинического применения урсодезоксихолевой кислоты // Consilium medicum. Гастроэнтерология. 2005. Т. 7, № 6.
-
Beuers U., Boyer J. L., Paumgartner G. Ursodeoxycholic acid in cholestasis: potential mechanisms of action and therapeutic applications // Hepatology. 1998. Vol. 28. Р. 1449–1453.
-
Plevris J. N., Hayes P. C., Bouchier I. A. D. Ursodeoxycholic acid in the treatment of alcoholic liver disease // Eur. J. Gastroenterol. Hepatol. 1991. Vol. 3. 653–656.
-
Метадоксил. Клинико-экспериментальные наблюдения. М., 2005. 38 с.
-
Метадоксил в комплексном лечении острого и хронического отравления алкоголем. Информационное письмо. М., 2003. 12 с.
-
Метадоксил как средство лечения острого и хронического алкоголизма. Обзор //Международный журнал иммунопатологии и фармакологии. 2003. Т. 16, № 3. С. 207–214.
-
А. Диас Мартинес, В. Вильямс Сальцедо, К. Крус Фуэнтес. Эффективность метадоксила при лечении острой алкогольной интоксикации // Журнал международных медицинских исследований. 2002. № 30. С. 44–51.
-
T. Гундерманн К. Й. Новейшие данные о механизмах действия и клинической эффективности эссенциальных фосфолипидов // Клин. перспект. гастроэнтеролог., гепатол. 2002. № 3. С. 21–24.
-
Скворцова Т. Э., Куцевич М. Н., Кудряшова Г. П. Сравнительная оценка эффективности препаратов гепабене и эссливер-форте в лечении жировой дистрофии печени // Экспериментальная и клиническая гастроэнтерология. 2003. № 1. С. 132.
С. Н. Мехтиев, доктор медицинских наук, профессор
В. Ю. Ганчо, кандидат медицинских наук
Ю. А. Кравчук, кандидат медицинских наук
С. В. Карпов
Военно-медицинская академия им. С. М. Кирова, Санкт-Петербург
